miR-1269a表达对H460干细胞样细胞放疗敏感性的影响
姜贻乾,郭庆敏,朱春兰,徐小平,安素红,鲍艳红,苏芳,俞灿炳
杭州市萧山区第一人民医院放疗科,杭州 311200
肺癌是全球最常见的癌症之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%~90%[1]。目前肺癌的主要治疗手段包括外科手术、放射治疗及化学药物治疗等,生物或靶向治疗也可在一定程度上抑制晚期肺癌的进展[2-6]。随着临床上放疗与外科手术的联合使用,NSCLC患者的治疗效果得到了一定改善,但是NSCLC患者的5年生存率仍然较低,主要原因是患者对放疗的敏感性不高,因此寻找放疗增敏剂对提高NSCLC患者的存活率至关重要[7]。微小RNA(miRNA)是一类较短的非编码RNA分子,可通过调节下游靶基因的转录水平而影响癌细胞对放疗的敏感性。癌症干细胞(cancer stem cell,CSC)这一概念由Rudolf Virchow在1858年首次提出,是指存在于癌症细胞中的一小部分具有自我更新、无限增殖及多向分化潜能的细胞,是导致放疗抵抗、耐药性及癌症复发的主要原因[8]。近年来已成功分离鉴定出近10种CSC。业内较为认可的“标志”CSC是流式细胞仪检测的侧群细胞(肿瘤干细胞样细胞)、CD133及CD44阳性的肿瘤细胞[9]。 本课题组前期研究已成功分离、鉴定并扩增了NSCLC H460干细胞样细胞[10]。本研究拟在前期研究的基础上筛选与H460干细胞样细胞放疗抵抗相关的miRNA,并分析其对H460干细胞样细胞放疗敏感性的影响,为开发新型高效的NSCLC放疗增敏剂提供依据。
1 材料与方法
1.1材料与试剂 NSCLC H460细胞株由浙江大学医学院免疫研究所提供并保存。DMEM/F12细胞培养液及牛血清蛋白(BSA)购自美国Gibco公司;重组表皮生长因子(EGF)及碱性成纤维生长因子(bFGF)购自美国PeproTech公司;胰岛素及B27因子购自美国Sigma公司;Trizol试剂盒及LipofectamineTM2000试剂盒购自美国Invitrogen公司;TaqMan miRNA反转录试剂盒购自美国Promega公司;SYBR-Green PCR Master Mix试剂盒购自德国QiaGen公司;CCK-8试剂盒购自日本同仁化学研究所。流式细胞仪(型号:FC500MCL,美国Beckman Coulter公司),多功能酶标仪(型号:SuperMax 3100,中国上海闪谱生物科技公司)。
1.2H460干细胞样细胞的制备 在无血清DMEM/F12培养液中加入EGF、bFGF、胰岛素、BSA、B27及葡萄糖等制备无血清培养液(SFM)。H460细胞经胰酶消化后在SFM中重悬成浓度为1×103个/ml的单细胞悬液,培养瓶竖直放置在37 ℃、5%CO2的培养箱中培养,每天摇晃5次。
1.3H460干细胞样细胞的转染 将H460干细胞样细胞置于DMEM/F12培养基中,在37 ℃、5%CO2培养箱中培养,待细胞融合至80%左右时进行转染。H460干细胞样细胞以5×104个/ml的密度接种于6孔板,严格按照LipofectamineTM2000试剂盒说明书将miR-1269a inhibitor及miR-NC(上海吉玛公司设计并合成)转染至H460干细胞样细胞中,转染48 h后进行后续实验。
1.4H460干细胞样细胞的分选与鉴定 培养的H460细胞形成微球后,收集对数生长期的微球体,用Accutase酶消化并吹打成单细胞,随后使用Hoechst33342孵育微球体,于流式细胞仪中检测细胞中的侧群细胞,当侧群细胞的比例达25%后,收集全部细胞,制备成单细胞PBS悬液。加入荧光标记的单抗孵育,使用流式细胞仪分选CD133及CD44阳性的细胞作为H460干细胞样细胞。
1.5RT-qPCR检测细胞中miRNA的表达 采用Trizol试剂盒提取H460细胞及H460干细胞样细胞的总RNA,用TaqMan miRNA反转录试剂盒反转录RNA,然后用SYBR-Green PCR Master Mix试剂盒以U6为内参照进行RT-qPCR反应。反应条件为:95 ℃ 5 min,95 ℃ 20 s,60 ℃ 30 s,共40个循环。所有引物均由上海吉玛公司设计合成,引物序列见表1。
1.6细胞电离辐射处理 将H460干细胞样细胞使用X线照射处理,放射剂量率均为2.0 Gy/min,在照射时使用0.5 mm的铝过滤器对X线进行过滤。
1.7CCK-8实验检测细胞生长抑制率 收集对数生长期的H460干细胞样细胞,将细胞悬液浓度调整为5×104个/ml后培养至单层细胞铺满96孔板孔底。各组细胞经不同处理后加入10 μl的CCK-8试剂孵育2 h。使用酶标仪检测490 nm处各孔的光密度(OD)值。计算H460干细胞样细胞的生长抑制率。生长抑制率=(1-OD实验组/OD对照组)×100%。各组实验均设置空白对照组,且每组设置3个复孔。
1.8H460干细胞样细胞成球实验检测细胞成球能力 于DMEM/F12培养基中加入EGF、bFGF及B27,并将H460干细胞样细胞置于新配制的DMEM/F12培养基中,在37 ℃、5%CO2条件下培养,每天观察直径大于50 μm的球体并记录其 直径。
1.9流式细胞术检测细胞凋亡率 H460干细胞样细胞经PBS洗3次后,与CD133及CD44抗体共孵育30 min,随后将细胞与FITC共孵育20 min,PBS洗3次后在流式细胞仪上分选H460干细胞样细胞;将各组H460干细胞样细胞消化计数后接种于6孔板,在37 ℃、5%CO2条件下培养24 h后经X线照射处理。细胞继续培养72 h,PBS洗3次,经胰酶消化后制备成细胞悬液,按照Annexin V-PI试剂盒说明书检测各组H460干细胞样细胞的凋亡率。

表1 RT-qPCR反应的引物序列Tab. 1 Primer sequence for RT-qPCR
1.10彗星实验检测细胞内DNA双链断裂情况 将H460干细胞样细胞接种于T25培养瓶中,待细胞融合至80%左右时进行单细胞凝胶电泳,观察H460干细胞样细胞中DNA尾矩变化情况,以评估不同剂量X射线辐射对H460干细胞样细胞DNA双链断裂的 影响。
1.11Western blotting检测细胞内SOX7蛋白表达水平 使用RIPA裂解液提取各组H460干细胞样细胞的总蛋白,在4%~20%的SDS-PAGE凝胶中进行分离。蛋白上样后在250 mA的电流下转膜,5%脱脂牛奶封闭1 h后在蛋白样品中加入一抗SOX7(1:1000)或GAPDH(1:2000),4 ℃下孵育过夜。加入二抗(1:2000)后室温孵育1 h,经ECL试剂显影后拍照 记录。
1.12miR-1269a下游靶基因的预测 采用中山大学生物防治国家重点实验室RNA信息中心研发的ENCORI数据库预测miR-1269a的下游靶基因,并在后续实验中进行验证。
1.13双荧光素酶报告基因实验验证miR-1269a与SOX7的靶向关系 将野生型或突变型SOX7 3'-UTR载入pGL3载体中,并与miR-1269a mimics或miR-1269a inhibitor共转染至H460干细胞样细胞内。转染48 h后使用双荧光素酶报告基因系统分析相对荧光素酶活性。
1.14统计学处理 采用SPSS 22.0软件进行统计分析。定量资料若呈正态分布,以±s表示,在满足方差齐性的条件下,两组间比较采用t检验,多组间比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1H460干细胞样细胞的分选与鉴定 流式细胞仪初次分选时H460细胞株侧群细胞与非侧群细胞所占百分比分别为3.64%±0.27%、96.36%±0.49%,再纯化后H460细胞株侧群细胞与非侧群细胞所占百分比分别为99.24%±0.19%、99.67%±0.42%。于无血清培养基中培养筛选出的H460干细胞样细胞,在光学显微镜下观察发现细胞为圆形或椭圆形,呈球形立体生长,球体饱满,折光性强且形状规则,球内细胞结合紧密,符合干细胞样细胞的基本形态及特征。RT-qPCR结果显示,筛选出的细胞中CD133及CD44 mRNA的表达水平明显增加,分别为H460细胞的(1.30±0.03)倍和(1.19±0.02)倍(P<0.01,图1A)。CCK-8结果显示,筛选出的H460干细胞样细胞的总生长抑制率(44.33%±2.05%)明显低于H460细胞的总生长抑制率(54.00%±2.16%,P<0.05,图1B)。上述结果表明,筛选出的细胞即为H460干细胞样细胞。
2.2H460干细胞样细胞中miRNA的表达情况 RTqPCR检测结果显示,在检测的11种miRNA中有7种在H460干细胞样细胞中的表达较H460细胞下调,分别为miR-30a、miR-148a、miR-148b、miR-152、miR-411、miR-497及miR-598;4种在H460干细胞样细胞中表达上调,分别为miR-424、miR-761、miR-1269a及miR-1280。在上调的4种miRNAs中,miR-1269a在H460干细胞样细胞中的表达量最高,且明显高于其在H460细胞中的表达,差异有统计学意义(P<0.01,图2)。
2.3miR-1269a对H460干细胞样细胞放疗敏感性的调节作用 RT-qPCR检测结果显示,转染miR-1269a inhibitor的H460干细胞样细胞内miR-1269a的表达水平(0.85±0.02)低于转染miR-NC的H460干细胞样细胞(1.01±0.02),差异有统计学意义(P<0.01)。CCK-8实验结果显示,H460干细胞样细胞在转染miR-1269a inhibitor后,其生长抑制率(72.11%±2.45%)明显高于miR-NC组(50.13%±2.16%,P<0.01),且当X线辐射剂量为4 Gy时,H460干细胞样细胞的生长抑制率已超过50%(图3A)。干细胞成球实验结果显示,转染miRNC的H460干细胞样细胞在经过4 Gy的X线辐射处理后的第5天即可形成干细胞球(直径>50 μm),但转染miR-1269a inhibitor的H460干细胞样细胞经过4 Gy的X线辐射处理后的第9天才形成干细胞球。在各组形成干细胞球的3 d后测量干细胞球的直径发现,转染miR-1269a inhibitor的H460干细胞样细胞球的直径为(73.00±2.94) μm,明显小于转染miR-NC的H460干细胞样细胞球的直径[(138.00±7.47) μm],差异有统计学意义(P<0.001,图3B)。流式细胞术检测结果显示,经过4 Gy的X线辐射处理后,转染miR-1269a inhibitor的H460干细胞样细胞的凋亡率为17.70%±0.54%,明显高于转染miR-NC的H460干细胞样细胞的凋亡率(1.90%±0.16%),差异有统计学意义(P<0.001,图3C)。彗星实验结果表明,转染miR-1269a inhibitor会使H460干细胞样细胞在X线辐射处理后DNA尾矩明显增加,在2 Gy的X线辐射处理后尾矩即为miR-NC组的(1.19±0.02)倍,即转染miR-1269a inhibitor使H460干细胞样细胞在X线辐射处理后更易产生DNA双链断裂损伤(P<0.01, 图3D)。

图1 H460干细胞样细胞的分选及鉴定Fig. 1 Sorting and identification of H460 stem cell-like cells
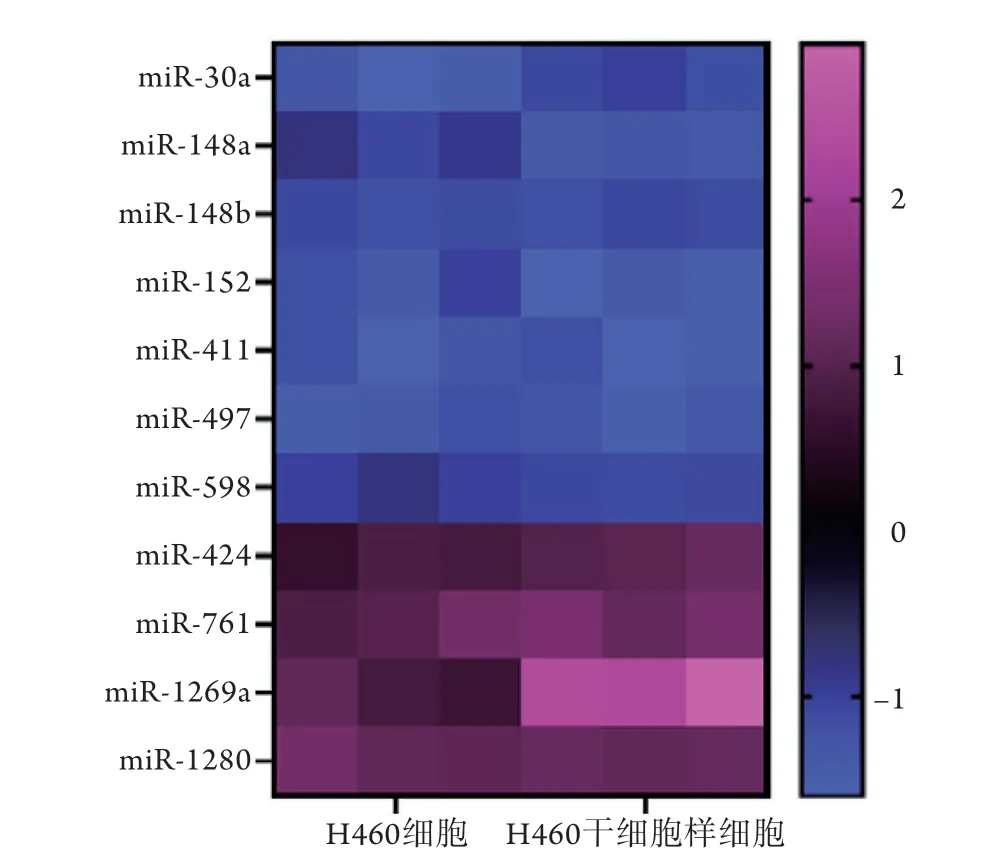
图2 多种miRNA在H460干细胞样细胞及H460细胞中的表达Fig. 2 Expressions of multiple miRNAs in H460 stem celllike cells and H460 cells
2.4miR-1269a增强H460干细胞样细胞放疗敏感性的机制 ENCORI数据库预测结果显示,miR-1269a与SOX7存在部分序列的结合(图4A)。Western blotting结果显示,转染miR-1269a inhibitor的H460干细胞样细胞中SOX7蛋白的表达量明显增加,为miR-NC组的(1.38±0.03)倍(P<0.01,图4B)。双荧光素酶报告基因结果显示,转染miR-1269a mimics会明显抑制野生型SOX7的荧光素酶活性,为转染miR-NC的(0.81±0.02)倍(P<0.05),但对突变型SOX7的荧光素酶活性无明显影响;转染miR-1269a inhibitor会明显增强野生型SOX7的荧光素酶活性,是转染miR-NC的(1.33±0.01)倍(P<0.01),但对突变型SOX7的荧光素酶无明显影响(图4C)。RTqPCR检测结果显示,转染pcDNA3.1-SOX7后H460干细胞样细胞内SOX7的mRNA表达量(1.38±0.03)高于转染pcDNA3.1-NC者(0.99±0.02),差异有统计学意义(P<0.001)。CCK-8检测结果显示,转染pcDNA3.1-SOX7后H460干细胞样细胞的增殖抑制率明显增高(P<0.01),但同时转染miR-1269a mimics后逆转了过表达SOX7对H460干细胞样细胞增殖活性的抑制作用(图4D)。细胞成球实验结果显示,与转染pcDNA3.1-NC的H460干细胞样细胞成球直径[(140.67±3.40) μm]相比,转染pcDNA3.1-SOX7的H460干细胞样细胞在形成干细胞球3 d后的直径[(88.67±2.62) μm]明显减小,差异有统计学意义(P<0.001),转染miR-1269a mimics的H460干细胞样细胞形成干细胞球3 d后的直径[(141.00±5.10) μm]与转染pcDNA3.1-NC的H460干细胞样细胞成球直径差异无统计学意义(P>0.05,图4E)。流式细胞术检测结果显示,转染pcDNA3.1-SOX7后H460干细胞样细胞的凋亡率为11.73%±0.29%,明显高于转染pcDNA3.1-NC后H460干细胞样细胞的凋亡率(2.07%±0.12%),差异有统计学意义(P<0.001),转染miR-1269a mimics的H460干细胞样细胞的凋亡率为2.17%±0.14%,与转染pcDNA3.1-NC的H460干细胞样细胞的凋亡率差异无统计学意义(P>0.05,图4F)。彗星实验结果表明,转染pcDNA3.1-SOX7能明显增加H460干细胞样细胞在X线辐射处理后DNA尾矩的变化(P<0.001),在2 Gy X线辐射处理后尾矩即为转染前的(1.21±0.02)倍,而同时转染miR-1269a mimics可逆转H460干细胞样细胞中DNA的损伤(P<0.05,图4G)。

图3 miR-1269a对H460干细胞样细胞放疗敏感性的调节作用Fig. 3 miR-1269a regulates the radio-sensitivity of H460 stem cell-like cells

图4 miR-1269a增强H460干细胞样细胞放疗敏感性的机制Fig. 4 Mechanism of miR-1269a in enhancing the radio-sensitivity of H460 stem cell-like cells
3 讨 论
NSCLC约占肺癌总数的85%以上[1],尽管放疗对NSCLC的治疗做出了巨大贡献,但肺癌细胞对放疗的不敏感性仍然是影响其达到最大疗效的主要障碍,因此寻找新的放疗增敏靶点、开发新型放疗增敏剂对提升NSCLC的放疗敏感性至关重要。肿瘤干细胞是存在于肿瘤细胞中具有干细胞特性的一小部分细胞,是导致肿瘤产生放疗抵抗及复发的重要因素。因此,清除肿瘤细胞中的干细胞对提升肿瘤的放疗敏感性尤为重要。近年来,miRNA已经成为癌症治疗的潜在靶点,miRNA能通过多种途径影响癌细胞的恶性生物学行为[11-12]。如Ma等[13]研究证实,miR-95在NSCLC组织及细胞中的表达上调,参与了肿瘤细胞的增殖及分化等恶性生物学行为,与NSCLC的放疗敏感性及预后也密切相关。本研究通过RT-qPCR实验检测的11种miRNA中,有7种在H460干细胞样细胞中的表达较H460细胞下调,分别为miR-30a、miR-148a、miR-148b、miR-152、miR-411、miR-497及miR-598;4种在H460干细胞样细胞中表达上调,分别为miR-424、miR-761、miR-1269a及miR-1280,其中miR-1269a在H460干细胞样细胞中的上调最为明显。后续实验结果显示,miR-1269a可通过抑制H460干细胞样细胞的增殖及分化,以及诱导H460干细胞样细胞的凋亡来提高H460干细胞样细胞对放疗的敏感性。
放射疗法治疗癌症的主要机制是诱导DNA双链断裂,因此DNA的损伤与修复也会影响放疗的敏感性。miRNA可通过作用于下游靶基因影响癌症的放疗敏感性,如Cortez等[14]报道miR-200c可通过下调PRDX2基因的表达增强肺癌细胞的放疗敏感性。Mao等[15]的研究结果显示,miR-449a可通过调节前列腺癌细胞中pRb/E2F1的表达增强其放疗敏感性。本研究发现,H460干细胞样细胞在转染miR-1269a inhibitor后,细胞内DNA双链断裂明显增加,且随着辐射剂量的增大,DNA双链的损伤程度也逐渐增加。
SOX7是属于SOX家族的一种新型肿瘤抑制剂。前期研究表明,SOX7在人类多种肿瘤中均起着至关重要的作用,如乳腺癌[16]、肝癌[17]、胃癌[18-19]及肺癌[20-21]等。Wang等[22]报道,miR-616抑制了SOX7在NSCLC细胞中的表达,并能调节SOX7下游靶标的表达。ENCORI数据库的预测结果显示,SOX7与miR-1269a存在部分结合序列。本研究通过双荧光素酶报告基因实验验证了他们之间的靶向关系。但是miRNA通常存在多个下游靶基因,miR-1269a也不例外,如miR-1269a可通过靶向调节SPATS2L及LRP6影响肝癌的发生发展[23]。因此,miR-1269a在NSCLC H460干细胞样细胞中也可能存在多个下游靶基因,值得在未来进行深入研究。
综上所述,与H460细胞比较,miR-1269a在H460干细胞样细胞中的表达明显升高,且转染miR-1269a inhibitor后H460干细胞样细胞对放疗的敏感性有所增加,其机制可能是通过上调SOX7的表达所致。

