NLRP3/GSDMD/IL-1β通路在发育期大鼠癫后抑郁行为中的作用及其干预方法
赵文婕,杨晨,韩慰,杨静,孙红,黄迪书,潘亚男,陈恒胜,程莉,蒋莉*
1儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心(重庆)/儿童发育重大疾病国家国际科技合作基地/认知发育与学习记忆障碍转化医学重庆市重点实验室/儿科学重庆市重点实验室,重庆 400014;2重庆医科大学附属儿童医院神经内科,重庆 400014
抑郁症是儿童及青少年最常见的癫痫共患精神障碍,二者具有相同的神经生物学机制[1],其中炎症反应可能参与了癫痫伴发抑郁的发生发展[2-3]。 如NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体活化参与了多种神经系统疾病,敲除NLRP3可以保护杏仁核点燃诱导的癫痫持续状态(status pilepticus,SE)大鼠海马CA1及CA3区神经元,减轻癫痫发作频率[4];NLRP3炎症小体抑制剂VX-765可降低血清及海马中白细胞介素-1β(interleukin-1β,IL-1β)水平,并缓解慢性应激抑郁程度[5]。因此,干预脑内炎症反应可能对癫痫及抑郁的治疗有效。临床上糖皮质激素具有非特异性的抗炎作用[6-7],且对部分发育性癫痫脑病具有一定疗效,可能与免疫调节抑制海马炎症反应、减轻脑水肿、改善血脑屏障损伤等有关[8]。因此,本研究建立发育期大鼠癫痫模型,观察SE后颞叶癫痫(TLE)大鼠是否伴发抑郁行为,进而以NLRP3炎症小体信号通路为切入点,探讨炎症反应对癫痫伴发抑郁行为的影响,以及糖皮质激素可能的治疗作用,以期为临床治疗癫痫共患抑郁提供新思路。
1 材料与方法
1.1试剂 氯化锂、匹罗卡品(美国Sigma-Aldrich公司);地塞米松磷酸钠注射液、硫酸阿托品(天津金耀氨基酸有限公司);NLRP3兔多克隆抗体(成都正能生物技术有限责任公司),GSDMD兔多克隆抗体(英国Abbexa公司),大鼠IL-1β ELISA试剂盒(深圳欣博盛生物科技有限公司),组织RNA提取试剂盒(武汉Servicebio生物科技有限公司),反转录试剂盒(日本TaKaRa公司),引物由上海生工生物工程有限公司合成,其他试剂为国产分析纯。
1.2动物模型制备及分组 无特定病原体级21日龄雄性SD大鼠60只,购自重庆医科大学实验动物中心[实验动物许可证号:SCXK(渝)2017-0012],动物饲养及实验过程符合国家及所在单位实验动物伦理委员会制定的伦理学标准。采用抽签法随机将大鼠分为3组:对照组、癫痫持续状态组(SE组)、癫痫持续状态+地塞米松(dexamethasone,DEX)组(SE+DEX组),每组20只。SE组及SE+DEX组均采用腹腔注射氯化锂、匹罗卡品诱发SE,建立TLE大鼠模型,方法是先腹腔注射氯化锂127 mg/kg, 18~20 h后再腹腔注射匹罗卡品30 mg/kg,采用Racine分级[9]评判惊厥发作,达到4级及以上发作视为建模成功。大鼠惊厥发作15 min后予硫酸阿托品1 mg/kg腹腔注射以减轻匹罗卡品的不良反应。惊厥发作1 h后,给予水合氯醛(300 mg/kg)终止癫痫发作。SE+DEX组大鼠在发作终止后立即予地塞米松腹腔注射[3 mg/(kg·d)],以后在每天的上午10点定时注射,连续7 d,SE组及对照组大鼠在相同时间点以相同给药方式给予等量生理盐水,取每组造模成功的8只大鼠用于行为学测试。
1.3蔗糖偏爱实验(SPT)评价大鼠的快感缺失情况 快感缺失被认为是抑郁症的核心症状,可反映大鼠体验甜食快感的能力,常用来评价大鼠的抑郁情况。以1 h内蔗糖消耗率作为检测指标,蔗糖消耗率降低表明动物缺乏对奖赏的兴趣及对甜食的快感,提示存在抑郁状态[10]。造模后第3周进行该实验,首先予1%蔗糖溶液饲养24 h,适应后禁食禁水24 h,然后暴露于两个完全相同的瓶子(一个盛满1%蔗糖水,另一个盛满普通饮用水)1 h,30 min更换水瓶位置以避免误差。蔗糖消耗率=蔗糖消耗量/总液体消耗量×100%。
1.4旷场实验(OPT)评估大鼠趋避性及自发运动能力 于SPT后第2天进行,将大鼠放置于旷场中心,利用运动轨迹图记录5 min内大鼠在中央区的停留时间及总运动距离,以评估大鼠的趋避性及自发运动能力,数据降低表明动物在新异环境中的探究行为减少及自发运动能力降低,提示抑郁行为严重程度增高[11]。
1.5强迫游泳实验(FST)评价大鼠的绝望程度 在OPT完成后第2天进行,第1天进行适应性训练,将大鼠放入游泳桶(直径30 cm,高70 cm)中游15 min,第2天开始正式测试,记录大鼠5 min内在水中的静止不动时间,即大鼠保持头部露出水面而不做任何动作或仅做微小活动保持的时间。静止不动时间(IMT)越长表明大鼠越绝望,可作为抑郁行为的检测指标[12]。
1.6Western blotting检测大鼠海马组织中NLRP3及Gasdermin D(GSDMD)蛋白表达水平 完成上述3项行为学测试后处死动物,每组取3只大鼠的单侧海马组织,提取组织蛋白,BCA法测定蛋白浓度,Image J软件分析各组NLRP3、GSDMD及内参β-actin的灰度值,NLRP3、GSDMD表达水平分别用NLRP3/β-actin、GSDMD/β-actin表示。
1.7实时荧光定量PCR检测NLRP3及GSDMD的mRNA表达水平 提取海马组织总RNA,Nanodrop 2000测定RNA浓度,用反转录试剂盒反转录为cDNA,扩增后进行实时荧光定量PCR分析。引物序列如下,GAPDH上游:5'-CTGGAGAAACCTGC CAAGTATG-3',下游:5'-GGTGGAAGAATGGGAG TTGCT-3',片段大小138 bp;NLRP3上游:5'-CCT CTGTGAGGGACTTCTGC-3',下游:5'-GAGGCTC TGGTTATGGGTCA-3',片段大小129 bp;GSDMD上游:5'-CAGGCAGCATCCTTGAGTGTC-3',下游5'-CCAAGACGTGCTTCACCAACT-3',片段大小186 bp。
1.8酶联免疫吸附实验(ELISA)检测海马组织中IL-1β表达水平 严格按照试剂盒说明书规范操作,每组各取3只大鼠的单侧海马,按20 mg加入100 μl组织裂解液的比例裂解组织,在450 nm处测定吸光度值。
1.9统计学处理 采用SPSS 22.0软件进行统计分析。对计量资料行正态检验,符合正态分布且方差齐的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法,方差不齐的计量资料采用Dunnett T3检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠的蔗糖消耗率比较 SE组及SE+DEX组的蔗糖消耗率均明显低于对照组,而SE+DEX组的蔗糖消耗率明显高于SE组,差异有统计学意义(P<0.05,表1)。
2.2各组大鼠OPT实验结果比较 SE组大鼠旷场中央区停留时间、总运动距离均明显低于对照组,差异有统计学意义(P<0.05);SE+DEX组的中央区停留时间明显长于SE组(P<0.05),但总运动距离与SE组比较差异无统计学意义(P>0.05,表1)。运动轨迹图表明,对照组有明显穿越中央区的迹象,而SE组及SE+DEX组的自主运动明显减少,活动主要集中在边角部位(图1)。
2.3各组大鼠FST实验结果比较 SE组的IMT高于对照组,而SE+DEX组的IMT低于SE组,差异有统计学意义(P<0.05,表1)。
2.4各组大鼠海马组织中NLRP3及GSDMD蛋白表达水平比较 与对照组比较,SE+DEX组及SE组的NLRP3蛋白表达水平明显升高,差异有统计学意义(P<0.05),而SE+DEX组与SE组比较差异无统计学意义(P>0.05)。SE组的GSDMD蛋白表达水平高于对照组及SE+DEX组,差异有统计学意义(P<0.05),而SE+DEX组与对照组比较差异无统计学意义(P>0.05,图2、表2)。
表1 各组大鼠抑郁行为学指标比较 (±s,n=8)Tab.1 Comparison of behavioral indicators of depression in each group of rats (±s, n=8)
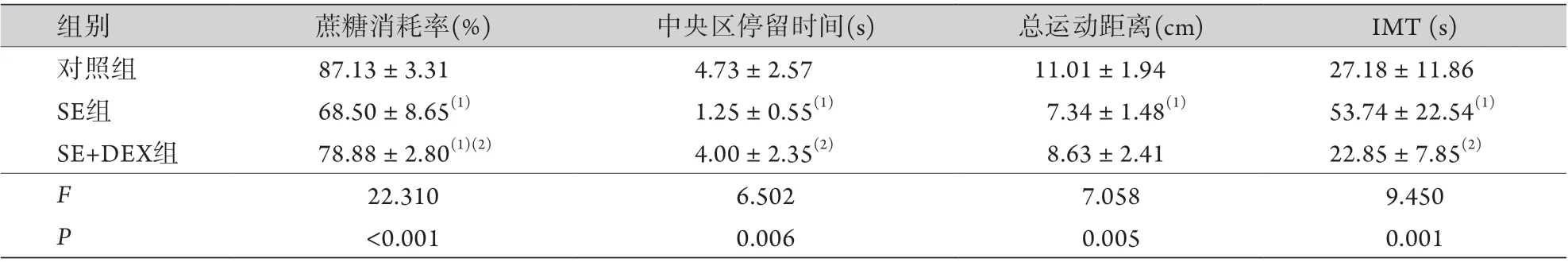
表1 各组大鼠抑郁行为学指标比较 (±s,n=8)Tab.1 Comparison of behavioral indicators of depression in each group of rats (±s, n=8)
SE. 癫痫持续状态;DEX. 地塞米松;与对照组比较,(1)P<0.05;与SE组比较,(2)P<0.05。
组别 蔗糖消耗率(%) 中央区停留时间(s) 总运动距离(cm) IMT (s)对照组 87.13±3.31 4.73±2.57 11.01±1.94 27.18±11.86 SE组 68.50±8.65(1) 1.25±0.55(1) 7.34±1.48(1) 53.74±22.54(1)SE+DEX组 78.88±2.80(1)(2) 4.00±2.35(2) 8.63±2.41 22.85±7.85(2)F 22.310 6.502 7.058 9.450 P<0.001 0.006 0.005 0.001

图1 各组大鼠运动轨迹图Fig.1 The trajectory of each group of rats
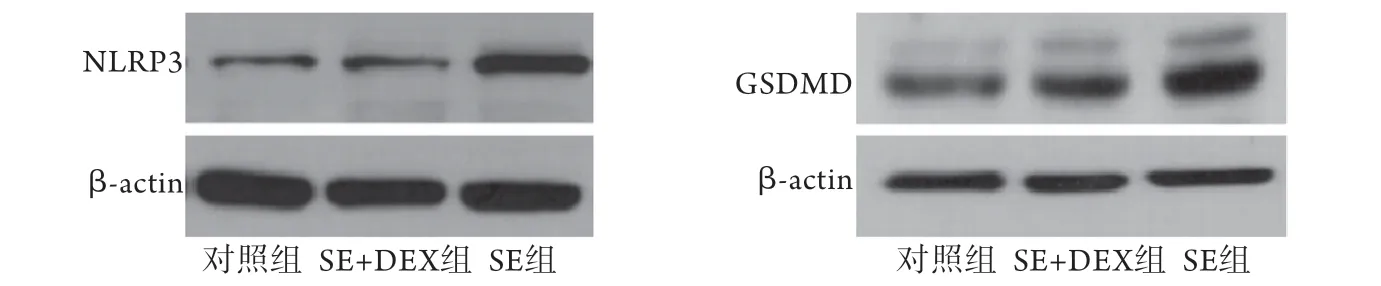
图2 Western blotting检测各组大鼠海马组织NLRP3及GSDMD蛋白表达Fig.2 Protein expressions of NLRP3 and GSDMD in hippocampus of rats in each group (Western blotting)
表2 各组大鼠炎症小体组分比较 (±s,n=3)Tab.2 Comparison of inflammasome components in each group of rats (±s, n=3)

表2 各组大鼠炎症小体组分比较 (±s,n=3)Tab.2 Comparison of inflammasome components in each group of rats (±s, n=3)
与对照组比较,(1)P<0.05;与SE组比较,(2)P<0.05。
2.5各组大鼠海马组织中NLRP3及GSDMD mRNA表达水平比较 SE组的NLRP3及GSDMD mRNA表达水平明显高于对照组和SE+DEX组,差异均有统计学意义(P<0.05),但SE+DEX组与对照组比较差异无统计学意义(P>0.05,表2)。
2.6各组大鼠海马组织中IL-1β表达水平比较 SE组大鼠海马组织中IL-1β表达水平明显高于对照组及SE+DEX组,差异有统计学意义(P<0.05),但SE+D E X 组与对照组比较差异无统计学意义(P>0.05,表2)。
3 讨 论
癫痫是儿童常见的神经系统疾病,儿童癫痫患病率为(3.7~6.2)/1000[13],其中TLE是症状性癫痫中最常见的一种类型。作为癫痫的常见共患病,情绪障碍在癫痫患儿中的发生率是普通儿童的3~6倍,且以抑郁为主[14-15],癫痫青少年中抑郁症的患病率高达8%~35%[16],可导致其学习成绩下降,人际关系受损,自杀率增高,使治疗复杂化并增加死亡率。探索癫痫共患抑郁障碍的发生机制,寻找可能的治疗途径,对改善癫痫患儿的生活质量具有重要意义。
作为共患病,癫痫与抑郁具有共同的神经生物学基础[1,17]。既往研究发现,氯化锂-匹罗卡品诱导大鼠SE造成急性脑损伤,后期进入以自发性癫痫发作为特征的TLE慢性期,同时出现抑郁状态,可作为癫痫与抑郁的共病模型[18]。本研究通过腹腔注射氯化锂-匹罗卡品构建发育期大鼠TLE模型,采用3种常用于模拟人抑郁状态的行为学测试方法SPT、OPT、FST分别从快感缺失、逃避、绝望3个不同角度检测TLE大鼠的抑郁行为,结果显示,与对照组相比,SE组大鼠的蔗糖消耗率明显降低,在旷场中心区域停留时间减少、自主活动减少,在水中IMT明显延长,提示处于脑发育期的幼龄大鼠在SE后的癫痫形成过程中存在明显的抑郁障碍表现。
癫痫共患抑郁的机制尚不完全明确,炎症与癫痫及抑郁的关系成为近年的研究热点[3,19-21]。有研究发现,在慢性TLE大鼠中,促炎因子IL-1β表达增加可使海马中的吲哚胺2,3-加双氧酶的水平升高,导致犬尿氨酸/色氨酸比值增高及血清素/色氨酸比值下降,从而诱导癫痫相关的抑郁行为[22]。异常升高的IL-1β被认为是癫痫相关抑郁的关键炎性因子。Mazarati等[23]发现,TLE与抑郁伴发大鼠海马内注射IL-1受体拮抗剂可改善抑郁障碍。本研究发现,SE后癫痫抑郁共患幼鼠海马内IL-1β表达升高,证实IL-1β与癫痫相关抑郁有关,提示神经炎症在癫痫相关抑郁中具有重要作用。已有研究发现,NLRP3炎症小体可作为炎症反应的核心部分[21],细菌、病毒及内源性危险信号等相关分子模式均可激活炎症小体,介导免疫细胞的活化。NLRP3炎症小体的主要组分包括胞内模式识别受体(intracellular pattern recognition receptor,PPRS)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、半胱天冬氨酸蛋白酶(caspase)及底物GSDMD蛋白,GSDMD作为调控IL-1β加工及成熟的关键信号分子[24-25],可独立介导IL-1β等炎性介质的释放,产生炎性病理反应[24,26]。 除炎性疾病以外,在部分神经精神性疾病,如额颞叶痴呆(FTD)、帕金森病、肌萎缩性脊髓侧索硬化症(ALS)及亨廷顿舞蹈症等中均发现NLRP3炎症小体表达明显增高[27]。本研究通过建立发育期大鼠SE模型,发现大鼠海马中NLRP3及GSDMD mRNA及蛋白表达均明显升高,且伴有IL-1β表达水平明显升高,提示发育期大鼠SE后脑内NLRP3被激活,诱导GSDMD活化,促进炎性因子IL-1β的成熟及分泌,通过诱发神经炎症导致抑郁行为的发生。
目前,治疗癫痫及抑郁症的药物尚存争议。研究表明,抗癫痫药物对控制精神障碍无明显作 用[28-29],而经典抗抑郁药如选择性5-羟色胺再吸收抑制剂有加剧癫痫发作的高风险。鉴于糖皮质激素对部分难治性癫痫脑病具有一定疗效[8,30],且有研究在热性惊厥持续状态、青霉素及匹罗卡品诱导的癫痫动物模型中发现DEX能抑制癫痫发作[31-33],因此,本研究进一步观察发育期大鼠SE后短期应用DEX能否减轻脑内炎症活化反应,发挥抗抑郁作用。结果显示,短期应用DEX后,可下调发育期SE大鼠海马组织中GSDMD及炎性因子IL-1β的表达水平,改善了抑郁行为,提示糖皮质激素可能通过干预SE后脑内的炎症反应而抑制癫痫发作,缓解抑郁症状。
目前,除研究最深入的NLRP3介导的炎症小体外,NLRP1、(NAIP)-NLRC4、AIM2、Pyrin也是研究较为充分的参与炎症小体组成的模式识别受体,而GSDMD被证实是炎症小体的下游关键效应分 子[34]。本研究发现,癫痫伴发抑郁大鼠在应用DEX后其海马内GSDMD的mRNA及蛋白表达水平均降低,而NLRP3仅mRNA表达水平低于SE组,蛋白表达水平两组无明显差异,提示糖皮质激素可能通过干预上述其他炎症小体的激活进而改善癫痫共患抑郁的发生发展。
综上所述,NLRP3/GSDMD/IL-1β通路可能参与了癫痫伴发抑郁的发生发展,GSDMD促进炎性介质IL-1β释放可能在发育期癫痫大鼠伴发抑郁的发病过程中促使海马炎症的发生,SE后短期应用DEX可能通过下调GSDMD/IL-1β表达而减轻神经炎症,进而改善与癫痫相关的抑郁行为。

