非体外循环下冠状动脉旁路移植术同期行体外循环下二尖瓣成形术:32例临床报告
白辰,李京倖,张帆,汪川,刘锐,顾承雄
首都医科大学附属北京安贞医院心脏外科/北京市心肺血管疾病研究所,北京 100029
近年来,冠状动脉粥样硬化性心脏病(冠心病,CAD)合并缺血性二尖瓣关闭不全的发病率逐年增高。该疾病患者具有高龄、病史久、术前心脏功能差等特点,除二尖瓣等心脏结构病变外,其心肌本身灌注不足,促使病变进一步加重,外科治疗则须同期行冠状动脉旁路移植术(coronary artery bypass graft,OPCABG)合并二尖瓣成形术(mitral valve repair,MVP)[1]。本研究总结32例CAD合并二尖瓣关闭不全患者同期行OPCABG和MVP术的临床经验,以提高手术安全性及疗效。
1 资料与方法
1.1一般资料 回顾性分析2017年4月-2018年3 月于北京安贞医院心脏外科住院且同期行OPCABG和MVP术的32例CAD合并二尖瓣关闭不全患者的临床资料。其中男21例,女11例,年龄(62.2±5.3)岁。所有患者术前均行冠状动脉造影明确诊断,三支病变10例,多支病变22例。术前超声心动图检查和术中食道超声显示二尖瓣关闭不全,二尖瓣反流面积5.0~8.0 cm224例,>8.0 cm28例;合并不同程度三尖瓣反流9例。左心房内径30~55(42.05±6.43) mm;左室射血分数(LVEF) 41%~61%(49%±11%);左室舒张期末径(LVEDD) 48~66(58.17±4.88) mm。
1.2手术方法 患者全麻后常规消毒铺巾,正中切开皮肤、皮下组织,锯开胸骨,打开心包,同期游离左乳内动脉与下肢大隐静脉备用。所有患者均先行OPCABG术,平均移植血管数3.69根,获取左乳内动脉26例。待全部吻合口缝合完毕,循环稳定后应用即时血流测量仪(transit-time flow meter,TTFM)测定各支桥血管流量。然后建立体外循环,并行循环,阻升主动脉,停跳液灌注保护心肌,在中度低温体外循环下行MVP术,术中阻断主动脉54~108(76.9±16.5) min。切开右心房及房间隔后,直视下探查二尖瓣病变,后叶瓣环明显下沉扩张26例,后叶腱索断裂2例,后瓣叶脱垂4例。其中单纯人工瓣环成形26例,后叶矩形切除4例,以及腱索转移2例均用硬质C形环加固瓣环。另外有3例行三尖瓣成形术。
1.3统计学处理 采用SPSS 20.0软件进行统计分析。计量数据以±s表示,术前术后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1手术结果 无手术死亡患者,且均用多巴胺维持循环。术后出现肾衰竭1例,于监护室行血液透析治疗治愈;无其他术后并发症。呼吸机使用时间(16.4±3.1) h,ICU监护时间(1.4±0.3) d,术后住院时间(7.5±1.9) d。
2.2术后随访 术后随访30例,随访时长6~30个月,失访2例,无死亡病例。心功能Ⅰ级26例,Ⅱ级4例。术后12个月超声心动图复查提示,二尖瓣无反流或微量反流8例,轻度反流20例,中度反流2例,其中15例患者的二尖瓣反流与术后1周时比较稍加重,但无需二次手术。与术前比较,随访患者的LVEDD显著减小[(49.40±5.74) mm vs. (58.17±4.88) mm,P=0.001],LVEF有所改善[(57%±10%) vs. (49%±11%),P=0.038)],但左心房内径差异无统计学意义[(43.00±5.77) mm vs. (42.05±6.43) mm,P=0.064],患者的心功能有所提高(表1)。
表1 患者手术前后超声心动图检查结果(±s,n=30)Tab.1 Results of echocardiography in patients before and after operation (±s, n=30)
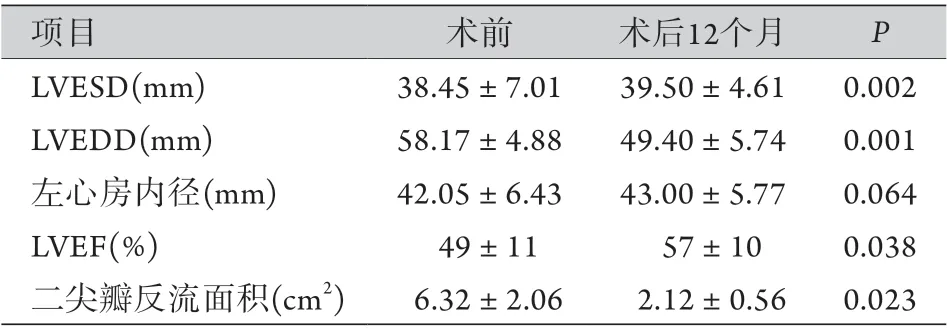
表1 患者手术前后超声心动图检查结果(±s,n=30)Tab.1 Results of echocardiography in patients before and after operation (±s, n=30)
LVESD. 左室收缩期末径;LVEDD. 左室舒张期末径;LVEF. 左室射血分数
3 讨 论
我国CAD合并二尖瓣关闭不全属常见心脏疾病,且该疾病患者逐年增多。国外报道,有症状的CAD患者二尖瓣关闭不全发病率为6%~19%[2]。Velazquez等[3]对376例年龄>40岁的瓣膜病患者行CT血管造影(CTA)检查显示,12.2%的患者存在明显的冠状动脉狭窄病变,需同期行CABG术。国外研究发现,同期施行MVP及CABG术的患者约占CAD患者的10%~15%[4-5]。目前,对CAD合并轻度二尖瓣关闭不全患者仅需行CABG术,合并重度二尖瓣关闭不全患者需同期行CABG+MVP术已达成共识,但对中度以下二尖瓣关闭不全以及左心室无明显扩大的患者是否在CABG术同期行MVP术仍存在争 议[6-8]。
二尖瓣的主要结构有瓣叶、瓣环、腱索及乳头肌。二尖瓣及左心房与左心室的解剖结构正常并协调运动时,才能保证二尖瓣的正常功能[9]。缺血坏死的心肌可引起以上结构的改变,导致二尖瓣结构功能失调;二尖瓣关闭不全的主要病理改变为二尖瓣环扩大,大部分患者是后瓣环扩大,左室壁运动失调,导致左心室几何结构改变;少部分患者是瓣叶脱垂,乳头肌坏死导致二级腱索延长或断裂[10]。20%的CAD患者合并二尖瓣关闭不全,其作为一个重要的危险因素,可导致患者病死率和心脏突发事件发生率增高,降低生活质量[11-13]。术前应明确病变程度,严格把握手术适应证。
体外循环可造成机体的强烈炎症反应,主要原因为低体温、冷心肌缺血以及转机对血液的破坏等[14]。这种炎症反应导致产生急性、大量的防御反应,释放凝血和纤溶系统的细胞因子、趋化因子、血管活性物质、细胞毒素、活性氧和蛋白酶,从而导致器官功能障碍[15]。体外循环和主动脉阻断时间越长,炎症反应程度越重[16]。因此,术中对心肌的保护以及尽量缩短主动脉阻断时间是手术成功的关键,同时正确的围术期处理可降低OPCABG同期行MVP术的病死率。本研究随访结果显示,CAD合并中度二尖瓣关闭不全患者在行OPCABG+MVP术后1年,二尖瓣反流面积和LVEF较术前明显好转,左心室舒张期末内径和收缩期末内径较术前有所 减小。
手术策略是保证手术安全的第一要素。笔者对本组病例治疗的体会是,不仅要做到准确吻合血管和有效的瓣膜成形术,还要保证术中对心肌的保护。国内外学者一致认为术中的心肌保护是重中之重[17-18]。本组病例伴有心肌缺血性病理改变,手术中采用的心肌保护为中低温冷晶体停跳液灌注,即先在不停跳下完成OPCABG术,然后再转体外循环机行MVP术,以缩短主动脉阻断时间以及减轻转机对机体的损伤。国外有学者发现这对于术前心功能不全或心肌缺血严重的患者有较好的心肌保护效 果[19-20]。杨帆等[21]发现,OPCABP+MVP组患者手术时间、术后心肌酶升高趋势、术后引流量及ICU住院时间均优于CABG+MVP组。
OPCABG要尽量做到完全再血管化,应在心脏复跳前处理好所有远端吻合口,一旦心脏复跳后再处理会比较困难。曾有学者报道,135例患者CABG+MVP非完全心肌再血管化病死率达18%,而90例患者心肌完全再血管化早期病死率仅为5.5%[22-23]。由于冠状动脉狭窄和心肌小动脉炎加剧了心肌供血不足,形成了冬眠心肌,完全再血管化可以最大限度地恢复冬眠心肌,增强心肌收缩力,提高远期疗效。
随着手术技术的成熟,延长吻合血管所付出的时间,对提高远期效果是值得的。Raja等[24]研究发现,先在非体外循环下完成冠状动脉的远端吻合,再阻断升主动脉行心脏瓣膜手术以缩短主动脉阻断时间,可提高心肌保护水平,缩短住院时间,以及降低病死率。
综上所述,对多支冠状动脉血管病变重、移植桥血管数量较多并同期行MVP术的患者,可先行OPCABG术,再行体外循环处理二尖瓣病变,以缩短体外循环与主动脉阻断时间,提高手术效果。

