主动脉弓缩窄模型所致小鼠主动脉重塑的lncRNA表达谱分析
冯婷,周风云,陈扬平,路祥麒,张秋霞,陈业佳,张新禄,修建成
南方医科大学南方医院心血管内科,广州 510515
高血压是最常见的慢性非传染性疾病,是多种环境因素及遗传因素共同决定的主要心血管危险因素[1-2]。据世界卫生组织统计,在全球范围内有超过11.3亿人患有高血压,随着人口老龄化的发展,预计到2025年全球高血压患病人数将上升至15亿[3]。高血压因常伴发心血管及肾脏疾病而成为世界性的公共卫生挑战[4-5],已被确定为死亡的主要危险因素[6]。据调查,中国有2.44亿成人患有高血压,是高血压第一大国[7]。尽管一些临床降压药物如血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)及β受体阻滞剂等在降压的同时还具有一定的抑制血管重塑作用,但预后仍不理想[8]。 因此寻找新的治疗靶点尤为重要。
动脉重塑是高血压的主要病理结果之一,最终可导致各种靶器官损害[9-10]。动脉重塑受血流动力学负荷及神经激素激活等多种因素的影响,其中血流动力学改变通过机械转导机制激活血管生物化学信号,调控多个细胞学的病理变化过程,如细胞肥大、增殖、凋亡、炎症反应、细胞外基质生成及降解等,其中以中膜平滑肌细胞肥大、增殖、向内皮下迁移并产生大量的细胞外基质为其中心环节[11]。 有研究表明,长链非编码RNA(long non-coding RNA,lncRNA)在调节血管平滑肌细胞的表型转化中起重要作用[12]。在主动脉弓缩窄(transverse aortic constriction,TAC)模型中,大动脉会发生结构及功能的改变,使用血管紧张素受体拮抗剂具有一定的抗炎效果,但主动脉管壁厚度、中膜肥厚、外膜增生、胶原沉积等形态学改变尚不能得到显著地抑 制[13]。因此,本研究采用全转录组测序(RNA-seq)鉴定TAC模型所致动脉重塑的差异表达转录本,通过分析小鼠主动脉组织中差异表达的转录本探讨动脉重塑的潜在机制,以期发现新的生物标志物及治疗靶点,为早期干预高血压引起的动脉重塑奠定 基础。
1 材料与方法
1.1动物模型的制备 60只7周龄左右的C57BL/6J雄性小鼠,适应性喂养1周。小鼠每日自由饮水、进食及在笼内自由活动,不受限。饲养条件:环境清洁,温度和湿度适宜,12 h照明,12 h黑暗。1周后,小鼠达8周龄,体重20~25 g。参照文献[14]、[15]的方法构建TAC模型:麻醉后,连接小动物呼吸机,常规皮肤消毒,在小鼠胸骨左旁第2肋骨处纵行切开皮肤,钝性分离筋膜及肌肉组织,探入第2肋间隙暴露胸腺,随后将胸腺推至小鼠右侧,直到主动脉弓进入视野,将自制的带6-0丝线的钩针由小鼠头部向尾部方向从头臂干及左颈总动脉之间的主动脉弓深面穿出,穿过主动脉弓后,将自制27G垫针置于主动脉弓表面,将6-0丝线结扎,结扎松紧度以保留主动脉内径0.4 mm为宜。逐层缝合肌肉组织及皮肤,术后常规消毒,给予镇痛、保温护理,等待小鼠苏醒。对照组小鼠行假手术,即接受同样的手术操作,但不结扎主动脉弓。小鼠苏醒后送回原饲养环境继续喂养。所有动物护理及实验均符合南方医科大学实验动物福利及伦理管理委员会规范,所有操作和处理均按照美国国立卫生研究院(NIH)出版的《实验室动物护理和使用指南》 进行。
1.2超声检测小鼠血流速度 术后1周,采用VEVO2100成像系统的MS400超声探头检测小鼠主动脉结扎处及左右颈总动脉处的血流速度。在B型超声模式下找到主动脉和3根分支后,切换至彩色多普勒模式,观察血流信号,切换至频谱多普勒模式即可获得该处的血流流速图像资料,此时的目的是判断TAC模型是否构建成功。当TAC处理小鼠的右颈总动脉/左颈总动脉血流速度比值为5~10时纳入实验组,假手术处理小鼠中该比值<1者纳入对照组。术后2周再次行超声检测,目的是观察主动脉根部内径变化情况。
1.3取材及石蜡切片制备 术后2周,按10 mg/kg给予0.5%异戊巴比妥钠腹腔注射对小鼠进行麻醉。暴露主动脉部分,肉眼观察主动脉形态。其中用于后续RNA提取的升主动脉组织(每组各20只)只需用预冷的PBS溶液灌注,取材后置入EP管中,随后迅速冻于液氮中,取材结束后转至-80 ℃冰箱保存备用。而用于制备石蜡切片的组织(每组各4只)分别用预冷的PBS溶液及4%多聚甲醛各20 ml先后缓慢灌注,取出的血管组织置于4%多聚甲醛中固定24 h,然后取出血管组织置于细方格包埋框内,用细水流缓慢冲洗过夜。第2天将组织进行浓度梯度脱水,脱水方案:70%乙醇(1 h)→80%乙醇(1 h)→90%乙醇(30 min)→95%乙醇(30 min)→100%乙醇(30 min)→100%乙醇(30 min)。脱水结束后,放入二甲苯中,分别于二甲苯Ⅰ及二甲苯Ⅱ中透明15 min及8 min;然后转移至60 ℃恒温箱内的石蜡缸中,于石蜡Ⅰ及石蜡Ⅱ内分别浸蜡45 min及30 min。浸蜡后进行包埋及切片,切片厚度为4 μm。然后将切片置于60 ℃恒温烤箱内烤片2 h备用。
1.4升主动脉组织切片染色 将石蜡切片放入二甲苯Ⅰ及二甲苯Ⅱ中各脱蜡10 min,再依次放入无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇及85%乙醇中各脱蜡处理5 min,自来水冲洗1~2 min。采用HE染色试剂盒、改良Weigert弹力纤维染色液及天狼猩红染色液进行染色。于显微镜下观察主动脉形态以及弹力纤维和胶原纤维的表达情况。采集图像后用Image J测量中膜厚度、弹力纤维面积比及外膜胶原纤维面积。
1.5RNA-seq筛选差异lncRNA 本研究中RNA的提取、全转录组检测及生物信息学分析委托广州基迪奥生物有限公司完成。对升主动脉组织进行混样处理,将5只小鼠的升主动脉混为1个样品。实验组与对照组分别为4个生物学重复。用Trizol法提取总RNA后,采用Agilent 2100生物分析仪(RNA分子完整数RIN值>7)评估RNA质量,并采用Nanodrop微量分光光度计及无RNase琼脂糖凝胶电泳进行两次检查。提取总RNA后,将1 μg总RNA用于制备lncRNA库。使用片段缓冲液将富集的mRNA片段化为短片段,并使用随机引物反转录为cDNA。通过DNA聚合酶Ⅰ、RNase H、dNTP(dUTP代替dTTP)合成第二链cDNA。然后用QiaQuick PCR提取试剂盒纯化cDNA片段,进行末端修复,添加poly(A),并连接Illumina测序接头,随后使用尿嘧啶-N-糖基化酶(UNG)消化第二链cDNA。通过琼脂糖凝胶电泳选择消化的产物大小,PCR扩增,然后采用Illumina HiSeqTM4000进行测序。为了获得高质量的纯净片段,用fastp(0.18.0版)进一步过滤序列[16]。建立参考基因组的索引(GRCm38.p6),并使用HISAT(2.1.0版)将“rna-strandness RF”及其他参数设置为默认值,将配对末端的纯序列映射到参考基因组[17]。通过基于参考的StringTie(1.3.4版)量化片段的丰度[18]。 对于每个转录区域,均计算每百万个映射读段的转录本的每千碱基片段数(FPKM)以量化其表达丰度及变异。
1.6qRT-PCR验证RNA-seq效力 分离主动脉组织,加入Trizol试剂匀浆主动脉组织,提取总RNA,利用反转录酶反转录为cDNA。引物由上海生工生物工程有限公司合成,使用的引物见表1。 采用SYBR Green RT-PCR试剂盒(日本TaKaRa公司)及LightCycler480 Ⅱ实时荧光定量PCR系统(瑞士巴塞尔罗氏诊断公司)检测目标lncRNA的相对表达量,以GAPDH为内参,结果以2-ΔΔCt方法计算 得出。

表1 qRT-PCR验证的引物Tab.1 Primers validated by qRT-PCR
1.7生物信息学分析 用DESeq2软件进行两组间差异表达转录本(DEGs)分析(两样本间用edgeR进行差异表达分析)。差异倍数≥2和错误发现率(FDR值)<0.05的lncRNA为差异显著的转录本。对差异表达显著的lncRNA,根据其在相关蛋白编码基因上的位置进行分类,然后再对差异表达的lncRNA进行靶基因预测,以便进行GO功能富集及KEGG通路富集分析。将预测的靶基因比对到基因本体数据库(http://www.geneontology.org/)中的GO terms。GO富集分析提供了与背景基因相比在DEGs中显著富集的GO条目,并过滤出了与生物功能相对应的靶基因。用FDR校正法分析计算得到的P值,即FDR值,以FDR<0.05为阈值,将满足这一条件的GO terms定义为在DEGs中显著富集的GO terms。利用KEGG数据库进行通路富集分析,以发现靶基因中显著富集的代谢或信号转导途径。
1.8统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以±s表示,两组间比较采用成组样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1TAC对主动脉压力及形态的影响 术后1周,超声测得两种不同处理小鼠右颈总动脉及左颈总动脉处的血流速度(图1)。实验组的右颈总动脉处血流速度与左颈总动脉处血流速度比值明显高于对照组,差异有统计学意义(P<0.001,表2)。术后2周,实验组的主动脉内径较对照组明显增宽,差异有统计学意义(图2,表2)。在分离主动脉组织时发现,实验组的升主动脉明显增厚,于显微镜下观察未发现动脉瘤及血栓。HE染色及形态学分析结果显示,实验组升主动脉中膜厚度明显大于对照组,差异有统计学意义(图3,表2)。Weigert染色结果显示实验组中膜弹力纤维变稀疏,实验组的中膜弹力纤维面积比明显低于对照组,差异有统计学意义(图4, 表2)。天狼猩红染色结果显示,胶原蛋白在实验组的升主动脉中大量积聚,主要见于中膜及外膜,外膜积聚较为明显,实验组的外膜胶原纤维面积明显高于对照组,差异有统计学意义(图5,表2)。

图1 两组右颈总动脉及左颈总动脉血流速度超声检测结果Fig.1 Ultrasonic detection of the blood flow velocity of right carotid artery and left carotid artery in the two groups

图2 两组升主动脉内径超声检测结果Fig.2 Ultrasonic detection of the inner diameter of the ascending aorta in the two groups
2.2RNA-seq筛选出差异表达的lncRNA 用RNA-seq 共筛选出199个差异表达的lncRNA、213个差异表达的微小RNA(miRNA)、158个差异表达的环状RNA(circRNA)及1019个差异表达的mRNA。在差异表达的lncRNA中,有101个上调,98个下调。为了让两组间lncRNA的差异更加可视化,笔者根据差异倍数及FDR值用两组间的差异转录本构建了火山图,结果显示两组间存在明显不同的上调及下调lncRNA(图6)。分层聚类显示可以通过不同表达的lncRNA谱很好地区分实验组及对照组,所有差异lncRNA均正确分类(图7)。
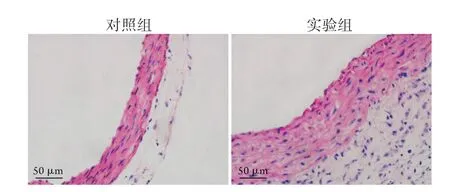
图3 两组升主动脉组织的HE染色结果Fig.3 HE staining of ascending aorta tissue in the two groups

图4 两组升主动脉组织的Weigert染色结果Fig.4 Weigert staining of ascending aorta tissue in the two groups
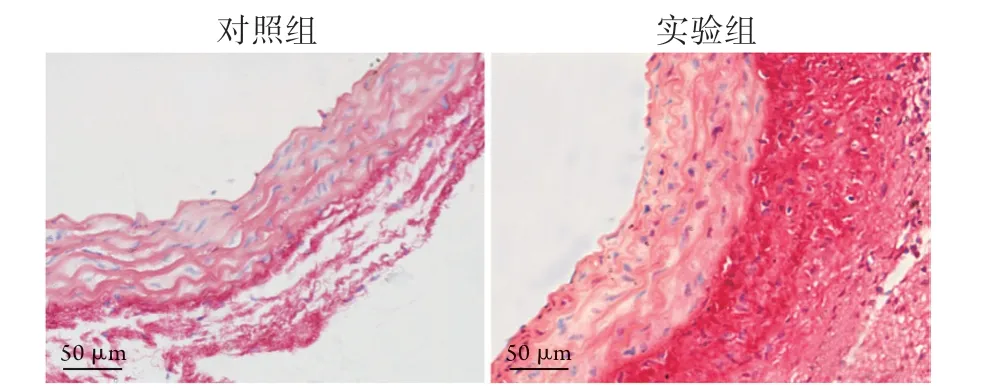
图5 两组升主动脉组织的天狼猩红染色结果Fig.5 Sirius red staining of ascending aorta tissue in the two groups

图6 差异表达lncRNAs的火山图Fig.6 Volcano map of differentially expressed lncRNAs
表2 两组升主动脉压力及形态学指标比较(±s,n=4)Tab.2 Comparison of ascending aortic pressure and morphological indexes between the two groups (±s, n=4)
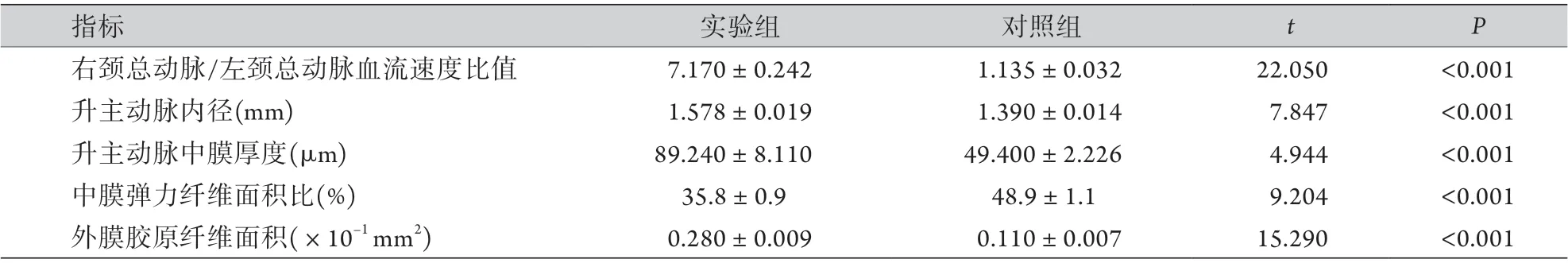
表2 两组升主动脉压力及形态学指标比较(±s,n=4)Tab.2 Comparison of ascending aortic pressure and morphological indexes between the two groups (±s, n=4)
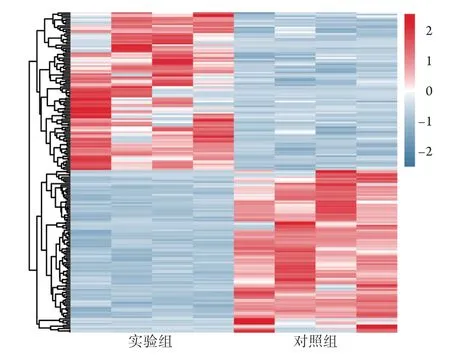
图7 差异表达lncRNAs的热图Fig.7 Heat map of differentially expressed lncRNAs
2.3qRT-PCR验证RNA-seq效力 任意挑选6个在实验组与对照组差异表达的lncRNA (MSTRG.10220.2、MSTRG.11224.2、MSTRG.4916.1、MSTRG.10841.2、MSTRG.17751.1及MSTRG.16766.2)进行qRT-PCR验证,结果显示这些lncRNA的表达模式与高通量测序观察到的表达模式一致,差异无统计学意义(表3,图8)。
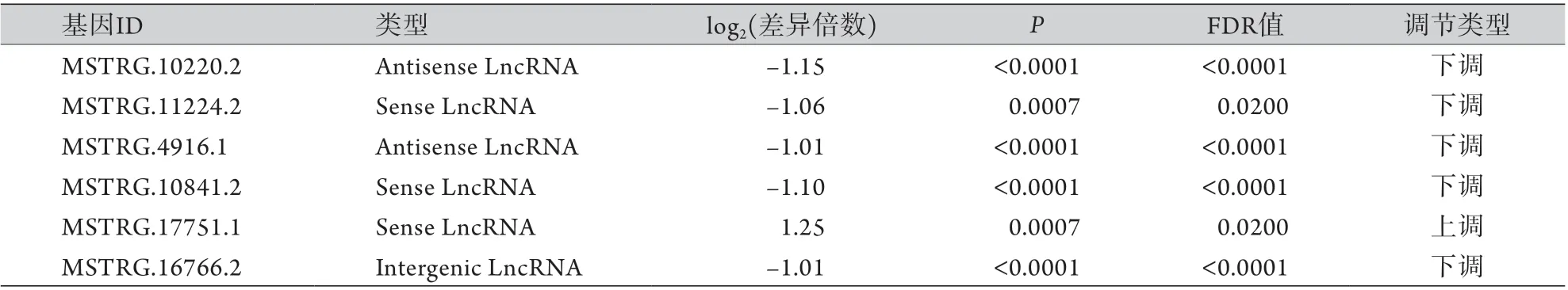
表3 6个在实验组与对照组差异表达的lncRNA的特征Tab.3 The characteristics of 6 differentially expressed lncRNAs existed in experimental group and control group
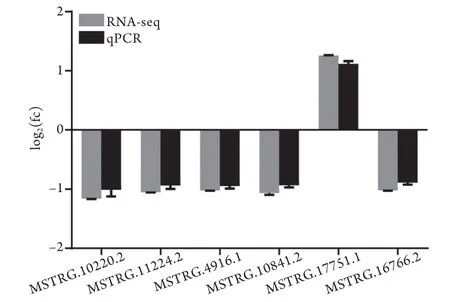
图8 qRT-PCR验证6个差异表达lncRNA的RNA-seq表达情况(n=4)Fig.8 RNA-seq expression of 6 diあerentially expressed lncRNAs validated by qRT-PCR (n=4)
2.4反义预测的靶基因的功能富集分析 反义lncRNA可与正义链的mRNA结合而调控基因沉默、转录及mRNA的稳定性。本研究对差异表达的lncRNA预测反义作用,获得了lncRNA-mRNA靶基因对。然后对反义预测的靶基因进行GO分析(图9A),注释包括生物学过程、细胞组分及分子功能3个部分的GO条目。GO生物学过程分析显示富集的条目包括细应答内源性刺激和细胞基质黏附,但富集不显著。GO细胞组分分析显示,与质膜相关的条目显著富集。GO分子功能分析主要显著富集了与信号转导活动相关的条目。此外,对靶基因进行的KEGG通路分析发现,可能参与动脉重塑的信号通路包括血管平滑肌收缩、cGMP-PKG信号通路、钙信号通路及肌动蛋白细胞骨架调节(图9B)。
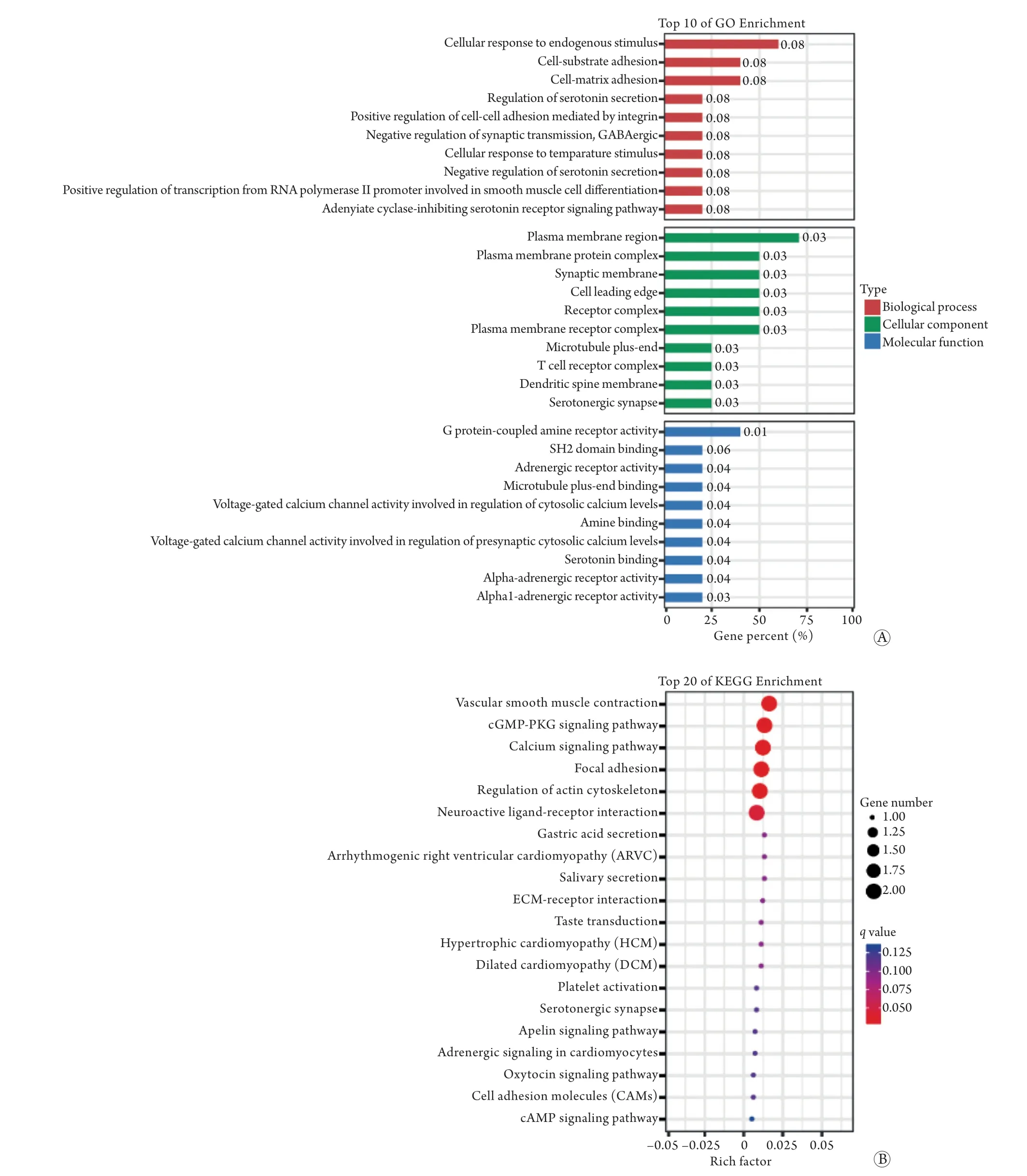
图9 反义预测靶基因的功能富集分析Fig.9 Functional enrichment analysis of antisense-predicted target genes
2.5顺式调控预测的靶基因的功能富集分析 考虑到lncRNA的功能还与其邻近的蛋白编码基因相关,位于上游的lncRNA可能与启动子或者共表达基因的其他顺式作用元件有交集,从而在转录或转录后水平对基因的表达进行调控。如果位于一个基因的上游或下游10 kb内,这些lncRNA有可能与顺式作用元件所在区域有交集,从而参与转录调控的进程。本研究对所有的lncRNA及差异表达的lncRNA预测顺式调控作用,获得lncRNA-mRNA靶基因对。与反义预测的靶基因相似,同样对获得的差异靶基因进行GO及KEGG分析(图10)。GO生物学过程分析显示,细胞基质黏附相关条目富集较为显著。GO细胞组分分析主要富集在细胞外区域及细胞外基质相关的条目。GO分子功能分析主要富集了细胞黏附分子结合功能。但细胞组分及分子功能富集不显著。KEGG通路分析发现,与疾病相关的信号通路(心律失常性右室心肌病和病毒性心肌炎)及免疫反应相关的信号通路[核因子(NF)-κB信号通路和趋化因子信号通路]富集较为明显。但仅富集了8条信号通路,且每个信号通路仅有一个靶基因参与。
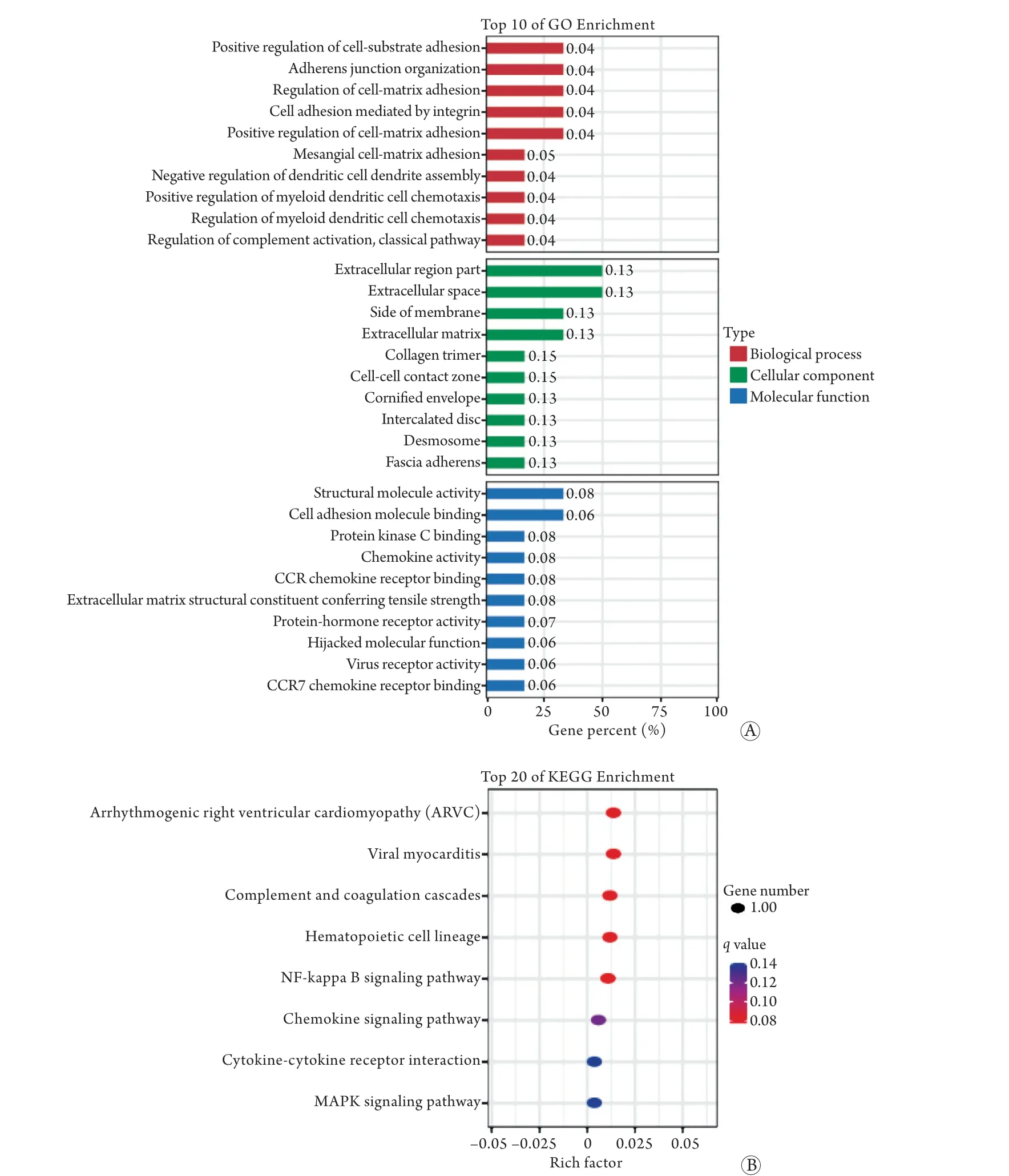
图10 顺式调控预测靶基因的功能富集分析Fig.10 Functional enrichment analysis of cis-regulatory predicted target genes
3 讨 论
高血压的主要病理结果是血管重塑。血压升高伴随着血流动力学的改变,血流剪切力下降,导致血管内皮细胞信号转导激活,继而引起一系列反应,包括中膜平滑肌细胞、外膜成纤维细胞的表型转化,以及外膜细胞对早期炎性细胞的募集。其中,平滑肌细胞从收缩型转变为合成型是血管重塑的主要环节。LncRNA在氧化应激、炎症、细胞增殖、迁移、表型转换等病理生理过程中发挥重要的生物学功能[19],最重要的是,lncRNA还参与调节血管平滑肌细胞的表型转化。有研究显示,过表达lncRNA-GAS5后,GAS5可通过活化内皮细胞、抑制血管平滑肌细胞表型转化而减轻高血压诱导的血管重塑,该研究进一步证实敲低GAS5的表达能够促进β-连环蛋白(β-catenin)的核转位,从而激活其下游基因c-Myc、cyclin D1及过氧化物酶体增殖物激活受体(PPAR)-δ等的表达,继而促进血管平滑肌细胞表型转化,增加血管平滑肌细胞活性,并促进其凋亡[20],提示GAS5可能为高血压发生血管重塑的潜在保护因素。通过靶向一些关键的调节因子或途径来对主动脉重塑过程进行早期干预代表了一种极具潜力的治疗策略,可能有助于延迟或预防高血压相关的病理后果。
最近的研究表明,TAC模型能快速诱导动脉重塑,包括外膜巨噬细胞的浸润及外膜成纤维细胞向肌成纤维细胞的转化,并具有明显的血管重构[12]。研究发现,TAC诱导的这些动脉组织学变化与血管紧张素Ⅱ(AngⅡ)输注模型及自发性高血压大鼠中观察到的结果相似[21-22]。本研究成功构建了经血管组织形态学验证的TAC模型,并获取组织用于转录水平的测序分析。结果表明,在血管重塑后,与细胞外基质转化及平滑肌细胞收缩相关的转录本发生了显著变化;对获得的差异lncRNA进行反义调节机制预测发现,lncRNA的生物学功能可以不依赖于其与蛋白质编码基因的相对位置。本研究采用RNAplex软件(0.2版)来预测反义lncRNA与mRNA之间的互补结合,获得靶基因集,对靶基因进行GO功能富集及KEGG通路分析,主要富集到了刺激应答、基质黏附及平滑肌细胞收缩相关的条目。此外,对差异lncRNA进行了顺式调节机制预测,结果发现lncRNA的生物学功能可以通过调节其邻近的蛋白编码基因来实现;对获得的靶基因进行GO功能富集及KEGG通路分析,结果富集获得了细胞黏附及与一些疾病和免疫应答相关的条目。近期研究发现,T细胞及各种T细胞来源的细胞因子在几种实验性高血压模型中发挥了重要作用[23]。另有文献报道了氧化应激及免疫激活与高血压之间的联系,发现高血压与树突细胞中活性氧的形成有关,而活性氧的形成会导致γ-酮醛或异酮的形成,并由树突细胞提呈新抗原,从而激活T细胞并促进高血压的发展[24]。
总之,治疗高血压引起的血管重塑,目的是防止终末器官损害,而炎症被认为是这两个事件之间的重要介质。因此,靶向炎症是避免高血压相关器官损害的直接策略。

