Ni/PVA催化剂催化还原对硝基苯酚性能研究
彭奥会,杨 波,韩 琪,黄 琼,徐海涛
(1. 南京信息工程大学 环境科学与工程学院,大气环境与装备技术协同创新中心,江苏省大气环境监测与污染控制高技术研究重点实验室,南京 210044;2. 南京工业大学 环境科学与工程学院,南京 211816)
0 引 言
随着中国工业化进程的不断深入,水污染问题变得越来越严重,水质下降与中国日益增长的环境保护需求之间的矛盾正在升级[1]。废水中的对硝基苯酚(4-NP)来源广泛,主要来自工业或农业生产过程[2-3],很难去除。4-NP具有剧毒作用,对生态环境和人们生活都会造成严重影响[4-5],因此,有效处理含酚废水的技术成为迫切需求。国内外已经提出了几种去除4-NP的方法,主要包括吸附、光催化、高级氧化工艺、催化化学氧化和硝基还原[6-7]。在当前的水处理领域中,硝基还原技术由于具有其便捷性以及低成本,已被广泛采用[8]。同时,前期的研究也表明4-NP的还原产物(对氨基苯酚)具有很好的可重复使用性。然而,该技术必须要有一种高效的新型催化剂来达到还原4-NP的目的。另一方面,使用持续流(CF)系统进行的化学催化过程比传统催化剂具有多个优势,特别是在混合效率、安全性、可重复性等方面[9]。CF系统可以大批量合成这些材料,同时保持对材料性能的高度控制[10]。基于此,可以通过将催化剂与持续流系统相结合,从而实现4-NP平稳地转化为对氨基苯酚(4-AP)。同时,温和的反应条件和流动的反应体系也提高了安全性[11]。
目前研究发现金属纳米颗粒(NPs)在催化[12-13]、电子学[14]、生物学[15]、药物递送系统[16]、生物传感器[17]、发酵[18]和表面活性等方面显示出巨大潜力。因为其比表面积大和表面自由能高的特点,金属纳米颗粒具有出色的吸附性能[19-20]。使用其作为吸附剂用于各种类型的废水处理已成为研究人员的重点。另一方面,贵金属可为催化剂的高活性、选择性和持久性提供保障,因此成为生态环保材料的核心[21-22]。但是,由于贵金属的稀缺性、成本和毒性等方面的制约,近年来,众多的研究开始大力开发非贵金属催化剂[23]。其中,镍(Ni)由于其独特的电子性能、大比表面积和出色的电导率而在非均相催化中显示出巨大的潜力,引起了广泛关注[24]。目前为止,NiNPs已被广泛应用于各个领域,如固定氧化酶[25]、氨分解[26]和对硝基苯酚的氢化[27]。
NiNPs作为活性成分具有成本低、易于制备的优点[28],并且由于其固有的顺磁性质而可以重复使用。然而,由于其相对较低的稳定性,在实际使用中仍然存在一些缺点。研究表明,镍纳米管由于其较高的表面能而在制备和催化反应过程中会发生不可逆地聚集,从而导致催化活性显著降低[29]。因此,开发高效且稳定的NiNPs催化剂成为目前研究的难点与热点。
聚乙烯醇(PVA)海绵是一种多孔载体[30],可形成嵌入结构[31]作为催化剂载体使用。同时PVA材料具有重量轻、价格低、吸水率高和在强碱性条件下稳定存在的特点。基于上述考虑,本文拟通过制备Ni/PVA催化剂,从而抑制NiNPs小颗粒在制备过程中的聚集,同时通过控制注入速率使其满足对硝基苯酚催化还原的需求,最终实现Ni/PVA催化剂作为持续流催化剂将4-NP高效转化为4-AP。
1 实验部分
1.1 样品制备
第一步,用激光切割机(Zing 16~30w)将PVA海绵切成直径20 mm、厚1.5 mm的圆柱体。第二步,称量适量的NiCl3并溶于超纯水(10 mL)中以形成NiCl3溶液并搅拌3 min;然后,将PVA海绵浸入NiCl3溶液中并振摇3~4 min,以使NiCl3完全吸附到PVA海绵的表面。第三步,称取硼氢化钠(NaBH4)100 mg,溶解于20 mL超纯水中制成NaBH4溶液。将所有PVA海绵通过镊子从NiCl3溶液转移到NaBH4溶液中,并使PVA与溶液完全接触。第四步,将样品在60 ℃的烘箱中干燥2 h,然后将Ni/PVA催化剂标记为Ni/PVA-1,Ni/PVA-2,Ni/PVA-3,Ni/PVA-4。最后,将Ni/PVA催化剂组装到注射器(10 mL)中以获得Ni/PVA反应器。催化剂的制备信息如表1所示。

表1 制备催化剂所需材料的质量
1.2 样品的表征方法
采用日本理学公司Rigaku D max/RB型X射线衍射仪(X-ray diffraction,XRD)对催化剂样品进行晶体结构和物相组成分析。采用日本电子株式会社的JSM-5900型扫描电子显微镜(Scanning Electron Microscopy, SEM)测试催化剂样品表面形貌。采用日本岛津公司的AXIS ULTRA DLD仪器进行催化剂的X射线光电子能谱(XPS)测试。采用美国Nicolet 公司的NEXU670型傅立叶变换红外光谱仪(FT-IR) 对催化剂的官能团结构分析。
1.3 催化剂活性评价
Ni/PVA的催化效率可以通过将4-NP转化为4-AP的转化率表示。如图1所示,催化剂的活性评价主要是通过紫外可见分光光度计测量的图谱进行计算[31]。首先,配制不同浓度(0.1,0.2,0.3,0.4 mmol/L)的4-NP溶液,以在紫外可见分光光度计中测量吸收光谱并绘制标准曲线。然后将4-NP溶液(1 mmol/L,5 mL)和NaBH4溶液(0.1 mmol/L,5 mL)添加到样品瓶中并混合在一起。将混合溶液(5 mL)加入到Ni/PVA催化剂。注射速率由微流注射泵(LSP01-1A,兰格恒流泵有限公司)控制。使混合溶液流入离心管(10 mL),然后利用紫外可见分光光度计以测量吸收光谱。最后通过标准曲线的回归方程计算4-NP的还原效率。同时,本文还研究了使用后Ni/PVA催化剂的重复利用。对于每次重复利用,必须清洁用过的催化剂并在60 ℃下真空干燥干燥24 h后,以用于下一个实验。

图1 催化剂实验反应装置Fig 1 Schematic diagram of catalytic testing device
2 结果与讨论
2.1 催化活性
图2为在3 mL/min的条件下将0.1 mol/L NaBH4溶液与1 m mol/L 4-NP溶液混合前后在Ni/PVA-3催化下的紫外可见吸收光谱。在实验过程中,黄色反应试剂(4-NP/NaBH4溶液)最终通过Ni/PVA-3催化剂的处理而脱色,变成透明。根据前期的研究[32]可知,400 nm处的峰为4-NP,295 nm处的峰是4-AP。因此,当注入速率为3 mL/min时,4-NP向4-AP的转化可能导致峰强度变化。此时,通过Ni/PVA-3催化剂实现了4-NP完全转化4-AP,催化效率达到100%。

图2 Ni/PVA-3催化剂反应前后的紫外-可见光吸收光谱Fig 2 UV-vis absorption spectra of 1 mmol/L 4-NP solution with 0.1 mol/L NaBH4 before and after feeding into the Ni/PVA-3 catalyst at 3 mL/min
图3(a)为不同负载量Ni/PVA催化剂的催化效率与注射速率之间的关系。当注射速率小于3 mL/min时,Ni/PVA催化剂的催化效率可达100%。然而,随着注射速度的增加,催化效率逐渐下降。这是因为随着注射速度的增加,活化分子的数量减少,NiNPs表面的有效碰撞频率降低。当进样速率为3 mL/min时,催化效率从100%降至95%,因此进样速率的临界值为3 mL/min,同时选择Ni/PVA-3作为4-NP转化的最佳催化剂。同时,测试了循环次数对Ni/PVA-3样品催化效率的影响(图3(b))。结果表明,Ni/PVA-3的催化活性在6个循环中均未出现明显下降,并且在注入速率为3 mL/min时,在第6个循环周期中Ni/PVA-3的转化率仍然达到95%。前期的研究已发现一些具有较高回收效率的催化剂,例如Pd@CNT-P(6个反应运行后活性降低17%)[33]与ZrO2NPs催化体系(4个使用周期后剩余80%的产率)[34]。与以上催化剂相比,Ni/PVA具有优异的可回收性和稳定性,这主要与NiNPs的高度分散以及PVA海绵的多孔结构有关。此外,多孔结构在减少镍纳米粒子的浸出和聚集中也发挥了作用。

图3 (a) 注射速率对不同负载量Ni/PVA催化剂催化效率的影响;(b) 循环次数对Ni/PVA-3催化效率的影响Fig 3 (a) Effect of injection rate on the catalytic efficiency of Ni/PVA catalysts with different loadings; (b) Effect of recycling time on 4-NP reduction over Ni/PVA-3 catalyst
2.2 样品的微观结构
图4为纯PVA与活性测试前后Ni/PVA-3催化剂中NiNPs的扫描电子显微镜照片。从图中可以看出,PVA海绵具有多孔结构,其拥有各种尺寸的孔,最大的尺寸约为1.77 μm,最小的尺寸约为0.44 μm。而NiNPs主要为直径约0.11~0.79 μm的球形形态,大部分的NiNPs颗粒随机分布并分散聚集在载体表面上。反应后,NiNPs以0.14~0.54 μm的直径高度分散在PVA海绵的表面上。此外,从图4(b)与图4(c)可以看出,反应前后的Ni/PVA催化剂中的NiNPs的粒径未出现显著差异,表明Ni/PVA催化剂反应前后NiNPs的形态未发生明显变化从而影响NiNPs的活性,这也是Ni/PVA催化剂具有优异的可回收性和稳定性的原因之一。

图4 SEM照片:(a) 纯PVA, (b)新鲜Ni/PVA样品, (c)使用过后的Ni/PVA样品Fig 4 SEM micrograph of (a) PVA; (b) Ni/PVA; (c) used Ni/PVA
2.3 样品的热重分析
通过热重分析(TGA)研究了PVA海绵和Ni/PVA-3催化剂的热稳定性(图5)。TGA的结果表明,纯PVA在100~200 ℃出现第一个降解阶段,此时质量损失为8%,其主要是多烯结构的形成和水的去除[34]。随着温度的进一步升高(> 350 ℃),这些多烯结构转变为低分子量脂族产物。与纯PVA相比,一方面,浸渍后Ni相中存在有机基质;另一方面,NiNPs在PVA海绵上的自组装会消耗-OH量,因此负载NiNPs颗粒的Ni/PVA-3催化剂在100~200 ℃内没有降解。然而,与PVA海绵相比,Ni/PVA所需的降解温度更低(跨度在250~500 ℃)。主要是因为NiNPs的导热性能优于PVA海绵,因此,当环境温度升高时,NiNPs更容易升高温度并导致PVA降解。最后,纯PVA海绵几乎完全失重(100%),而Ni/PVA-3的失重增加到95.9%。因此,可以推断出Ni/PVA-3催化剂中的NiNPs含量为4.1%。
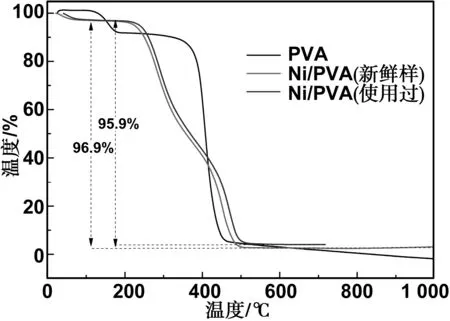
图5 PVA和Ni/PVA样品的TGA曲线Fig 5 TGA curve for Ni/PVA catalyst
2.4 样品的物理化学结构
图6(a)为PVA与使用前后Ni/PVA催化剂的X射线衍射图。在19°(跨越15~25°)出现的宽的无定形峰对应于聚乙烯醇。然而,在Ni/PVA催化剂反应前后,样品中均未出现NiNPs的明显XRD衍射峰,这主要是由于NiNPs在催化剂表面形成了超细或高度分散的Ni颗粒[35]。同时,聚乙烯醇的无定形峰强度没有明显变化,这表明在制备NiNPs期间PVA海绵的结构没有明显变化。此外,通过FT-IR光谱对纯PVA与使用前后Ni/PVA催化剂的化学组成和化学键进行了分析(图6(b))。从图中可以看出,PVA与Ni/PVA催化剂在500~4 000 cm-1的波长范围内出现一系列振动峰。其中,3 370 cm-1到3 547 cm-1的振动峰为PVA中O-H键(氢键)的拉伸振动[36]。2 920 和1 007 cm-1处的振动峰分别属于C-H键和C-O键的拉伸振动。1 300~1 500 cm-1处的振动峰为CH2对称和不对称拉伸振动[37]。900~1 200 cm-1处的振动峰为C-O-C和C-O键的组合。而784 cm-1处的振动峰则为H-C-H的拉伸振动。对比纯PVA与Ni/PVA催化剂可以看出,纳米Ni的添加并未影响PVA海绵之间的基本相互作用。同时,反应前后的Ni/PVA催化剂未出现明显的振动峰移动,这也证实了PVA海绵的稳定结构。

图6 PVA和Ni/PVA样品的(a) XRD谱图;(b) FT-IR谱图Fig 6 (a) XRD and (b) FT-IR spectra of PVA and Ni/PVA catalysts
2.5 样品的表面元素分析
X射线光电子能谱(XPS)可以更好地分析Ni/PVA催化剂的结构和表面组成。图7(a)为PVA海绵和使用前后的Ni/PVA催化剂XPS扫描全谱图。从图中可以看出,PVA基本上由C和O元素组成。图7(b)为PVA和使用前后Ni/PVA催化剂的C 1s谱图,3个样品均显示存在3种不同类型的碳,分别位于287.5 ,286.2和284.8 eV,其中,碳与氧双键(C=O)对应于位于287.5 eV的峰;与氧结合的碳(C-O)对应于位于286.2 eV的峰;脂族碳键(C-C/C-H)对应于284.8 eV处的峰[38]。从图中可以看出,使用前后Ni/PVA催化剂C-O和C = O峰强度明显下降,其主要原因是由于NiNPs和PVA之间相互作用,从而改变了C-O和C = O周围的环境。图7(c) PVA和使用前后Ni/PVA催化剂的O 1s光谱。所有样品中只有一个峰,其代表C-OH基团。从图中可以看出,对比PVA海绵和使用前后的Ni/PVA催化剂,C-OH基团向右移动且峰强度减弱,其主要原因是NiNPs的存在和与4-NP的反应还原了PVA表面的C-OH基团。图7(d)为使用前后Ni/PVA催化剂的Ni 2p光谱。从图中可以看出Ni/PVA催化剂中,880、873、862与856 eV处的峰为Ni0[39],并为检测出Ni2+的峰,表明在催化剂制备过程中Ni2+可以完全还原为Ni0。
表2为PVA与使用前后Ni/PVA催化剂的原子分布和百分比。从表中可以看出,Ni/PVA与纯PVA相比C/O原子比下降,这主要是由于Ni/PVA制备过程中氧气的参与造成的。同时,使用过的Ni/PVA催化剂中Ni的含量相较于新鲜Ni/PVA催化剂略微下降,表明Ni/PVA催化剂有较好的重复性。此外,从表中还可以看出,Ni/PVA催化剂制备过程中,NiNPs与PVA之间的相互作用致使C-O和C=O基团的相对含量发生变化,这也表明NiNPs与PVA之间的相互作用主要为氢键。

图7 不同催化剂的高分辨率X射线光电子能谱图:(a) 全谱, (b) C 1s, (c) O 1s和(d) Ni 3dFig 7 (a) survey, (b)C 1s, (c) O 1s, and (d) Ni 3d high-resolution scan spectra of PVA, Ni/PVA and used Ni/PVA catalysts

表2 PVA, Ni/PVA和使用过后Ni/PVA催化剂表面原子分布和比例
3 结 论
(1)通过改进的浸渍和自组装方法制备了聚乙烯醇海绵(PVA)支撑的镍纳米粒子催化剂Ni/PVA,并创新性的将Ni/PVA催化剂用于持续流还原硝基芳族化合物(4-NP),当NiNPs剂量为500 mg时,以3 mL/min的注入速度存在4-NP的100%转化。同时,Ni/PVA催化剂还具有出色的可回收性,可在6次回收后保持95%的转化率。
(2)PVA的多孔结构既有效抑制了NiNPs的团聚,而且还确保了Ni/PVA催化剂的稳定性。Ni/PVA催化剂具有高催化效率、可重复使用性和低成本的特点,在水处理领域具有很大的发展潜力。

