急性缺血性卒中静脉溶栓治疗研究新进展
刘慧慧,姜倩梅,戴婧,刘春风,2
卒中是全球第二大死亡原因,是导致我国成人死亡和残疾的首位原因[1],其中71%为缺血性卒中[2]。2019美国心脏学会(American Heart Association,AHA)/美国卒中学会(American Stroke Association,ASA)指南[3]更新了对缺血性卒中静脉溶栓的推荐,除了对发病3 h内、3~4.5 h的患者溶栓推荐外,新增了对醒后或发病时间不明卒中患者(在发现症状后4.5 h内,MRI-DWI阳性且FLAIR阴性的条件下)溶栓推荐。本文回顾了25年来静脉溶栓的发展历程,并综述静脉溶栓治疗的最新研究进展,即组织窗评估的影像学方法、静脉溶栓的药物选择及未来发展前景,希望能为急性缺血性卒中静脉溶栓治疗的临床实践提供参考。
1 静脉溶栓的发展历程
1995年发表在NEJM上的美国国立神经疾病和卒中研究院急性卒中静脉溶栓试验(National Institute for Neurological Disorders and Stroke,NINDS)[4]证实了急性缺血性卒中静脉溶栓的有效性和安全性,从此开启了卒中血管再通治疗的新纪元。近年来随着影像技术的发展和临床研究的开展,静脉溶栓治疗由时间窗理念逐渐扩展到组织窗(表1)。2019年发表的急性缺血性卒中患者静脉溶栓扩展时间窗研究(Extending the Time for Thrombolysis in Emergency Neurological Deficits,EXTEND)[5]结果证实了基于多模影像筛选的超时间窗溶栓的有效性和安全性,每治疗11例发病在4.5~9 h或者醒后卒中且伴有影像不匹配的患者就有1例可获得良好功能预后。Campbell等[6]对平面回波成像指导的溶栓评价试验(Echoplanar Imaging Thrombolytic Evaluation Trial,EPITHET)、欧洲协作性急性卒中溶栓试验-4(European Cooperative Acute Stroke Study 4,ECASS-4)、EXTEND试验等进行Meta分析,得出了相似的结论,即每治疗14例醒后卒中或者发病在4.5~9 h且伴有影像不匹配的患者就有1例可获得良好功能预后。基于该研究结果,该领域学者普遍认为静脉溶栓时间窗应该从4.5 h扩展到9 h,前提是患者能够进行多模影像的检查并存在符合溶栓要求的组织窗。
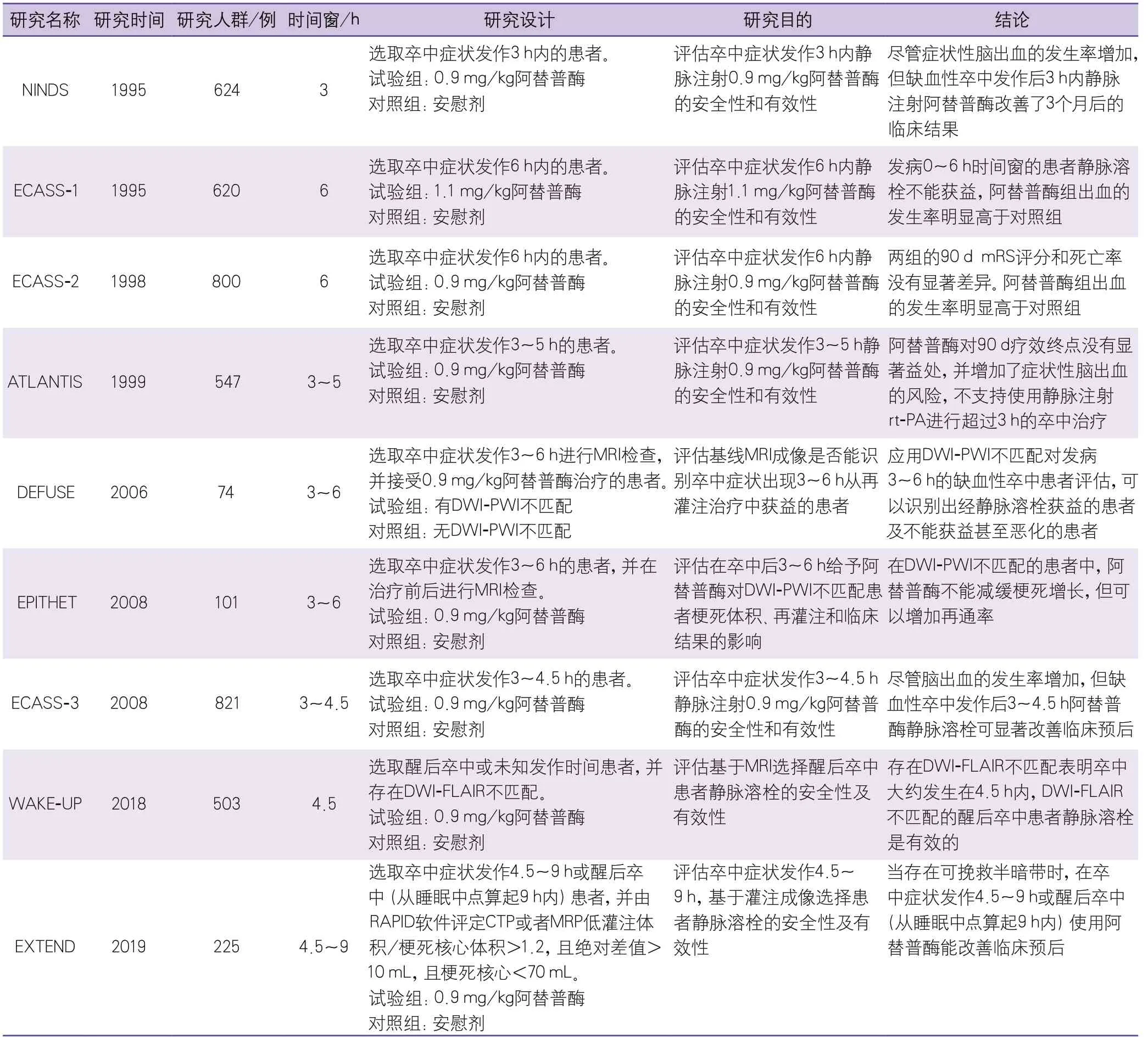
表1 rt-PA静脉溶栓随机对照研究
2 组织窗的理论基础——缺血半暗带
脑细胞首先需要维持细胞膜的稳定,然后才能传递信息,这两种活动需要的能量和脑血流有不同的阈值,高阈值代表可逆性膜功能损伤(电衰竭),低阈值代表不可逆膜功能损伤和形态损伤(细胞能量衰竭),处于高低阈值之间的脑组织就是缺血半暗带[8]。PET是目前判断缺血半暗带的金标准[9],根据脑组织缺血程度不同,可分为中心梗死区、弥散异常区、灌注异常区和最外层良性缺血区[10-11]。Chung等[12]证实了良好缺血半暗带与患者功能独立结局显著相关,即使是延迟的血管再通,这种相关性依然显著。然而,PET虽然是金标准,但价格昂贵,临床难以推广。因此,临床上常常以CTP和磁共振灌注成像作为判定缺血半暗带的标准。最新指南推荐,如果超时间窗(6~24 h)或发病时间不明,强烈推荐采用灌注成像(CTP或PWI)评估核心梗死区和缺血半暗带[3]。目前,临床最常用的定量评估缺血半暗带的影像学检查方法主要有CTP、DWI、PWI、FLARE、T2WI等。
不同检查手段对半暗带有不同的参数评估阈值。在CTP灌注参数中,核心梗死区的脑血容量(cerebral blood volume,CBV)(每100 g脑组织的血流毫升数)、脑血流(cerebral blood flow,CBF)(1 min内每100 g脑组织所流经的血流量)均下降,但半暗带组织CBV下降后可通过扩张小动脉来代偿,使相应的CBF下降而CBV保持不变甚至增加,因此CBF下降而CBV轻度升高为半暗带区。根据不同的后处理软件,大多数研究用于定义梗死核心的CBF阈值为30%~45%[13-15]。其中大部分研究中常用的是CBF阈值<30%的正常脑血流,具有较高的特异性,其他CBF阈值如<38%[13]和35%[16]等各有优劣;而造影剂达峰时间Tmax>6 s的区域为公认的低灌注区[17];Tmax>6 s的区域减去CBF<30%的区域就是半暗带区。最近,Martins等[18]报道,由于“幽灵梗死核心”(ghost infarct core)(初始梗死核心减去最终梗死体积的差异区>10 mL)的存在,在极早时间窗内和快速完全再灌注的患者中,CTPCBV可能高估了入院时的梗死核心。Boned等[19]发现CTP在38%的患者中高估了10 mL以上的梗死核心,Geuskens等[20]也观察到,与DWI相比,CTP有高估梗死核心的可能性。因此,基于CTP决定再灌注治疗策略可能会剔除部分仍可受益的患者。
此外,也有许多因素能够影响CTP上梗死核心和半暗带的评估:第一,如果软脑膜侧支循环使部分缺血脑组织实现再灌注,则缺血核心在CTP上可能被低估,此时CT平扫上的低密度影至关重要;第二,CTP软件使用对侧大脑作为检测核心的参考,检查时两大脑半球的不对称也可能影响最后的结果;第三,影像学处理使用的自动化软件包包括RAPID、OLEA、GE、PHILIPS、Siemens Syngo、Viz.ai、Mistar以及国内复旦研发的F-STROKE[21]等,不同的后处理软件对其评估也有一定的影响[22-24];最后,灰质和白质对缺血性损伤的耐受性是不同的,特别对于脑白质疏松的患者,需要不同的CBF阈值来明确梗死核心,这也是目前研究的重点和难点[28]。
虽然CTP已经在前循环中梗死得到了很好的应用,但仅有少数研究表明,CTP可能在后循环中有实用价值[29-31]。因此,对于后循环卒中和一些把MRI作为常规卒中流程的欧洲国家和国内部分卒中中心,基于MRI的评估可能是更好的选择。其中,DWI可在发病后3 min发现急性脑缺血,具有较高的敏感性和特异性(>90%)[32]。大多数学者认为,DWI高信号区代表核心梗死区,然而DWI的高信号区也与时间有关:在再通后1~3 h,DWI逆转是可变的;超过4.5 h后,逆转的组织体积通常不超过总DWI损伤的10%,大多数患者<5 mL[33-34]。基于此引入了FLARE成像评估梗死核心,即只有出现FLAIR高信号才提示梗死已不可逆。综上所述,改进不同灌注成像参数和成像方法,使其能更好地预测缺血半暗带,从而筛选出能够从再灌注治疗中获益的超时间窗患者(即组织窗),是当前研究努力的方向。
3 组织窗的临床影像评估
2019 AHA/ASA指南表明,溶栓疗效与时间相关,对于有静脉溶栓指征的患者,治疗应该尽快开始,而不是等待多模式神经成像评估,如CTP和磁共振灌注成像(Ⅰ类推荐,B级证据)[3]。但是,对于超时间窗、发病时间不明或醒后卒中患者,通过多模影像评估组织窗,可以更精准地识别潜在的溶栓获益人群,近两年的基于MRI指导的醒后卒中患者静脉溶栓的有效性和安全性试验(Efficacy and Safety of MRI-Based Thrombolysis in Wake-Up Stroke,WAKE-UP)和EXTEND研究[5]证实了这一理念。如果没有可以挽救的缺血半暗带,血管开通不仅无效还可能增加高灌注的风险。因此,引入影像学标准的目的就是明确可能从溶栓治疗中获益的组织分区,即组织窗。组织错配是指灌注不足和梗死核心之间的病灶体积差(即不匹配),是存在可挽救脑组织体积的替代标记。
目前常用的不匹配主要有PWI-DWI不匹配、灌注成像不匹配、临床症状-梗死核心区不匹配(clinical-core mismatch,CCM)、DWIFLAIR不匹配和临床症状-ASPECTS不匹配(clinical-ASPECTS mismatch或者clinical-CT mismatch)[36]。其中,PWI-DWI不匹配是指DWI高信号区代表梗死核心区(即半暗带内界),PWI异常区代表低灌注区域(即半暗带外界),两者差值即为组织窗。灌注成像不匹配是指在CTP引起的灌注缺损(常指达峰时间Tmax>6 s)和局部缺血核心区(梗死核心常指CBF<30%的正常脑血流)之间不匹配。这两者都是基于灌注成像的不匹配,已在各大研究和临床实践中广泛应用,例如,取栓研究中的急性缺血性卒中患者扩展时间窗静脉溶栓联合机械取栓治疗(Extending the Time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy,EXTEND-IA)试验[37]、Solitaire支架取栓治疗急性缺血性卒中试验(SolitaireTMWith the Intention For Thrombectomy as PRIMary Endovascular Treatment,SWIFTPRIME)[38]、弥散/灌注成像筛选的静脉溶栓患者试验(Diffusion and perfusion imaging Evaluation For Understanding Stroke Evolution,DEFUSE)-3[39],以及最近的延长静脉溶栓时间窗的EXTEND研究[5]和ECASS-4研究[40]。而在应用Trevo装置血管内治疗经影像和临床不匹配筛选的醒后卒中和晚就诊卒中患者试验(DWI or CTP Assessment with Clinical Mismatch in the Triage of Wake Up and Late Presenting Strokes Undergoing Neurointervention with Trevo,DAWN)[41]中,考虑到半暗带区域受侧支循环等诸多因素的影响,因此只纳入了梗死核心,用年龄调整的NIHSS评分来代替低灌注区指标,此即CCM。DWI-FLAIR不匹配指DWI阳性、FLAIR阴性的区域被视为半暗带,多用于醒后卒中。2018年的WAKE-UP研究证明了FLAIR和DWI不匹配可以筛选出发病时间在4.5 h内的患者,其研究结果也被写入了2019 AHA/ASA指南。而采用类似入组标准的发病时间不明确的急性醒后卒中静脉溶栓试验(THrombolysis for Acute Wake-up and Unclear-onset Strokes,THAWS)[42]使用低剂量(0.6 mg/kg)阿替普酶与对照组相比,未能显示低剂量阿替普酶的有效性。然而,并不是所有卒中中心都能随时行MRI或者灌注检查,在没有一站式多模式成像的卒中中心,临床-ASPECTS不匹配(NIHSS评分≥6分或10分并且ASPECTS评分≥6分)也是一种有效的选择办法[43-44],但是其准确性还有待验证[45]。虽然组织窗代替时间窗是今后血管再通治疗的发展方向,但同时错配定义的多样性也预示着组织窗评价的优化在未来卒中治疗中还有很长的一段路需要走。
4 药物选择-阿替普酶和替奈普酶
正是基于NINDS的研究结果,美国食品药品监督管理局于1996年正式批准rt-PA的临床应用,我国也于2004年批准了rt-PA的应用。rt-PA是组织型纤溶酶原激活剂经过基因修饰后的产物,属于第二代溶栓药物,可直接激活纤溶酶原,是当前指南里唯一Ⅰ类推荐的静脉溶栓药物。
最近,第三代溶栓药物——替奈普酶的出现,丰富和改进了溶栓药物的选择。替奈普酶主要有以下特点[46]:①方便:与传统的阿替普酶的用法(0.9 mg/kg,最大量90 mg,总量的10%在1 min内静推,剩余的90%持续静滴1 h)相比,替奈普酶半衰期更长,只需在10 s内单次推注;②有效:与rt-PA相比,对纤维蛋白特异性更高,有更高的血管再通率;③相对安全,相比于一般的rt-PA,替奈普酶对血栓处纤维蛋白有较高的特异性,且其活性可被内生的抑制剂所抑制;④相比阿替普酶价格便宜,可以减少患者使用前的经济顾虑,从而增加溶栓患者比例。
挪威急性卒中替奈普酶静脉溶栓试验(Norwegian Tenecteplase Stroke Trial,NOR-TEST)[47]纳入了发病4.5 h内更广泛的卒中人群(包括4%醒后卒中,适合机械取栓者行桥接治疗,阿替普酶和替奈普酶两组共1100例患者,基线NIHSS评分中位数4分),比较0.4 mg/kg替奈普酶治疗和标准阿替普酶治疗,结果显示两组的安全性和有效性均无显著差异。基于该项研究结果,2019 AHA/ASA指南推荐对于轻型卒中患者,替奈普酶(0.4 mg/kg)可考虑作为阿替普酶的替代用药(Ⅱb类推荐,B级证据)。而对于中度(6分<基线NIHSS评分<14分)、重度(基线NIHSS评分≥15分)卒中患者,Kvistad等[48]比较了替奈普酶0.4 mg/kg与阿替普酶0.9 mg/kg的安全性和有效性,结果发现良好预后率和症状性颅内出血发生率在两组间是相似的,但是接受替奈普酶治疗的重度卒中患者90 d死亡率增加。
2018年发表在NEJM的缺血性卒中血管内治疗前应用替奈普酶最佳剂量研究(Determining the Optimal Dose of Tenecteplase Before Endovascular Therapy for Ischemic Stroke,EXTEND-IA TNK)[49],入组了发病4.5 h内静脉溶栓和发病6 h内行取栓治疗的患者,比较替奈普酶0.25 mg/kg组和标准阿替普酶治疗组,发现替奈普酶良好再灌注率更高(22%vs10%),而安全性两组无显著差别。由此,最新2019 AHA/ASA指南推荐,桥接治疗优选替奈普酶(单次静脉团注0.25 mg/kg,最大剂量25 mg)可能是合理的(Ⅱb类推荐,B级证据)。最近的EXTEND-IA TNK part 2试验[50]比较了桥接治疗时不同剂量替奈普酶(0.40 mg/kgvs0.25 mg/kg)的安全性和有效性,结果发现0.40 mg/kg的替奈普酶组不优于0.25 mg/kg组。目前的试验结果都是替奈普酶在4.5 h时间窗内的静脉溶栓试验,未来的替奈普酶vs阿替普酶治疗伴血管闭塞的轻型缺血性卒中试验(A Randomized Controlled Trial of TNK-tPA Versus Standard of Care for Minor Ischemic Stroke With Proven Occlusion,TEMPO-2)(NCT02398656)和发病4.5~24 h缺血性卒中替奈普酶静脉溶栓试验(Tenecteplase in Stroke Patients Between 4.5 and 24 Hours,TIMELESS)(NCT03785678)将使用多模式影像学策略,这些试验将填补替奈普酶在超时间窗溶栓领域的空白。
5 静脉溶栓的未来前景
对于超时间窗、发病时间不明或醒后卒中患者,基于多模影像的组织窗筛选适合溶栓患者已逐渐成为临床治疗趋势,时间窗概念将会越来越模糊。尽管如此,对于发病时间4.5 h内的卒中患者普通CT依然是首选影像标准。对于怀疑为大血管闭塞患者,是否可以跨过静脉溶栓直接取栓,尽管刚刚发表的中国三级医院大血管闭塞性急性缺血性卒中患者行直接机械取栓治疗(Direct Intra-arterial Thrombectomy in Order to Revascularize AIS Patients With Large Vessel Occlusion Efficiently in Chinese Tertiary Hospitals,DIRECT-MT)研究[51]的主要结局显示直接取栓非劣于桥接取栓,但是依然可以看出静脉溶栓患者的取栓前血管再通率显著高于直接取栓患者取栓前结果(7.0%vs2.4%)。特别是新一代溶栓药替奈普酶的团注使用方法和更高的血管再通率,未来可能依然不能摒弃桥接取栓治疗。另外,对于后循环的超时间窗血管再通治疗,不管是取栓还是静脉溶栓,都还留有很大的研究空白和进步空间,需要探索更准确的影像学技术或者错配方式来评估后循环的组织窗。
【点睛】对于超时间窗、发病时间不明或醒后卒中患者,基于多模影像的组织窗筛选适合溶栓患者已逐渐成为临床治疗趋势,时间窗概念将会越来越模糊。尽管如此,对于发病时间4.5 h内的卒中患者普通CT依然是首选影像标准。

