虎斑乌贼神经肽sCAP 基因克隆与表达分析
(浙江海洋大学海洋科学与技术学院,国家海洋设施养殖工程技术研究中心,海洋生物种质发掘与利用国家地方联合实验室,浙江舟山 316022)
目前关于头足类神经肽的研究主要集中在如GnRH、FaRPs 和APGWamide 等分子多肽方面[1-3],而在生理调节过程中意义重大的sCAP 研究较少。sCAP 在刺激心脏运动[4]、控制肌肉收缩[5]、输卵管收缩、增强后肠收缩[6]及生物蜕皮等生理过程中有重要作用[7]。sCAP 最初发现于长蛸Octopus minor 的脑组织中,有Ocp-1、Ocp-2、Ocp-3 和Ocp-4 四种类型[8]。其相关类似物oct-SCPRP 也被发现于真蛸Octopus vulgaris中,具有收缩牙齿及舌头牵拉肌的作用[9]。有研究表明Ocp-1 和Ocp-2 是非洲大蜗牛Achatina fulica 中Achatin-Ⅰ的同源基因产物,Ocp-1 可通过影响红螺Rapana thomasiana 中谷氨酸含量刺激心脏收缩[10-11]。综上,开展对sCAP 参与的各种生理功的鉴定研究具有非常重要意义。
虎斑乌贼Sepia pharaonis,属软体动物门Mollusca、头足纲Cephalopoda、十腕目Sepiida、乌贼科Sepiidae、乌贼属Sepia,广泛分布于35 °S-30 °N、30 °E-140 °W 的海域。虎斑乌贼为经济头足类,其个体较大,口味鲜美,蛋白质含量高,且适合高密度养殖、有较强的抗病力及快速生长等优点,是经济价值较高的名优新品种。但是自20 世纪80 年代以来,由于海域生态环境恶化和过度捕捞,虎斑乌贼自然资源遭到极大破坏,并开始出现衰退现象[12]。目前,虎斑乌贼的人工养殖和增殖放流工作已经在我国的一些地区展开,并且取得了实际经济效益。
本研究采用RACE 技术克隆获得虎斑乌贼sCAP 基因(以下简称SpsCAP)的cDNA 全长序列并开展生物信息学分析;采用qRT-PCR 技术研究sCAP 基因在虎斑乌贼成熟的雌性个体和雄性个体不同组织中表达的差异性,进而推测sCAP 基因在乌贼中的可能生理功能,并为虎斑乌贼的种质资源保护和开发奠定一定理论基础。
1 材料与方法
1.1 实验样品
性成熟时期的虎斑乌贼(体重1 500~2 000 g)从浙江省温州市苍南养殖基地采样,虎斑乌贼被麻醉后解剖,取出组织放在冻存管内,将冻存管立即放入液氮中,在液氮中存放24 h 后,用干冰快递运回实验室,-80 °C 保存备用。
1.2 总RNA 的提取及cDNA 第一条链的合成
虎斑乌贼各组织总RNA 使用RNAiso Plus(Takara 公司)进行提取。2 μg 总RNA 用于cDNA 第一条链的合成,实验方法参照M-MLV (Rnase H-)反转录试剂盒(Takara 公司)说明书方法进行。
1.3 虎斑乌贼sCAP 基因核心片段的扩增
根据NCBI 已有的商乌贼(Sepia officinalis,AFS32691.1)、真蛸(AB198190.1)、静水椎实螺(Lymnaea stagnalis,AF056941.1)和长牡蛎(Crassostrea gigas,EU152957.1)的sCAP 基因序列,设计虎斑乌贼sCAP 基因核心片段的简并引物Sp-sCAP-F 和Sp-sCAP-R,见表1。
以性成熟时期的虎斑乌贼脑组织cDNA 为模板,采用25 μL PCR 体系根据Premix Taq 试剂(Takara公司)说明书进行,PCR 产物经过用1.2%的琼脂糖电泳检测后送至上海生工进行测序。
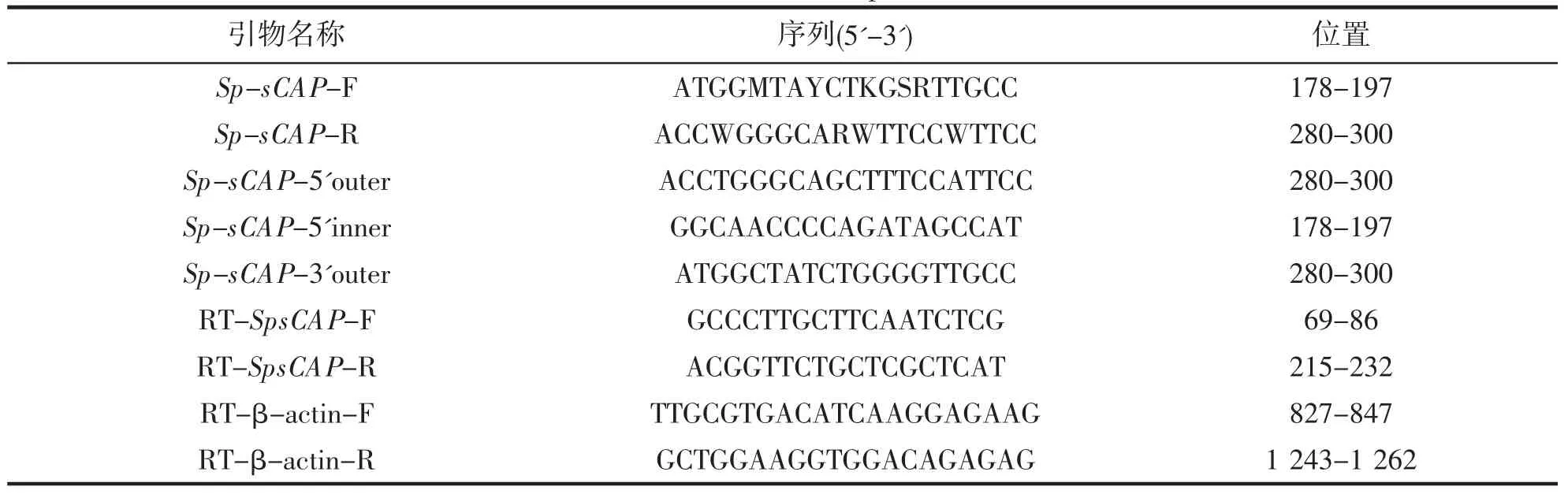
表1 SpsCAP 基因所用引物Tab.1 Primers used in SpsCAP clone
1.4 虎斑乌贼sCAP 基因cDNA 全长的克隆
根据SpsCAP 基因核心序列设计5’RACE 和3’RACE 的引物 (表1)。cDNA 全长的扩增根据SMARTTMRACE 试剂盒(Takara 公司)说明书进行。PCR 产物经纯化、连接、转化最后将菌液送至上海生工生物公司测序。
1.5 虎斑乌贼sCAP 基因cDNA 全长序列分析方法
采用DNAMAN 软件对SpsCAP 基因的5’端、3’端和核心序列的测序结果进行拼接,获得SpsCAP 基因的全长序列;在NCBI 上预测蛋白的ORF 并将全长序列与ORF 的验证序列进行比对;利用在线软件Expasy-ProtParam(http://we-b.expasy.org/protparam/)[13]将其翻译为氨基酸序列并预测蛋白的相对分子质量和等电点;采用TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白的跨膜结构域;利用SignalIP[14](http://www.cbs.dtu.dk/service/SignalP/) 预测蛋白质序列中的信号肽区域;利用在线软件Net-NGly 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/) 预测蛋白的糖基化位点;利用在线软件NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/) 预测蛋白的磷酸化位点;利用ExPASy-ProtScale[15](http://web.expasy.org/cgi-bin/protscale/protscale.pl)预测蛋白的亲疏水性;利用在线软件Prabi(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_gor4.pl)预测蛋白的二级结构;利用ClustalX[16]以及MEGA6.0[17]软件将其与已知物种的心激肽基因进行同源性比对;用MrBayes v3.2.6 软件[18]采用贝叶斯推理方法(Bayesian inference,BI)构建系统进化树,建立4 个马尔可夫链,共运行2 000 000 代,每100 代进行一次抽样,舍弃样本25%后根据残余样本计算后验概率(Posterior probability),利用在线软件ITOL(http://itol.embl.de/itol.cgi)对进化树进行注释[19]。
1.6 虎斑乌贼sCAP 基因组织定量表达特异性分析
选取性成熟时期的虎斑乌贼取出不同组织包括胃、肝脏、皮肤、肠、胰、鳃、肌肉、心脏、脑、视叶、性腺(精巢和卵巢)、缠卵腺和副缠卵腺,根据已经得到的虎斑乌贼sCAP 基因的cDNA 全长,利用Primer 6.0 设计qRT-PCR 所用到的引物,选择β-肌动蛋白作为内参基因。虎斑乌贼sCAP 基因qRT-PCR 所需的引物见表1。使用相对定量方法分别检测雌、雄个体虎斑乌贼sCAP 基因不同组织的表达特异性,雌雄各选择3只做3 次生物学重复,每个个体的每个组织的定量表达做3 次机械重复。qRT-PCR 实验操作参考SYBR Premix Ex TaqTM II Kit(Takara 公司)试剂说明书进行。
2 结果
2.1 虎斑乌贼sCAP 基因cDNA 全长分析
虎斑乌贼sCAP 的序列全长为666 bp,包含可编码86 个氨基酸的261 bp 的ORF、109 bp 的5'-UTR、296 bp 的3'-UTR。预测分析表明该基因所表达的蛋白MW 为9.3 kDa,pI 为8.52。
虎斑乌贼sCAP 的前体蛋白预测含有20 个氨基酸的信号肽段,跨膜结构域为7-29th位点(图1、图2)。前体蛋白序列包含蛋白修饰位点为:2 个N-糖基化位点(5,21);10 个磷酸化位点包含6 个Ser 位点(3-7-23-35-72-79)、3 个Thr 位点(18-22-76) 和1 个Tyr 位点(24)(图1)。预测二级结构发现该前体蛋白含33.72 %的延伸链和66.28 %的无规则卷曲。通过亲疏水性分析,发现该蛋白含有28 个疏水性氨基酸和58个亲水性氨基酸,因此推测其为亲水性蛋白(图3)。

图1 虎斑乌贼sCAP 基因cDNA 全长Fig.1 Full-length cDNA sequence and predicted amino acid sequence of sCAP in S.pharaonis
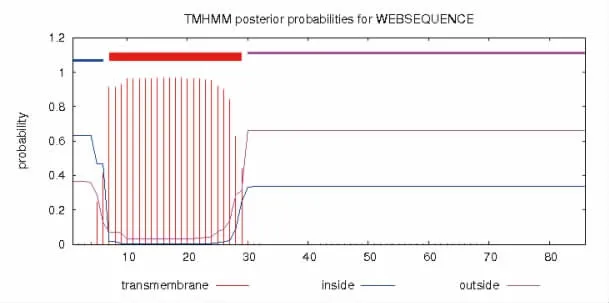
图2 SpsCAP 蛋白跨膜结构域预测结果Fig.2 Transmembrane domain result for SpsCAP
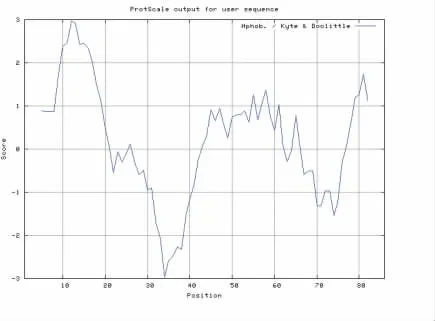
图3 SpsCAP 亲疏水性分析Fig.3 Hydrophobic analysis of SpsCAP
2.2 虎斑乌贼sCAP 氨基酸序列分析
虎斑乌贼的sCAP 氨基酸序列通过MEGA6.0 和DNAMAN 软件与其它6 个物种进行比对(图4)。结果显示,虎斑乌贼sCAP的氨基酸序列与曼氏无针乌贼(Sepiella japonica,MG779491)、商乌贼(AFS32691.1)、双斑蛸(Octopus bimaculoides,XP014771607.1)、真蛸(Q2V2G5.1)的相似性分别为98%、88%、66%、54%,与曼氏无针乌贼的相似度最高;与野蛞蝓(Deroceras reticulatum,ARS01388.1)的相似性为35%,与Pleurobranchaea californica(ABU82753.1)的相似性仅为33%。

图4 SpsCAP 氨基酸序列比对Fig.4 Multiple alignment of the deduced amino acid sequences of sCAP precursor from S.pharaonis and other species
2.3 虎斑乌贼sCAP 基因的系统进化树构建
在NCBI 上选取了57 条不同物种的与sCAP 功能类似的心激肽基因的序列,通过MEGA 6.0 软件将这些序列与SpsCAP 基因的氨基酸序列进行比对,再通过MrBayes v3.2.6 软件基于BI 的方法构建系统进化树(图5)。结果显示,虎斑乌贼sCAP 基因与曼氏无针乌贼的亲缘关系最近,其次是商乌贼,并且与双斑蛸、真蛸等软体动物聚为一支,与节肢动物相应的分子聚类成另外的分支(图5)。
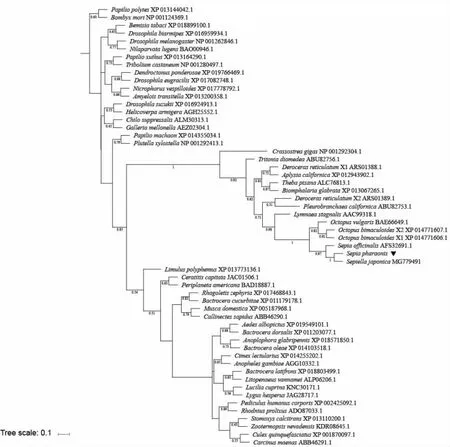
图5 SpsCAP 同源氨基酸序列构建的贝叶斯系统进化树Fig.5 Evolutionary trees based on SpsCAP homologous amino acid sequences with Bayesian methods
2.4 虎斑乌贼sCAP 基因组织定量表达特异性分析
SpsCAP 在虎斑乌贼的脑、视叶、胃、肝、皮肤、肠、胰脏、性腺、肌肉、心、缠卵腺、副缠卵腺各个组织中均有表达(图6)。其中SpsCAP 在视叶组织中表达量最高,其次是脑组织,并且与其它组织进行多重比较有显著性差异;雄性乌贼的视叶组织与雌性乌贼的视叶组织表达量也存在显著性差异,且雄性乌贼的视叶相对表达量是雌性乌贼的相对表达量的4 倍,造成这种差异可能原因是SpsCAP 在雌雄个体上发挥的作用存在差异。
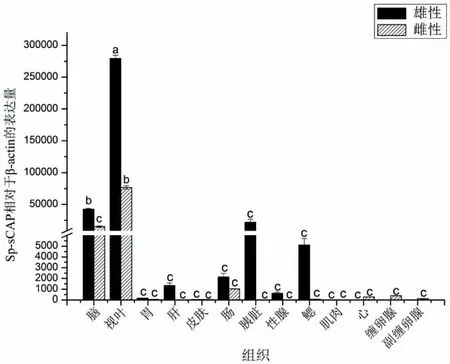
图6 SpsCAP 基因不同组织表达特异性Fig.6 Distribution of SpsCAP mRNA in various tissues
3 讨论
目前有关于心激肽的研究集中在甲壳类、昆虫类以及腹足类中。CAPs 和CAP2 是存在于昆虫的中枢神经系统,也同样具有刺激心脏运动的功能[20],CAP2 还参与胚胎发育中肠道运动的调节[21];SCP 和SCPB 被称为小心激肽,它们不仅可以刺激心脏运动[22],还可以控制肌肉的收缩[23];LCP 被称为大心激肽,研究表明它可能具有刺激心脏运动的作用[24];CCAP 最初是从普通滨蟹Carcinus maenas 的围心器官中被发现的[25],它不仅可以刺激心脏运动,还参与生物的蜕皮[26]、刺激输卵管收缩[27]、增强后肠的收缩[28]、控制肌肉的收缩、调节包括视觉和嗅觉在内的各种神经系统的功能[29],还具有作为脂肪动力激素释放因子的作用[30]和调节口腔胃神经节等功能[31]。因此可以推测SpsCAP 也可能具有以上提出的功能。
本研究应用qRT-PCR 技术和RACE 技术,首次从虎斑乌贼脑组织中克隆到sCAP 基因,并研究其在雌雄虎斑乌贼各个组织中的差异表达。SpsCAP 全序列与其他头足类的相应序列同源性均较高,与曼氏无针乌贼的相应序列同源性最高。进化分析显示虎斑乌贼sCAP 与曼氏无针乌贼、真蛸等软体动物相应的同源分子聚为一支,而与节肢动物相应的分子聚类成另外的分支。
通过qRT-PCR 表达分析,SpsCAP 的表达在雄性及雌性虎斑乌贼的视叶中被明显检测到,其次是脑,表明sCAP 可能通过虎斑乌贼的神经系统来控制其活动。SpsCAP 在缠卵腺及副缠卵腺中微量表达说明其可能与输卵管的收缩功能有关[32]。从表达量分析,雄性个体的表达量明显高于雌性个体,表达量最显著的视叶组织雄性的表达量与雌性之间也有显著性差异,并且雄性乌贼与雌性乌贼在视叶组织的相对表达量相差4 倍,可能是因为不同性别的组织差异性导致的,推测该基因在控制雌雄个体生理活动时可能存在性别差异,还需进一步实验验证。有研究学者用RT-PCR 的方法对昆虫中的甲壳类心激肽CCAP 进行了研究,结果显示其在不同发育阶段均有表达,表达最多的是在幼虫到蛹过渡的阶段[33],表达水平波动在几个发育阶段的过程中,直到发育后期一些细胞依然没有表达[33-34],细胞内刺激识别的神经元可以引起心脏运动加速[35]。因此,sCAP 在不同发育时期的虎斑乌贼体内的表达量也应作为后续的一个研究方向,鉴定在不同发育时期时sCAP 在虎斑乌贼视叶等组织中的表达变化,可以进一步的研究该基因的相关功能,以及为后续的组织定位,免疫组织化学实验奠定依据。

