FBXO7载体构建及其对结直肠癌细胞生物学行为影响的初步探讨
唐月阳 易红 李星枝 龙汉安 王舰梅
1四川大学华西口腔医院病理科(成都610041);西南医科大学附属医院2细胞室,3病理科(四川泸州646000)
结直肠癌是目前全球最常见恶性肿瘤之一,其发病率居第2 位,呈现逐年上升的趋势[1]。近年来研究发现,结直肠癌发病原因与不良生活方式、饮食习惯、肠道菌群紊乱、大肠腺瘤及遗传因素等各方面关系密切[2]。其中约85%的结直肠癌是由结直肠癌息肉中的腺瘤逐步演变而来[3]。手术切除仍是目前治疗结直肠癌的主要方式,术后辅以放化疗,使结直肠癌治疗取得较明显的进步,但患者长期生存情况仍然较差[4]。因此,探讨结直肠癌的发生和发展机制,筛选早期生物标志物,寻找新的治疗靶点,对临床诊断及治疗结直肠癌都显得格外重要。
F-box 蛋白7(F-box protein 7,FBXO7)是新发现的F-box 蛋白家族成员之一,F-box 是由40 个氨基酸残基组成的一个特征性的酸性结构域[5-6]。F-box 家族参与组成SKP1-CUL1-F-box(SCF)复合物,是泛素化系统的重要组成部分[7]。目前国内外学者对于FBXO7 的研究不多,并且主要都集中在帕金森病方面,在肿瘤领域中的研究较少。研究发现,FBXO7 在肺鳞状细胞癌和结直肠腺癌组织中过表达,提示FBXO7 很可能在肺癌和结直肠癌的发生发展过程中扮演重要角色[8]。同时FBXO7 也参与了细胞周期控制,调控相关生物因子并被认为是一种原癌基因[9]。本实验检测FBXO7 在结直肠癌细胞中的表达情况,并成功构建GV230-FBXO7 表达载体,检测其过表达对结直肠癌细胞生物学行为影响,初步探讨FBXO7 调控结直肠癌细胞增殖、周期及迁移的分子机制。
1 材料与方法
1.1 材料人结直肠癌细胞株均为病理科实验室保存提供;引物均由上海生工生物工程公司合成;大肠杆菌感受态细胞、GV230 质粒均购自上海吉凯基因化学技术有限公司;DNA 电泳凝胶回收试剂盒、质粒小提中量取试剂盒、琼脂糖粉均购于天根生化公司;RNAiso Plus、逆转录试剂Kit、SYBR®Premix Ex TaqTMII 和DNA Marker、T4 连接酶、限制性内切酶XhoI 和KpnI 均购自日本Takara 公司;转染试剂Lipofectamine®2000 购自美国Invitrogen 公司;细胞周期检测试剂盒购自美国BD Biosciences公司;Enhanced Cell Counting Kit-8(增强型CCK-8试剂盒)购自碧云天生物技术公司。
1.2 方法
1.2.1 人结直肠癌细胞总RNA 提取和逆转录取出培养结直肠癌细胞的培养瓶,倒掉培养基,用预冷的PBS 冲洗2 ~3 遍,缓慢加入1 mL RNAiso Plus 后冰上静置5 ~10 min。具体按照说明书提取总RNA,利用紫外分光光度计测定RNA 纯度和浓度,OD260/OD280比值在1.7 ~2.2 为佳,放-80 ℃冰箱保存备用。按照Takara 公司的逆转录试剂盒说明将RNA 逆转录成cDNA,放-20 ℃冰箱保存备用。
1.2.2 荧光定量PCR 检测FBXO7 的mRNA 的表达提取结直肠癌细胞总RNA 并逆转录成cDNA。通过SYBR®Premix Ex TaqTMII 方法进行荧光定量PCR 检测,从而在转录水平检测FBXO7 的表达。用于荧光定量PCR 的FBXO7 引物如下:上游引物,5′-TGCTCTGTAGTGAATCGGTGGA-3′;下游引物,5′-CTTCGGTGCCCTGAGGTATG-3′;以GADPH做内参,引物如下:上游引物,5′-TGACTTCAACAGCGACACCCA-3′ ;下游引物5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.2.3 引物设计合成与目的基因的扩增根据GV230 酶切位点,设计FBXO7 的扩增引物:分别选取FBXO7 基因编码区双侧序列,分别加入XhoI 和KpnI 内切酶酶切位点和保护碱基,上游引物5′-TACCGGACTCAGATCTCGAGCGCCACCATGAGGCTGCGGGTGCGGCTTC-3′;下游引物5′-GATCCCGGGCCCGCGGTACCGTCATGAATGACAG CCGGCCATCAG-3′。取上述cDNA 为模板,加入FBXO7 前后引物根据说明书进行PCR 扩增。扩增条件:98 ℃预变性5 min →98 ℃变性10 s →55 ℃退火10 s →72 ℃延伸90 s →(共30 个循环)→再延伸8 min,产物放-20 ℃冰箱保存,将PCR 扩增产物进行琼脂糖凝胶电泳鉴定。
1.2.4 FBXO7 载体构建取PCR 扩增的FBXO7序列用XhoⅠ和KpnⅠ双酶切,同时根据无内毒素质粒小提中量试剂盒说明小提质粒GV230 质粒,并经XhoⅠ和KpnⅠ双酶切,回收并纯化酶切产物。于16 ℃循环水浴锅中将上述制备纯化的FBXO7 序列与线性化双粘性末端的GV230 载体片段按比例用T4 DNA 连接酶置连接反应过夜,60 ℃灭活连接产物10min 后转化至大肠杆菌感受态细胞,经卡那霉素抗性筛选,挑取阳性单克隆菌落,接入LB 培养基中,根据质粒提取试剂盒,从菌液中提取重组质粒GV230 - FBXO7 并进行双酶切鉴定和质粒测序。
1.2.5 Western blot 法取转染后72 h生长良好的结直肠癌细胞,提取总蛋白,用BCA 试剂盒测定蛋白浓度,蛋白液中加入5×loading buffer,水浴锅中煮沸至100 ℃,使蛋白完全变性,置于-20 ℃保存。每孔蛋白上样量7 ~15 μL,10%SDS-PAGE 电泳分离在电压80 ~110 V下进行,再以200 mA,90 min的恒流条件转至甲醇预处理的PVDF 膜上,PBST配制的5%脱脂奶粉中封闭1 h 后,PBST 洗涤3 次,每次10 min,将PVDF 膜放入稀释后的FBXO7 和GADPH抗体中,4 ℃摇床孵育过夜。次日,PBST 洗涤3 次,每次10 min 后,加入提前稀释好的二抗中,继续室温摇床振荡孵育1 h。最后PBST 洗涤3 次,每次6 min,再加入现配发光液,置于凝胶成像仪上发光。
1.2.6 细胞增殖实验将转染后48 h 的结直肠癌细胞,用胰酶消化离心并计数,以每孔100 μL 细胞悬液(2 000 个/孔)接种到96 孔板中。96 孔板边缘每孔加入100 μL PBS,以防止蒸发影响实验结果。分别培养6(当做0 h)、24、48、72、96 h 后,每孔加入10 μL CCK-8 试剂,置于37 ℃孵箱中孵育1 h,酶标仪测定波长450 nm 处每孔的OD值。
1.2.7 流式细胞技术检测细胞周期转染后48 h的结直肠癌细胞用不含EDTA 的胰酶消化收集,1 000 r/min 离心3 min 后弃去上清,加入预冷的PBS 洗涤细胞沉淀,再次1 000 r/min 离心3 min 后弃去上清,加入预冷的70%乙醇,吹散细胞,4 ℃冰箱固定24 h。染色前用预冷的PBS 洗涤,加入500 μL Propidium Iodide 溶液,37 ℃避光孵育30 min。上机检测,分析结果。
1.2.8 细胞划痕实验在6 孔板的背面,用Marker笔每隔0.5 ~1 cm 均匀地划横线,在每孔中加入5× 105个转染24 h 后的细胞,培养过夜后使其能铺满。第2 天垂直于6 孔板背后的横线,用10 μL 的枪头划痕。PBS 清洗细胞3 遍,洗去划落的细胞后,加入无血清培养基。放入37 ℃、5% CO2培养箱中继续培养,于0、24、48 h 取样拍照。
1.3 统计学方法运用SPSS 17.0软件进行统计分析,计数资料用均数±标准差表示,t检验用于比较两组间均数。以P<0.05为差异有统计学意义。
2 结果
2.1 FBXO7 在结直肠癌细胞中的表达情况通过实时荧光定量PCR 和蛋白免疫印迹检测结直肠癌细胞中FBXO7 的mRNA 和蛋白表达水平,结果发现HCT116 和SW620 细胞株中FBXO7 的mRNA(P <0.05)和蛋白表达量均明显低于其他细胞株(图1)。因此选用这两株细胞进行后续相关实验。

图1 荧光定量PCR 和Western blot 法检测结直肠癌细胞株中FBXO7 表达情况Fig.1 Detection of FBXO7 expression in colorectal cancer cell lines by real-time quantitative PCR and Western blot
2.2 目的基因片段获取提取结直肠癌细胞中RNA 逆转录合成的cDNA,以此为模板进行PCR 扩增。对该扩增产物进行琼脂糖电泳显示,在DNA Marker 的1 000 ~2 500 bp 范围内有一条明显的条带(图2)。本实验预扩增的FBXO7 全长大小为1 615 bp,该条带大小与预期的条带大小相符合,证明FBXO7 片段扩增成功。

图2 PCR 扩增FBXO7 片段琼脂糖电泳结果图Fig.2 PCR amplification of FBXO7 fragment agarose electrophoresis results
2.3 重组质粒的双酶切鉴定结果对FBXO7 片段和质粒GV230 分别进行限制性内切酶XhoI 和KpnI 双酶切后连接。将该产物进行细菌转化,涂板、挑取单个菌落。摇菌并进行质粒小提。经双酶切后电泳酶切产物,4.7 kb 和1 000 ~2 500 bp 左右分别出现条带(图3)。为进一步鉴定质粒,送检该质粒测序,测序结果经BLAST比对,序列完全正确,从而证明重组质粒GV230-FBXO7构建成功。

图3 GV230-FBXO7 双酶切电泳结果图Fig.3 Results of GV230-FBXO7 double digestion electrophoresis
2.4 转染GV230-FBXO7 后检测FBXO7 的表达情况将GV230 和GV230 - FBXO7 质粒分别转染结直肠癌细胞HCT116 和SW620,检测结直肠癌细胞中FBXO7 的mRNA 和蛋白表达水平。实时荧光定量PCR 和蛋白免疫印迹检测结果发现,在两株细 胞 中,GV230-FBXO7 组FBXO7 的mRNA(P <0.05)和蛋白表达量均明显高于GV230 组(图4)。该结果证明,GV230-FBXO7 在HCT116 和SW620中均成功过表达。

图4 荧光定量PCR 和Western blot 法检测GV230-FBXO7转染效率Fig.4 Detection of GV230-FBXO7 transfection efficiency by real-time PCR and Western blot
2.5 FBXO7 过表达对结直肠癌细胞体外增殖的影响CCK-8 检测结果发现,与瞬时转染的GV230组相比,GV230 - FBXO7组的HCT116 和SW620 细胞在不同时间段OD值均增加(图5),并且差异有统计学意义(P <0.05)。该结果表明,FBXO7 可以增强结直肠癌细胞的体外增殖能力。
2.6 FBXO7 过表达对结直肠癌细胞周期的影响利用流式细胞仪检测过表达FBXO7 的HCT116 和SW620 细胞周期的变化,结果发现,与GV230 组相比,GV230 - FBXO7 组细胞的G1 期比例减少,而S 期比例增加(图6),并且差异有统计学意义(P <0.05)。由此可见,FBXO7 可以促进结直肠癌细胞由G1 期进入到S 期,促进细胞发生G1/S 期转变。

图5 GV230-FBXO7 过表达对结直肠癌细胞HCT116 和SW620 增殖影响Fig.5 Effect of GV230-FBXO7 overexpression on proliferation of rectal cancer cells HCT116 and SW620
2.7 FBXO7 过表达对结直肠癌细胞体外迁移能力的影响通过划痕实验检测过表达FBXO7 后HCT116 和SW620 迁移能力变化,结果显示,与GV230 组 相 比,GV230-FBXO7 组 的HCT116 和SW620 细胞迁移能力增强,表明过表达FBXO7 后增强了结直肠癌细胞的迁移能力(图7)。
3 讨论
F-box 蛋白家族是泛素化系统的重要组成部分,而F-box 结构域是该家族的标志性结构域,F-box 蛋白通过参与泛素-蛋白酶体途径进而调控细胞周期、转录、信号通路传导等过程[10-11]。FBOX7 属于新发现的F-box 蛋白家族的FBXO 类别[12]。研究显示FBXO7 参与多种疾病的发生发展。FBXO7 突变可以使线粒体功能障碍,这与早发帕金森综合征密切相关[13],FBXO7 的丢失会通过RPL23-MDM2-TP53 途径能导致帕金森氏样多巴胺变性[14]。FBXO7 和α-突触素G51D 同时突变可以导致特殊的临床症状,被称为帕金森-锥体束征[15]。此外,通过依赖p53 的方式,FBXO7 可以负向调节原代造血干细胞(primary hematopietic stem cells,HSPC)的增殖和分化,而当不存在p53 的情况下,FBXO7 表达可促进T 细胞淋巴瘤形成[9,16-17]。此外还有研究发现FBXO7在上皮肿瘤中高表达,在正常组织中不表达或低表达,因此FBXO7 可能具有促进肿瘤发生、发展的作用[18]。
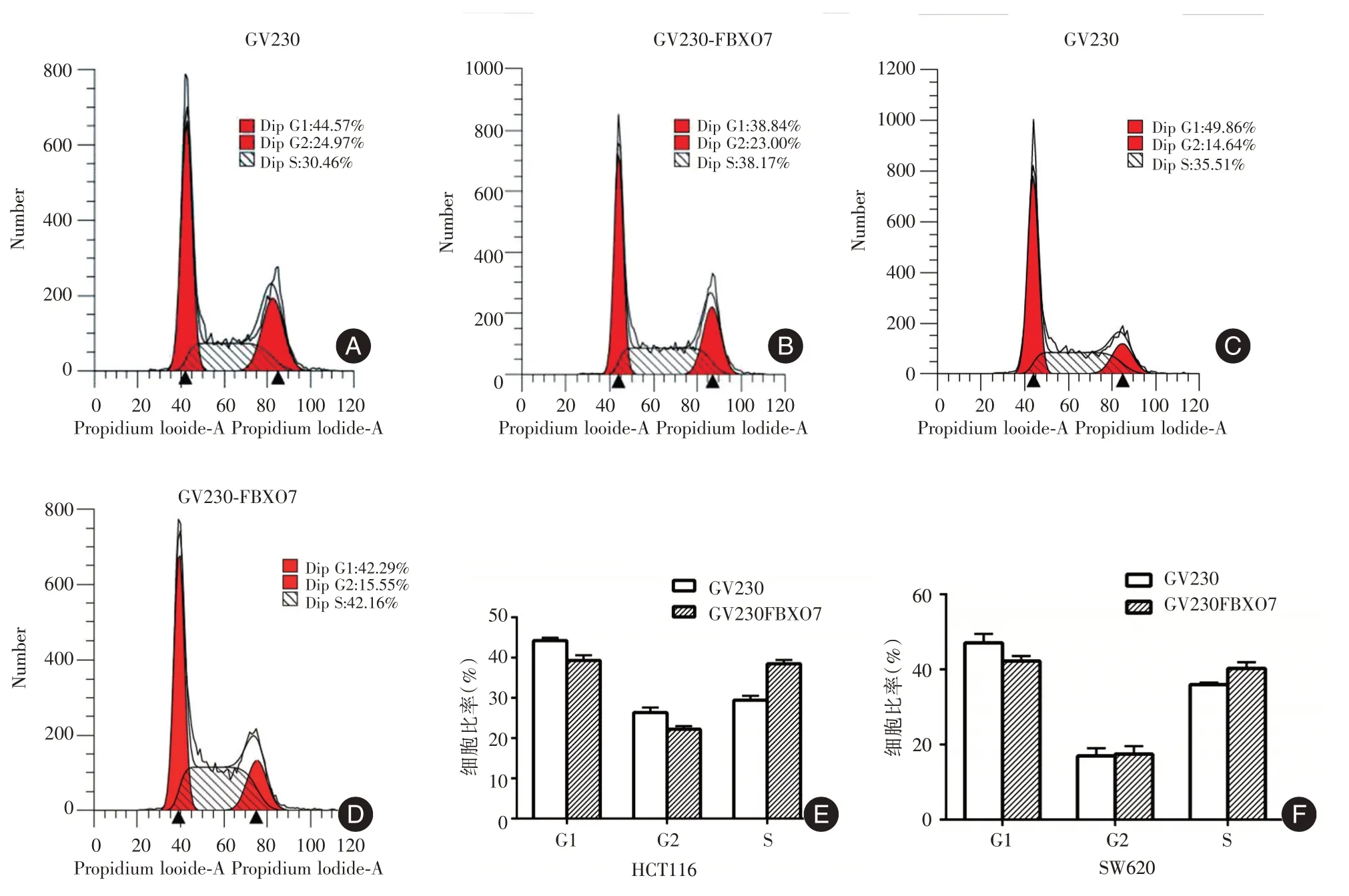
图6 GV230-FBXO7 对细胞周期的影响Fig.6 Effect of GV230-FBXO7 on cell cycle
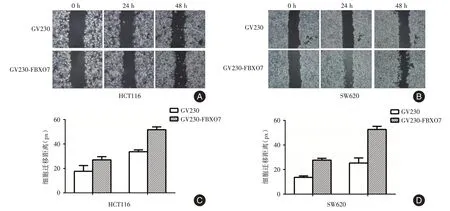
图7 GV230-FBXO7 对细胞迁移能力的影响Fig.7 Effect of GV230-FBXO7 on cell migration ability
肿瘤的发生发展是一个极其复杂的过程,包括体内微环境和细胞的多种遗传改变[19]。而细胞增殖是所有生物体最重要生理特征之一,也是生物体生长、发育、繁殖和遗传的基础。在一些致癌因素诱导下,细胞增殖失去调控,可导致细胞无限增殖,从而形成肿瘤。因此调控癌细胞的增殖是影响癌症发生和发展的关键。目前,还未有关于FBXO7 参与结直肠癌细胞增殖的相关文献报道。本实验中GV230-FBXO7 质粒被成功构建,并验证了在结直肠癌细胞中的转染效率。CCK-8 检测结果发现过表达FBXO7 后可促进结直肠癌细胞体外的增殖。正常细胞周期以有序的方式进行,当调节细胞周期的基因发生突变、缺失和扩增时,细胞周期失去控制,细胞将无限增殖形成肿瘤。为进一步探究FBXO7 在细胞周期中的作用,本实验通过过表达FBXO7 检测其对结直肠癌周期的影响,发现G1 期细胞比例减少,而S 期细胞比例增加,表明FBXO7 可以促进结直肠癌细胞由G1 期进入到S期,促进细胞发生G1/S 期转变,从而影响细胞的增殖能力。文献报道FBXO7 可以特异性调节Cyclin D1/CDK6 复合物,其过表达能增加Cyclin D1/CDK6复合物和E2F 活性[18]。而细胞周期蛋白依赖性激酶CDK4 或CDK6 都可以与Cyclin D1 相互作用形成复合物,促进G1 期至S 期的进展[20],本实验结果与其较一致。
侵袭和转移是恶性肿瘤的最主要的特征。肿瘤细胞转移取决于其逃离原发肿瘤的能力,通过渗入血管内循环,渗入远处组织并定植,同时逃避免疫监视并促进局部组织环境变化[21]。肿瘤细胞以不同的模式渗入邻近的组织基质,如作为单个细胞传播,称为“个体细胞迁移”或成片细胞传播,称为“集体迁移”[22]。而恶性肿瘤侵袭转移的最重要标志是突破基膜。MMP-2 和MMP-9属于MMP 家族,是一种可降解细胞外基质的蛋白水解酶,其异常表达在肿瘤侵袭和转移中发挥重要作用[23]。有文献报道,F-box 家族中的FBXO22可以增强结直肠癌细胞的侵袭和迁移能力,其作用是通过MMP-2 和MMP-9 实现[24-25]。本实验在结直肠癌细胞中过表达FBXO7。经细胞划痕实验初步发现,过表达FBXO7 后明显增强了结直肠癌细胞体外迁移能力,具体分子机制有待进一步探讨。
综上所述,FBXO7 不仅可以促进结直肠癌增殖,还能影响结直肠癌细胞周期以及增强结直肠癌细胞体外迁移能力。FBXO7 可能在结直肠癌发生发展的不同阶段均发挥着作用,促进结直肠癌的演进。本实验为深入研究结直肠癌的发生和发展提供了一定的理论依据,进一步明确了FBXO7在结直肠癌中的相关作用,为结直肠癌的治疗和预后寻找到新的靶点。然而本实验还存在一定的局限性,未探究过表达FBXO7 后调控结直肠癌增殖、周期及迁移的具体途径及通路,并且未进行动物模型实验验证。针对本实验的不足,我们将继续通过过表达FBXO7 后检测影响结直肠癌细胞增殖、周期及迁移的相关通路基因及蛋白的表达情况,并通过裸鼠皮下成瘤及肝肺转移模型来进一步验证。
——一道江苏高考题的奥秘解读和拓展

