LMP-1与CXCR4在鼻咽癌组织中的表达及临床意义
陈俊妮 袁 波 陈集敏 陈春吉 杨时平 王 奋 王一鸣
远处转移是鼻咽癌患者治疗失败的主要原因[1-2],研究鼻咽癌转移的分子机制,寻找治疗靶点,对提高鼻咽癌患者生存率,具有重要的临床意义。大量文献报道趋化因子受体4(chemokine receptor 4,CXCR4)具有促进肿瘤生长和转移的作用。目前已在前列腺癌、肺癌、乳腺癌、胃癌、肾癌、卵巢癌、食管癌、头颈部鳞状细胞癌等多种肿瘤细胞中检测到CXCR4高表达[3-10]。Tao等[11]和Segawa等[12]在鼻咽癌肿瘤组织中检测到CXCR4蛋白高表达。鼻咽癌作为南方高发恶性肿瘤,与EB病毒感染密切相关,潜伏膜蛋白1(latent membraneprotein-1,LMP-1)是EB病毒编码产物中被证实具有癌基因功能的蛋白质之一,在鼻咽癌侵袭和转移中起着重要的作用[13]。有研究发现LMP-1可激活NF-KB信号通路[14],而另有研究报道NF-KB信号通路可上调CXCR4表达,从而促进肿瘤细胞的迁移和转移[15]。目前关于LMP-1与CXCR4在鼻咽癌组织中的表达是否存在相关性报道较少。该研究采用免疫组化检测LMP-1蛋白和CXCR4蛋白在鼻咽癌组织中的表达情况,并分析两者是否存在相关性及其临床意义。现将结果报告如下。
1 材料与方法
1.1 一般资料
收集2013年12月至2015年5月在海南省人民医院放疗科诊治且经鼻咽活检病理诊断为鼻咽癌的初诊患者66例,中位年龄49岁(30~73岁),男性48例,女性18例。所有患者在治疗前均接受全身检查以排出骨及脏器等全身转移,并经AJCC8th重新分期:T1期1例,T2期21例,T3期27例,T4期17例;N0期1例,N1期15例,N2期28例,N3期22例。Ⅱ期5例,Ⅲ期27例,Ⅳa期34例。病理类型:未分化型非角化性癌56例,分化型非角化性癌10例。所有入组对象均告知试验的目的和可能存在的风险,征得同意并签署知情同意书。
1.2 仪器和试剂
鼠抗人LMP-1单克隆抗体购自Gene company公司,鼠抗人CXCR4单克隆抗体购自R&D Systems公司,山羊抗小鼠二抗试剂盒、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、柠檬酸盐缓冲液(citrate buffer,CB)、磷酸盐缓冲液(phosphate buffered solution,PBS)、多聚赖氨酸硅化载玻片购自北京中杉金桥公司,二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自福建迈新公司。SP试剂盒均购自北京中杉生物技术有限公司。切片机、双目显微镜、恒温孵育箱、微波炉等常规实验设备,无水酒精、二甲苯伊红、苏木精等普通试剂由我院病理科提供。
1.3 标本处理和检测
石蜡标本以4 μm连续切片。石蜡切片常规脱蜡,梯度水化;加一滴3 %过氧化氢,室温下孵育15 min,滴加正常山羊血清封闭20 min,分别滴加1∶100稀释的LMP1和1∶600稀释的CXCR4单克隆抗体,4 ℃过夜;然后滴加1∶100生物素标记的二抗,室温孵育15 min,滴加1∶100 辣根过氧化物酶标记的卵白素,室温孵育15 min,滴加DAB显色,苏木精复染,脱水、透明、中性树胶封片,镜检。用磷酸盐缓冲液(phosphatic buffered saline,PBS)代替一抗作阴性对照。
1.4 结果判定
肿瘤细胞染色呈浅黄、不均匀着色,判为弱染色;染色呈黄褐色,着色比较均匀,判为中等染色;染色呈棕褐色,着色均匀者判为强染色。采用半定量积分法判断结果,随机观察10个高倍视野(×400):①细胞染色强度:不染色0分、弱染色(浅黄色)1分、中等染色(黄褐色)2分,强染色(棕褐色)3分;②阳性细胞占视野细胞总数:0~5%得0分,6%~25%得1分,26%~50%得2分,51%~75%得3分,76%~100%得4分。两项得分相加,≥4分为阳性。
1.5 随访方法
随访形式为:返院复查、电话随访。放疗结束后前2年,每3个月复查1次,2年以后每6个月复查1次。5年以后每年复查1次。随访内容包括完善的体检、胸部CT、腹部彩超、纤维鼻咽镜、鼻咽及颈部MRI、全身骨显像等。
1.6 统计方法
应用SPSS 20.0软件进行数据分析,采用χ2检验分析转移组和非转移组间两蛋白表达差异。采用Spearman 等级相关分析两蛋白表达相关性。采用Kaplan-Meier法计算生存率并应用Logrank法单因素预后分析,P<0.05为差异有统计学意义。
2 结果
2.1 LMP-1和CXCR4在鼻咽癌组织中的表达
66例鼻咽癌组织中,LMP-1阳性50例,阳性率为75.76%。CXCR4阳性65例,阳性率为98.48%。LMP1阳性细胞着色定位于细胞膜、细胞质,根据染色强弱表现,不染色3例,弱染色有40例,中等染色23例。CXCR4阳性细胞着色定位于胞膜、胞质、细胞核。根据染色强弱表现,弱染色有16例,强染色50例。
2.2 LMP-1和CXCR4与鼻咽癌患者临床病理特征的关系
LMP1蛋白在N0~1、N2和N3分期患者中阳性表达率分别为56.25%、75.00%和90.91%(P<0.05)。LMP-1蛋白在GTVnd<49.15 cm3和GTVnd≥49.15 cm3两组中阳性表达率分别为:69.81% vs.100%,(P<0.05)。由此说明:N分期越高或肿瘤体积越大,LMP-1阳性表达率越高。因CXCR4阳性率高达98.48%,因此根据CXCR4染色强弱进行分层研究,结果显示:CXCR4蛋白染色强弱在各组间无显著性差异(P>0.05),见表1。
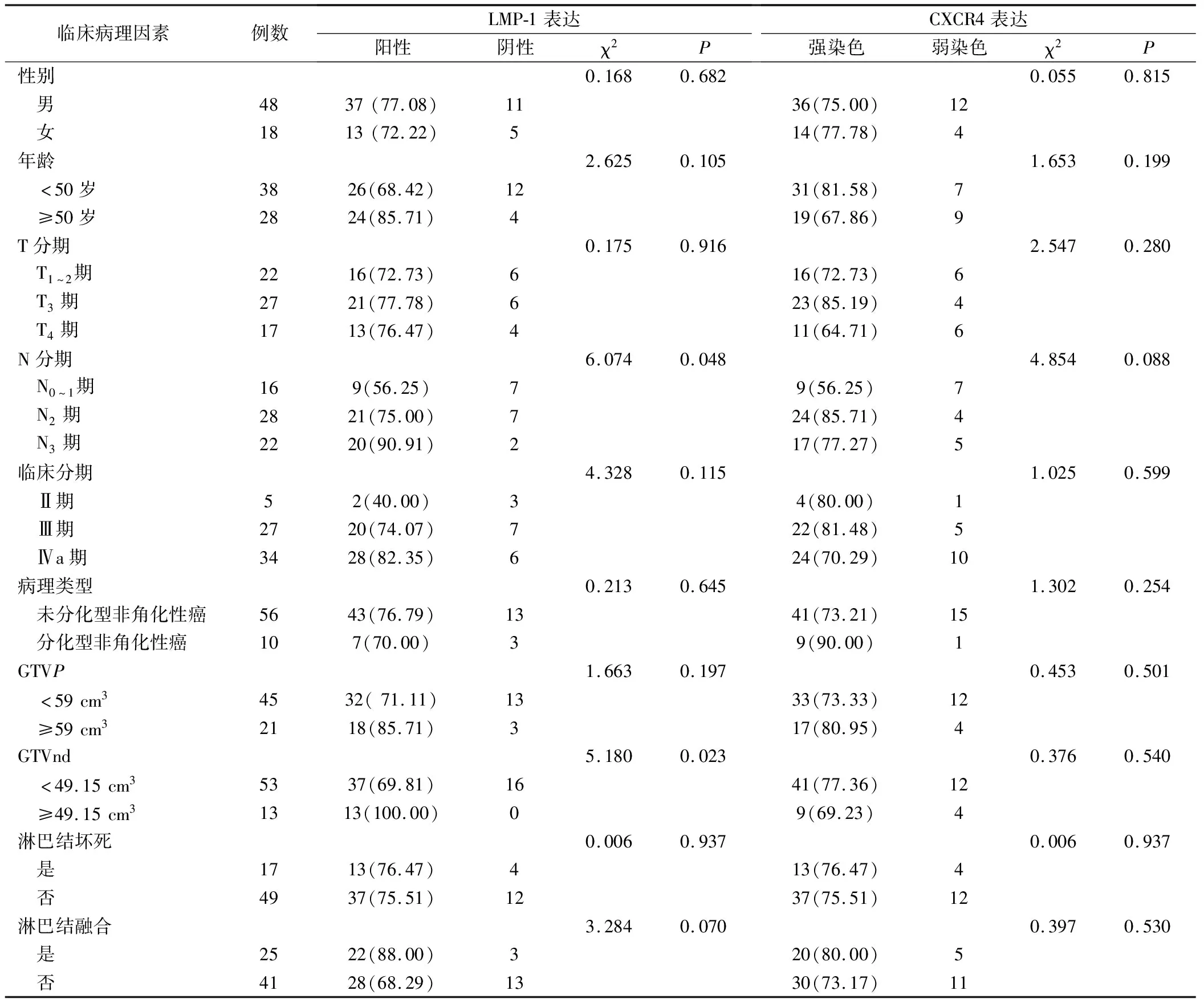
表1 LMP-1蛋白表达和CXCR4蛋白染色强弱与临床病理特征的关系(例,%)
2.3 LMP-1与CXCR4蛋白表达的相关性分析
采用Spearman等级相关分析:LMP-1蛋白表达与CXCR4染色强弱是否存在相关性,结果显示:相关系数为0.010,P=0.936,因此两者表达不存在相关性。
2.4 LMP-1及CXCR4表达与预后的关系
LMP-1蛋白在远处转移组和无转移组阳性率分别为100.00%和68.63%。CXCR4染色强弱在组间的差异无统计学意义。由此说明:LMP-1阳性组鼻咽癌患者更容易发生远处转移,见表2。

表2 LMP1蛋白表达及CXCR4染色强弱与复发和远处转移的关系(例,%)
2.5 生存分析
根据LMP-1蛋白表达将66例患者分成阴性组和阳性组,3年总生存率(OS):93.8% vs.70%(χ2=3.775,P=0.052);3年无进展生存率(PFS):93.8% vs.63.4%,(χ2=5.267,P=0.022);3年无远处转移生存率(DMFS):100% vs.71%(χ2=5.788,P=0.016);3年无复发生存率(RFS):93.8% vs.88.9%(χ2=0.271,P=0.603),见图1。CXCR4染色强弱两组的3年OS、PFS、DMFS和RFS差异均无统计学意义(P>0.05)。
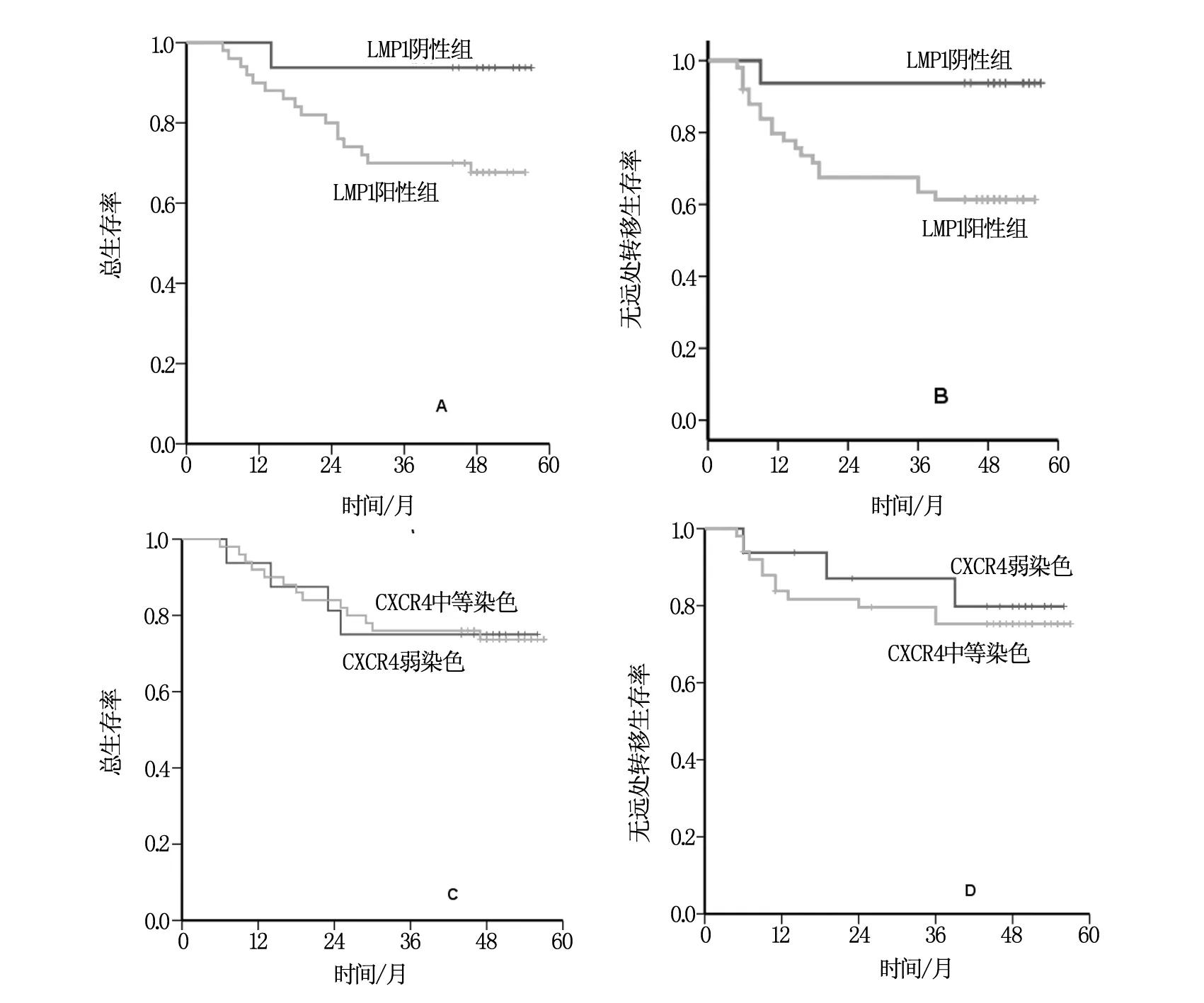
图1 LMP-1阴性组和阳性组以及CXCR4弱染色组和强染色组的鼻咽癌患者生存情况比较
3 讨论
鼻咽癌是南方地区高发恶性肿瘤,与EB病毒感染密切相关,而LMP-1是EB病毒潜伏感染时表达的一种重要转化膜蛋白,其与细胞的转化、增殖、去分化以及肿瘤的生长转移有关[16]。既往国内研究报道采用免疫组化方法检测LMP-1在鼻咽癌组织中的阳性表达率为43%~72.5%[17-18],采用PCR检测LMP-1阳性表达率更高,可达88.37%[19]。目前该研究采用免疫组化检测LMP-1阳性率达75.76%,与文献报道结果一致。LMP-1蛋白表达与病理类型是否有关存在争议[19-20]。该研究结果显示:鼻咽未分化型非角化性癌占84.85%,分化型非角化性癌占15.15%。虽然LMP-1在未分化组表达略高于分化组(76.79% vs.70%),但差异未达到统计学意义。LMP-1蛋白表达与性别、年龄、临床分期、T分期、鼻咽肿瘤体积、淋巴结坏死和融合无关,但与N分期、颈部转移淋巴结体积有关。LMP-1在N0~1期、N2和N3期患者中阳性表达率为56.25%、75%和90.91%,呈递增趋势,并且颈部转移淋巴结体积越大,LMP-1表达率越高。分析LMP-1与远处转移、复发关系发现:LMP-1与远处转移有关,与鼻咽癌局部复发无关,远处转移组LMP-1阳性率高。LMP-1阴性组总生存率、无进展生存率和无远处转移生存率显著高于阳性组,但无复发生存率两组无显著性差异。本研究结论与Zhao等[21]的研究结果一致,林锦等[19]研究发现淋巴结阳性组(N1~3)患者LMP-1 阳性表达率明显高于淋巴结阴性组(N0)。首诊无远处转移(M0)患者122例中有107例LMP-1呈阳性表达,阳性表达率为87.70%,而首诊有远处转移(M1)的7例患者LMP-1均呈阳性表达,阳性表达率为100%,高于M0组,但该研究分析远处转移组与无远处转移组LMP-1阳性表达率差异无统计学意义,考虑与该研究随访时间过短有关。
目前关于LMP-1蛋白表达与肿瘤体积的关系无人报道,该研究中淋巴结体积大于49.15 cm3组的LMP-1阳性表达率高,尽管LMP-1在鼻咽部肿瘤不同体积组(GTVp≥59 cm3和GTVP<59 cm3)表达差异无统计学意义,但在大体积组仍表现出增高趋势(85.71% vs.71.11%)。由此提示:LMP-1具有促进鼻咽癌肿瘤细胞生长和转移的作用,可作为预测鼻咽癌预后的生物学指标。那么LMP-1是如何促进肿瘤生长和转移呢?其内在机制目前尚不十分明确。趋化因子受体4(CXCR4)在肿瘤细胞中高表达,其配体即趋化因子基质细胞衍生因子1(Stromal cell derived factor 1,SDF-1)是一种趋化蛋白,在骨、肺、肝、脑等肿瘤易转移器官中高表达。CXCR4 与SDF-1 具有高度亲和力,两者特异性结合构成SDF-1/CXCR4 轴参与肿瘤细胞增殖、浸润和定向迁移等[22-23]。现有研究表明,LMP-1可以通过激活NF-KB信号通路,从而促进肿瘤转移[14],而另有研究报道NF-KB信号通路可上调CXCR4表达增加,促进肿瘤细胞的迁移和转移[15]。然而LMP-1、CXCR4两者是否具有相关性呢?
Li等[24]采用免疫组化检测56例鼻咽癌患者鼻咽肿瘤CXCR4阳性表达率为30%,Segawa等[12]的报道中CXCR4阳性率为53.9%。Hu等[25]采用PCR、免疫组化法和流式细胞仪等方法检测CXCR4在鼻咽癌中的阳性表达率为77.5%。Wang等[26]采用免疫组化检测194例鼻咽癌肿瘤组织CXCR4表达,结果发现:194例中仅1例不染色,强阳性表达率为45.4%(88例),弱阳性表达率为54.12%(105例),不表达1例。在鼻咽癌的不同研究中CXCR4阳性表达率不同,可能与检测方法以及阳性评判标准存在差异有关。Wang等[26]分析CXCR4表达与预后的关系发现:CXCR4强表达中有38.6%的远处转移率,弱或阴性表达者仅19.8%发生远处转移。CXCR4强表达组的生存率低于弱表达组。该研究采用免疫组化检测66例鼻咽肿瘤组织CXCR4的表达,结果发现仅1例未达到阳性诊断标准,弱染色有16例,强染色50例。根据染色强弱进行分组分析,结果未发现CXCR4染色强弱与临床病理、复发和转移等有关,LMP-1表达与CXCR4染色强弱亦不存在相关性。
综上所述,LMP-1阳性者,更容易发生转移,可作为肿瘤治疗的分子靶点和预测鼻咽癌预后的生物学指标。CXCR4在鼻咽癌组织中的表达及其意义需要进一步探索。

