前列腺癌根治术患者治疗前后血小板/淋巴细胞比值变化及其与预后相关性分析
胡小剑 郑 亮 张志刚 杜永辉 牛 彬 惠鹏宇 于 靳 贾 磊 倪 锋
前列腺癌是1种严重威胁男性生命健康的恶性肿瘤,死亡率位居第三,近年来前列腺癌在我国发病率呈逐步上升趋势[1]。血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR),作为1种常见的反应机体炎症和免疫状态的指标,已被证实是影响卵巢癌患者术后预后的独立危险因素[2]。同时也有研究显示PLR对结直肠癌、胰腺癌等的预后具有一定预测价值[3-4]。但是关于前列腺癌根治术患者PLR与预后关系的研究报导相对较少。本研究以我院60例行前列腺癌根治术患者为研究对象,评价PLR与前列腺癌预后的关系,现报告如下。
1 资料与方法
1.1 一般资料
选取2013年6月至2016年2月我院泌尿外科收治的60例前列腺癌病例作为研究对象。所有患者经前列腺穿刺,病理学确诊为前列腺癌。纳入标准:①均经前列腺穿刺,病理学确诊为原发性前列腺癌。②按国际抗癌联盟(UICC)的TNM分期诊断分期为T2~4N0M0。排除标准:①接受过放、化疗或内分泌治疗者;②白血病患者;③确诊前半年内有重大感染、外伤或手术者。④合并其他恶性肿瘤或系统性炎性疾病者。所有病例年龄54~82(70.54±6.93)岁,其中39例行胸腔镜前列腺癌根治术,21例行耻骨后根治术。临床分期Ⅱ期36例,Ⅲ期19例,Ⅳ期5例。
1.2 观察指标
所有患者术前1周采取外周血检查血常规细胞计数。术后前2年,每3个月进行一次随访,2年后每6个月随访一次,所有患者术后随访3年,随访内容包括血常规、血生化、前列腺特异性抗原(prostate-specific antigen,PSA)以及直肠指诊。记录患者随访期内复发、转移和死亡情况,复发定义为连续2次PSA>0.2 μg/l,或直肠指诊有硬物,结合病理检测阳性诊断为前列腺癌复发。主要观察终点为无复发生存期(recurrence free survival,RFS),指术后第一天至患者出现复发、转移的时间和总生存期(overall survival,OS)。
1.3 方法
收集临床资料包括患者年龄、临床T分期、骨转移、Gleason评分、术前1周外周血常规细胞计数等。本研究中PLR定义为血小板计数与淋巴细胞计数的比值。采用ROC曲线确定术前PLR预测前列腺癌患者预后的最佳临界值,并依据此临界值将所有患者分为高PLR组(n=29)和低PLR(n=31)组。使用单因素COX回归分析收集的各临床指标与预后的相关性,并将单因素分析有统计学意义的指标纳入多因素模型,评估影响前列腺癌根治术后患者预后生存的可能危险因素。
1.4 统计学处理
2 结果
2.1 手术前后PLR水平变化
所有患者术前PLR94.2~177.6(平均133.5±27.8),术后随访3个月时PLR90.6~158.4(平均119.2±19.4),差异有统计学意义(P<0.05)。
2.2 术前PLR预测前列腺癌根治术患者预后的ROC曲线
绘制术前PLR预测术后复发的ROC曲线,分析确定当PLR取130.2时,Youden指数最大,鉴别前列腺癌根治术后患者预后的灵敏度和特异度达到最佳,分别为73.1%、70.6%,ROC曲线下面积为0.740(95%CI:0.613~0.866),见图1。所有60例患者中,术前PLR≥130.2共29例,定义为高PLR组,PLR<130.2共31例,定义为低PLR组。
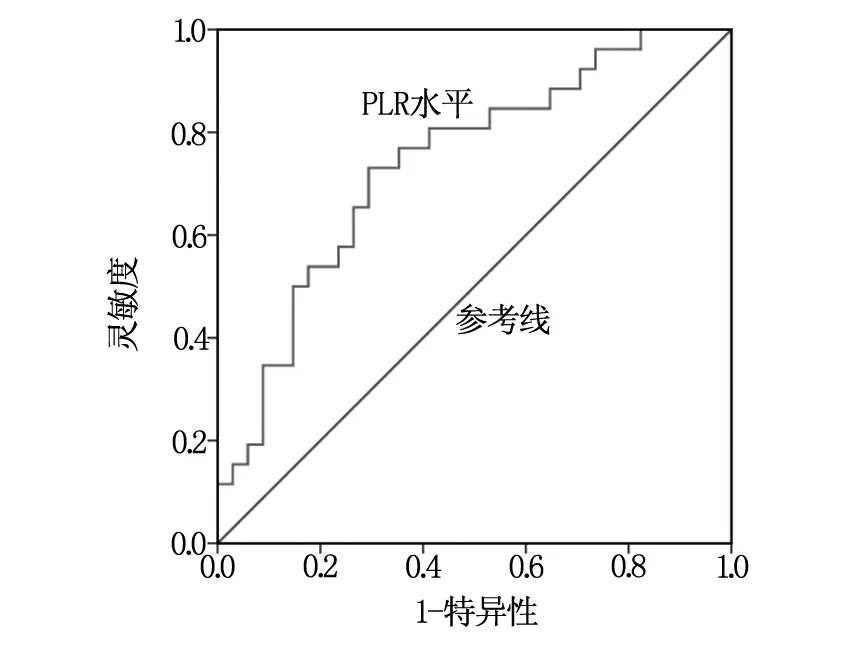
图1 PLR预测前列腺癌根治术患者预后的ROC曲线
2.3 高PLR组和低PLR组RFS和OS的比较
本研究观察期内,所有60例患者有31例(51.7%)出现复发,高PLR组复发率(65.5%,19/29)显著高于低PLR组(38.7%,12/31,χ2=4.312,P<0.05);观察期内共死亡29例(48.3%),高PLR组死亡率(62.1%,18/29)明显高于低PLR组(35.5%,11/31,χ2=4.241,P<0.05)。对不同PLR组患者生存资料使用单因素Kaplan-Meier生存分析,结果显示,高PLR组的患者术后3年无复发生存率(41.4% vs 71.0%)和3年总生存率(51.7% vs 77.4%)明显低于低PLR组,差异有统计学意义(P均<0.05),低PLR组预后优于高PLR组,其生存曲线见图2。
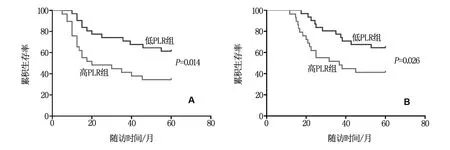
图2 前列腺癌根治术后高PLR组低PLR组RFS(A)和OS(B)的Kaplan-Meier生存分析
2.4 影响前列腺癌根治术后生存预后的单因素和多因素分析
以收集的各临床指标对患者进行分组,使用COX单因素分析提示:PLR≥130.2、临床T分期、骨转移等均是前列腺癌患者术后RFS和OS的不良预后因素(P均<0.05),见表1。进一步对PLR、临床T分期、骨转移进行COX多因素回归分析,结果表明:临床T3~4分期和PLR≥130.2是前列腺癌患者根治术后RFS和OS的独立危险因素(P均<0.05),见表2。
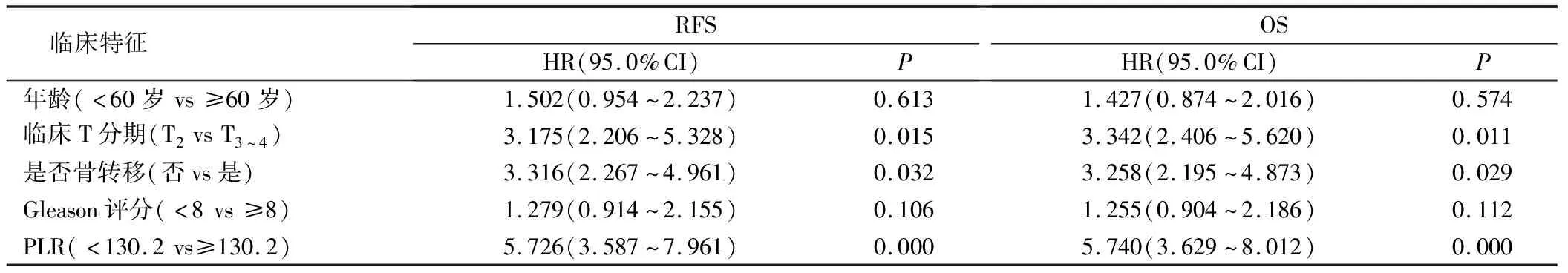
表1 影响前列腺癌根治术患者生存预后的COX单因素分析

表2 影响前列腺癌根治术患者生存预后的COX多因素分析
3 讨论
前列腺癌为发生于前列腺的上皮性恶性泌尿系统肿瘤,严重威胁中老年男性健康。目前前列腺癌的治疗方式主要包括根治性手术切除、放疗以及内分泌治疗等,PSA是目前用于诊断前列腺癌的主要生化指标,但目前临床上仍缺乏能有效预测其预后和进展情况的标志物,因此寻找更有效的预测前列腺癌预后的指标有助于帮助改善疾病预后[5]。炎症与肿瘤的关系一直是研究的热点,目前关于炎症指标对于评估肿瘤患者预后的价值获得了较多研究者的关注[6-8]。PLR是目前研究较多的炎症指标之一,其获取方便且无需侵入性操作,有望成为预测肿瘤患者预后的常用指标。尽管目前PLR升高与肿瘤患者不良预后的具体机制尚不明确,但有学者认为这可能与血小板依赖的促肿瘤反应和淋巴细胞介导的抗肿瘤免疫反应有关[9]。Feng等[10]研究显示术前PLR相比中性粒细胞-淋巴细胞比值(NLR)能更好预测食管鳞状细胞癌患者预后。张维维等[11]对164例卵巢癌患者的病例资料进行回顾性分析发现,术前PLR升高可作为卵巢癌预后的独立危险因素。越来越多研究提示PLR对肿瘤的预后显示出较好的预测价值,但也有研究[12]显示PLR不能作为胆道系统肿瘤预后的指标,尚需扩大样本进一步证实。对于PLR在前列腺癌中作用的研究,陈一鸣等[13]指出PLR是前列腺癌患者发生早期去势抵抗的独立危险因素,且对早期趋势抵抗具有较好的诊断价值。为了探究PLR对前列腺癌根治术后患者预后的影响,本研究通过ROC曲线分析,以yuden指数最大时,确定PLR临界值为130.2,通过Kaplan-Meier生存曲线分析显示,高PLR组的患者术后3年无复发生存率(41.4% vs 71.0%)和3年总生存率(51.7% vs 77.4%)明显低于低PLR组,差异有统计学意义(P<0.05),低PLR组预后优于高PLR组。
关于PLR最佳截值的确定,不同的研究中PLR的截值有所不同。Wang等[14]在一项研究中发现PLR为117.58作为前列腺癌内分泌治疗后预后预测的截点时,高于117.58的患者具有更短的无进展生存期和总生存期。闫传武[9]以130作为PLR预测前列腺癌根治术后预后预测的界值,发现PLR小于130的患者术后1、3、5年生存期显著高于术前PLR≥130患者。本研究通过ROC曲线分析确定PLR预测预后最佳截值取130.2,通过COX单因素及多因素分析发现术前PLR≥130.2是前列腺癌根治术患者预后不良的独立危险因素。不同研究确定的PLR截值不同,各个研究的结论也有所不同,这一差异可能与病例选择的不同以及病例随访因素有关,这些因素均可能影响数据分析的准确性。因此PLR最佳截值的确定以及与前列腺癌患者预后的相关性,有待更大样本量的多中心研究来进一步确定。
综上所述,术前PLR升高是影响前列腺癌根治术后预后的独立危险因素,可作为评价其预后的生化指标之一。

