论相同浓度醋酸与氢氧化钠溶液混合后溶液中微粒浓度的关系
唐德成
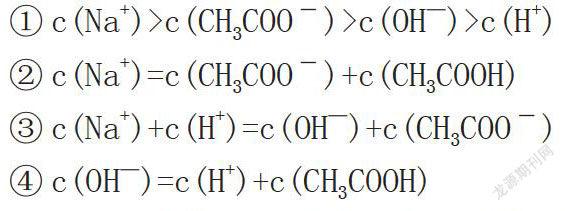



摘 要:相同浓度的醋酸与氢氧化钠混合后溶液中微粒浓度大小的讨论涉及了水的电离平衡、醋酸的电离平衡、醋酸根的水解平衡,微粒浓度之间的关系是高中化学选修四中第三章溶液中离子平衡教学中的难点。本文探讨等体积混合、混合后呈中性、醋酸与氢氧化钠体积比2:1混合三种情况下溶液离子浓度的关系,以期为教学实践找到有效的切入点和途径。
关键词:等体积;等浓度;酸碱性;离子浓度大小
第一种情况醋酸与氢氧化钠等体积混合,且浓度相同,混合后则是酸碱恰好完全反应,所以讨论的对象就是醋酸钠溶液。对于醋酸钠溶液就是讨论醋酸根离子的水解,所以溶液中的离子浓度关系有
对于一元酸与一元碱的混合,无论是强酸与弱碱混合还是弱酸和强碱混合,只要是等体积等浓度,则恰好完全反应,讨论的对象就是盐溶液,讨论的关键就是水解平衡,和上述实例的分析思路一样。
第二种情况是醋酸与氢氧化钠混合后溶液呈中性,根据第一种情况,如果酸碱恰好完全反应,则溶液呈碱性,要使混合后溶液呈中性,在等浓度条件下,则混合前醋酸溶液的体积大于氢氧化钠溶液的体积,即醋酸的物质的量大于氢氧化钠的物质的量,混合后溶液中离子浓度关系有
对于一强一弱的一元酸碱混合,在等浓度的条件下中和至中性,则有c(H+)=c(OH—),再利用电荷守恒,即可得出①式,②式是根据混合前醋酸的物质的量大于氢氧化钠的物质的量得出的,将②式带入③式可得出④式。此时所得溶液中的溶质应该为中和生成的醋酸钠与剩余的醋酸,所以既存在醋酸钠的水解,又存在醋酸的电离。从这两个离子平衡去分析认识,才能更透彻。
第三种情况是醋酸体积为氢氧化钠溶液体积的二倍,则混合后溶液中的溶质为醋酸钠与醋酸,且二者等量。溶液中存在醋酸钠的水解平衡和醋酸的电离平衡
如果换成另外一种弱酸,溶液显碱性,则水解程度大于电离程度,分析方法相同。注意这种情况的前提,弱酸(碱)的物质的量是强碱(酸)的物质的量的2倍,混合后剩余弱酸(碱)与盐是等量的关系。
以上三种情况是处理溶液中离子平衡问题常见的三种类型,在教学的过程中,首先要将混合后溶液中的溶质分析清楚,将存在的离子平衡分析准确,再根据平衡进行的程度,合理分析各离子浓度的关系。学生在解决这些问题时很茫然,不知所措,关键是没有形成正确的分析思路。在教学的过程中,要注重学生正确分析问题能力的培养,让学生掌握正确的方法,面对任一情况都能找准正确的切入点,合理分析,得出正确的结论。
在以上情况的基础上,可能还会讨论在中和过程中离子浓度可能出现的情况,如果是氢氧化钠溶液加入到醋酸溶液中,可能出现的离子浓度情況:
当氢氧化钠的量加的足够多时最终离子的大小关系是:c(Na+)>c(OH—)>c(CH3COO-)>c(H+)。在讨论离子大小可能的情况时要充分利用电荷守恒的思想,同时要利用极限思考的方式,如加的氢氧化钠特别少,或者加的氢氧化钠特别多是来判断两个端点的离子大小情况。
参考文献
[1]谈“化学反应的限度”教学概念导入的实验设计[J].陆余平.中小学教学研究.2007(10)
[2]化学实验教学中实施探究教学的探讨[J].蔡小兰.数理化学习.2009(04)

