醋酸铵对溶液酸碱性的影响
柴国英+吴文中
摘要:醋酸铵溶液中的醋酸根与铵根离子对溶液的离子行为的影响往往是同时的,不可忽视其中某一离子对其他溶液的影响;当溶液为酸性时,加入醋酸铵后,其中的醋酸根离子起主要作用,溶液酸性减弱,但不能忽视铵根离子对溶液的影响;当溶液为碱性时,碱性减弱,铵根离子是主因,也不能忽略醋酸根离子对溶液的影响。酸碱质子理论认为,醋酸铵溶液是一种缓冲溶液,是解决这类问题的简单处理方式。
关键词:醋酸铵;酸碱性;平衡移动;酸碱质子理论;同离子效应
文章编号:1005–6629(2017)11–0088–05 中图分类号:G633.8 文献标识码:B
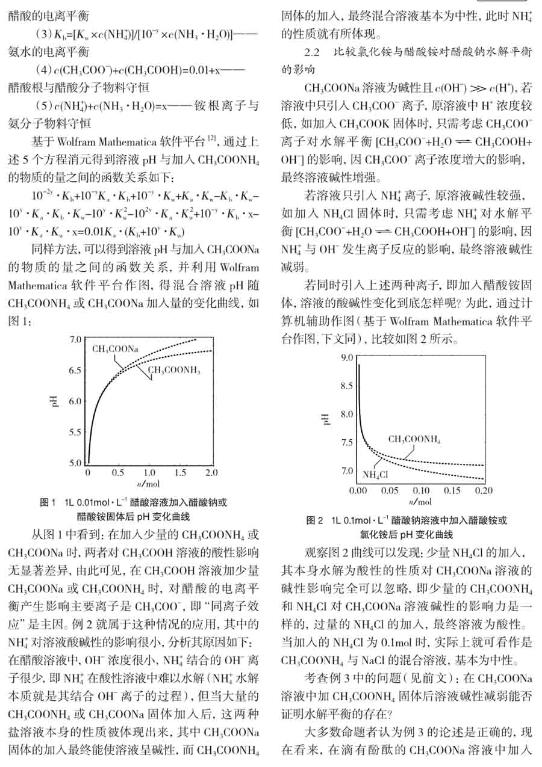


正因为CH3COONH4具有以上的特殊性质,因此其常常作为一种缓冲溶液,在CH3COONH4溶液中加入NaOH或盐酸后pH变化如图5。
文献[3]采用数字化实验测定在0.1mol·L-1 CH3COONa溶液逐漸加入饱和的CH3COONH4溶液,发现混合溶液的pH开始显著下降,之后溶液的pH反而升高的反常现象,文章的解释是因为CH3COONH4溶液并非完全为中性而是略为碱性。
但即便如此,也不可能出现pH先下降又上升的反常现象。查阅相关文献,并无相应阐述,经分析,笔者认为可能存在以下3个原因:
(1)混合溶液有效浓度发生变化,随着混合溶液离子浓度的增大,对溶液氢离子活度产生影响;
(2)由于CH3COONH4固体溶于水时,热效应显著,在水中加入CH3COONH4固体溶解后,溶液温度由18℃下降为9℃,混合溶液体系温度显著降低,从而影响各种平衡的电离常数,温度降低导致水的电离也受到较大影响,pH增大;同时我们测定了在水中加入饱和醋酸铵溶液后溶液温度的变化,发现溶液的温度由22℃升为25℃,温度是升高的,但温度变化幅度不大,此时对水电离的影响也许较小,但对CH3COO-水解影响可能较大,溶液的pH也可能同样增大;
(3)由于CH3COONH4溶液自身分解影响了溶液的pH,有人做了如下实验:CH3COONH4浓度2%时分解温度大约62℃,浓度10% 的分解温度为52℃,而浓度20%的分解温度只有38℃。值得注意的是:CH3COONH4分解后得到的醋酸分子比氨气更容易逸出,CH3COONH4是一种有乙酸气味的白色三角晶体的事实也说明其容易逸出乙酸。综合上述多方面因素可能是造成混合溶液的pH反而升高的反常现象。
限于实验条件限制,相关研究无法展开,这也说明化学实验的复杂性,多种因素影响实验结果的现象随时都可能发生。(注:以上的定性讨论,纯粹是一种可能性分析)
参考文献:
[1]李家郢.为何在氯化镁溶液中加氨水生成氢氧化镁沉淀,而氢氧化镁又可溶于氯化铵溶液[J].中学化学教学参考,1988,(3):26~27.
[2]吴文中.例谈作图法在高中化学解题中的应用[J].化学教学,2015,(3):72~75.
[3]罗敏,胡晓红.借助传感器探究醋酸铵对同类盐水解的影响[J].中学化学教学参考,2017,(1~2):48~50.endprint

