用平衡常数说明盐类水解的几个问题
潘雄风

【摘 要】平衡常数是用来解决化学平衡问题的一种重要工具,利用课本和资料上提供的一些数据,通過平衡常数的相关计算帮助学生更好地理解盐类水解的相关知识,特别是判断溶液的酸碱性和溶液酸碱的强弱。
【关键词】平衡常数;盐类水解;酸碱性
1.问题的提出
盐类的水解是选修4第三章《水溶液中的离子平衡》的重点内容,知识本身又比较复杂和抽象,属于高中化学知识体系中的难点。涉及的知识点多,能够很好地考查学生的综合分析能力。因此盐类水解的相关知识也成为了近几年高考的高频考点。特别是将化学平衡常数与盐类水解平衡相结合,如2017年高考化学全国卷I最后一个选择题中的C选项,就是要利用酸式盐的水解常数与电离常数的大小进行比较才能得出正确答案。所以盐类水解的相关知识是教师教学过程中亟待突破的难点。
在实际的教学过程中,很多教师在教学过程中重视盐类水解的规律总结,特别强调“越弱越水解”的记忆,欠缺对“越弱越水解”的数据分析,缺乏应用平常常数来分析问题的依据,导致很多学生只是机械地记住水解规律的口诀,并未自己消化理解口诀将它内化为自己的知识,导致知识容易遗忘。所以学生在面对盐类水解的题目,分析解答比较困难,教师讲解起来也比较费劲。
笔者在这个部分的教学过程中采用数据分析盐类水解的规律,应用平常常数帮助学生直观地体会“越弱越水解”的含义,让学生对知识的理解更加深入,对知识的印象更加深刻。
2.常数说明溶液的酸碱性
2.1比较强碱弱酸盐的碱性强弱
【题1】 相同浓度的①NaClO②CH■COONa③NaHCO■ 三种溶液,pH值的大小顺序_______。
【解析】方法一:酸性CH■COOH>H■CO■>HClO。酸性越弱对应酸根离子的水解程度大,水解产生的OH■越多,碱性越强;碱性NaClO>NaHCO■>CH■COONa。多数学生只能机械记忆性地解答该题,学生往往不能理解为什么酸性弱,对应弱酸根离子的水解程度大,所以在变式训练的时候容易出错。
方法二:用电离平衡常数说话,如下表
Ka越小,酸性越弱;根据CH■COO■+H■O CH■COOH+OH■书写水解常数表达式K■= =×=;推倒K■=K■/K■,让学生计算每一个物质的K■(如表1),发现K■越小,Kh越大,弱酸阴离子水解程度越大,水解产生OH■越多,碱性越强。
2.2判断混合溶液的酸碱性
【题2】 相同浓度的NH■Cl溶液和氨水等体积混合,溶液呈______性。
教师在讲解这类题目往往是让学生记住呈碱性,同理的还有浓度相同CH■COOH与CH■COONa溶液等体积混合呈现酸性,浓度相同NaCN与HCN等体积混合溶液呈碱性,许多同学可能都会有些提出疑问,为什么是这样。笔者分析讲解通过如下表格:
表2
醋酸的K■大于醋酸钠的K■,浓度相同,醋酸电离产生的H■浓度大于醋酸根水解产生的OH■的浓度,所以二者的混合溶液显酸性;同理K■(NH■·H■O)>K■(NH■Cl),相同浓度NH■·H■O电离产生的c(OH■)大于NH■■水解产生的c(H■),混合溶液显碱性。NaCN与HCN等体积混合溶液原理相同,NaCN的K■大于HCN的K■,所以二者等浓度等体积混合呈现碱性。
2.3判断酸式盐溶液的酸碱性
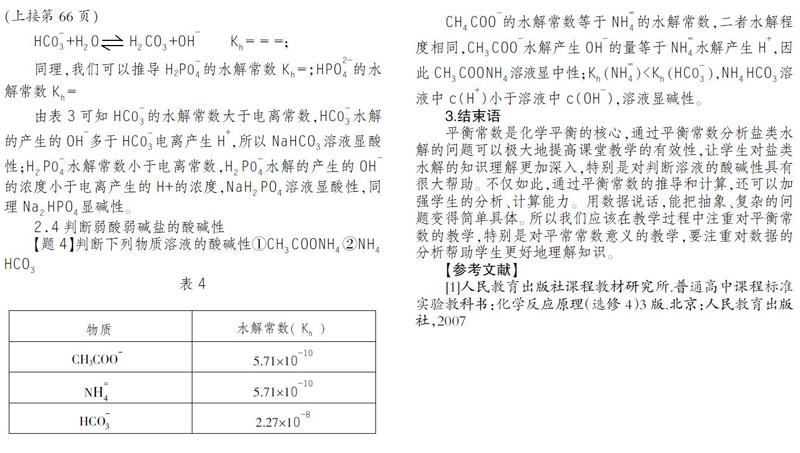
【题3】 判断下列物质溶液的酸碱性①NaHCO■②NaH■PO■③Na■HPO■
教师在实际教学过程中往往只会让学生死记硬背,学生不能理解其中原委,导致学生的印象不深,容易遗忘。笔者让学生通过课本的相关常数计算出各物质的水解和电离平衡常数,如下
表3
HCO■■+H■O H■CO■+OH■ K■= = =;
同理,我们可以推导H2PO■■的水解常数K■=;HPO■■的水解常数K■=
由表3可知HCO■■的水解常数大于电离常数,HCO■■水解的产生的OH■多于HCO■■电离产生H■,所以NaHCO■溶液显酸性;H■PO■■水解常数小于电离常数,H■PO■■水解的产生的OH■的浓度小于电离产生的H+的浓度,NaH■PO■溶液显酸性,同理Na■HPO■显碱性。
2.4判断弱酸弱碱盐的酸碱性
【题4】判断下列物质溶液的酸碱性①CH■COONH■②NH■HCO■
表4
CH■COO■的水解常数等于NH■■的水解常数,二者水解程度相同,CH■COO■水解产生OH■的量等于NH■■水解产生H■,因此CH■COONH■溶液显中性;K■(NH■■) 3.结束语 平衡常数是化学平衡的核心,通过平衡常数分析盐类水解的问题可以极大地提高课堂教学的有效性,让学生对盐类水解的知识理解更加深入,特别是对判断溶液的酸碱性具有很大帮助。不仅如此,通过平衡常数的推导和计算,还可以加强学生的分析、计算能力。用数据说话,能把抽象、复杂的问题变得简单具体。所以我们应该在教学过程中注重对平衡常数的教学,特别是对平常常数意义的教学,要注重对数据的分析帮助学生更好地理解知识。 【参考文献】 [1]人民教育出版社课程教材研究所.普通高中课程标准实验教科书:化学反应原理(选修4)3版.北京:人民教育出版社,2007

