肠易激综合征内脏高敏模型不同制作方法的比较研究
张薇,赵映,郑倩华,黎明,张健强,李瑛,蔡定均
(成都中医药大学针灸推拿学院,成都 610072)
肠易激综合征(irritable bowel syndrome,IBS)是临床常见的功能性肠病,以腹痛、排便习惯改变及粪便性状异常为主要临床表现[1]。 流行病学研究发现,IBS 影响约11%的全球人口,在中国IBS 患病率为0.82% ~ 11.5%[2]。 现代研究表明 IBS 的发病与内脏感觉过敏、胃肠动力学失常、精神因素、感染因素等相关[3]。 其中内脏高敏作为IBS 最主要的病变特征之一,其主要表现为内脏组织对生理性刺激及伤害性刺激的敏感性及反应性增强[4]。 在课题组前期研究中发现,IBS 内脏高敏的造模方法较多,虽各有优势,但都缺乏对模型内脏高敏状态的稳定性和持续性进行深入研究。 另外,目前研究IBS 内脏高敏所使用的幼鼠模型最常用的造模方法为新生期母婴分离(neonatal maternal separation,NMS)法[5-6],然而这种造模方式尚不完善[7],且刺激因素相对单一。 因此,我们将NMS 造模方法与慢性不可预测性应激[8]当中的时间应激相结合,并把此模型称之为不可预测性母婴分离模型,将其与传统母婴分离模型相比较,评估内脏高敏性及稳定性和持续性上有何异同,为IBS 内脏高敏幼鼠模型的研究和该病的相关治疗研究提供思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
2 日龄清洁级SD 大鼠30 只,雌雄各半,体重(8± 2.5)g,由成都中医药大学实验动物研究中心提供【SCXK(川)2019-11】,动物在成都中医药大学SPF级实验动物中心饲养【SYXK(川)2019-049】,室内温度18 ~24℃,湿度50% ~70%,昼夜节律12 h:12 h。 所有操作均符合成都中医药大学实验伦理学要求(成都中医药大学动物伦理备案号:2019-06),并且实验操作过程中按实验动物使用的3R 原则给予人道关怀。
1.1.2 试剂与仪器
二甲苯(AR 级),批号:20181020,福晨(天津)化学试剂有限公司;苏木素染液,批号:G1005-1,武汉赛维尔生物技术有限公司;伊红染液,批号:G1001,武汉赛维尔生物技术有限公司;盐酸(AR级),批号:20180118,成都市科龙化工试剂厂生产;中性树胶,批号:BL704 A,Biosharp 生物公司;转轮式切片机(徕卡-2016,德国);TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司,中国);BMJ-Ⅲ型包埋机(常州郊区中威电子仪器厂,中国);PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司,中国);数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司,中国);图像分析软件 Image-Pro Plus 6.0 (Media Cybernetics 公司,美国)。
1.2 方法
1.2.1 动物分组
每只幼鼠与哺乳母鼠共同饲养于塑料笼内,幼鼠在出生后第22 天断奶,第30 天分笼,并进行雌雄分离。 哺乳母鼠自由进食与饮水。 采用随机数字表将幼鼠随机分成母婴分离组(A 组)、不可预测性母婴分离组(B 组)和空白对照组(C 组),每组10只,雌雄各半。
1.2.2 肠易激综合征内脏高敏性模型的建立
A 组:乳鼠在出生后2 ~21 d 每天与母鼠分离3 h(9:00-12:00)。 B 组:乳鼠在出生后 2 ~ 21 d每天与母鼠分离3 h,每天随机安排分离时间刺激,分离时间段为:①9:00-12:00;②14:00-17:00;③19:00-22:00,且每个分离时间段不连续出现3 d,使动物不能预料分离刺激的发生。 C 组:乳鼠在出生后2 ~21 d 与母鼠一直共同饲养,不做任何分离处理。
1.2.3 观察指标
(1)一般情况
造模结束后,在大鼠 5 周龄、7 周龄、9 周龄和11 周龄时对所有组别的大鼠进行体重测量,并且观测所有组别大鼠的精神状态、皮毛色泽、活动度及进食量,并将以上指标作详细记录。 进食量检测方法为:将各组大鼠进行单笼饲养,称取24 h 前后饲料重量,进食量(g)=原有饲料量(g)-剩余量(g)。
(2)大便情况
造模结束后,在大鼠11 周龄时观测各组大鼠的大便颗数及粪便性状,采用Bristol 大便分型量表[9]判断粪便性状,评分标准为:1 分,分离的硬团;2 分,团块状;3 分,干裂的香肠状;4 分,柔软的香肠状;5 分,软的团块;6 分,泥浆状;7 分,水样便。 并测定粪便含水量,方法如下:对所有组别大鼠分笼单只饲养,在自由进食与饮水的情况下,每隔2 h 收集各组大鼠粪便一次,共收集12 h 粪便,使用电子天平称秤得湿重后,放入50℃烤箱内烘烤6 h 后,取出称干重,计算粪便含水量。 含水量=(湿重-干重)× 100%。
(3)内脏高敏测定
造模结束后,在大鼠 5 周龄、7 周龄、9 周龄和11 周龄时进行不同压力下结直肠扩张(colorectal distention,CRD) 刺激, 并使用腹壁撤退反射(abdominal withdrawal reflex,AWR)评分及内脏痛阈值进行评价,以评估其内脏敏感性。
中国国有企业大致分为三类:一是中央所属的工业企业(特殊行业的不算),即“中央企业”(狭义); 第二类是中央所属的非工业企业和特殊行业的工业企业,这类企业被财政部称为“中央企业”(广义),不但包括中央所属的金融机构,如四大国有商业银行、烟草总公司、铁路总公司等巨无霸企业,也包括各中央部委所属的林林总总的企业,甚至某部委机关服务中心下属的地下室招待所、印刷厂都在其中;第三类是地方政府出资成立的国有企业,按属地原则由当地政府所属的国资委或指派特定机构履行出资人职责。说明一下,地方国资委与国务院国资委无直接隶属关系,它们归地方政府管。
腹壁撤退反射评分:实验前24 h 禁食但不禁水,单手抓握大鼠后轻揉其肛口,排尽粪便后,用少量乙醚麻醉。 将麻醉后的大鼠放入自制的大鼠固定器中(清醒后大鼠在该固定器中只能上下运动,无法前后活动及转身),将涂抹石蜡油的球囊导管轻柔插入大鼠肛门,使球囊末端距肛门约1 cm,并用胶带将导管与鼠尾根部固定。 待大鼠清醒并能适应环境后,向球囊内迅速充气,使球囊扩张压在短时间内分别达到 20、40、60 和 80 mmHg。 每个压力梯度保持30 s,并观察记录AWR 评分。 使用腹壁撤退反射评分,评分标准:0 分:给予扩张刺激时大鼠的情绪基本稳定;1 分:给予扩张刺激时大鼠变的相对不稳定,偶尔扭动头部;2 分:腹背部肌肉轻微收缩但腹部未抬离地面;3 分:腹背部肌肉强烈收缩并把腹部抬离地面;4 分:腹部肌肉强烈收缩,腹部呈弓形并把腹部、会阴部抬离地面[10]。 每次检测重复3 次,评分过程采用盲法评价,避免人为的主观影响。
内脏痛阈值:将大鼠放入固定器中并插入球囊导管(方法与腹壁撤退反射一致),向球囊内迅速充气,压力从0 mmHg 每次匀速递增5 mmHg,每次扩张持续30 s 以观察大鼠的反应,待大鼠安静l min后,反复多次加压直至大鼠腹部抬起和背部拱起(即AWR 评分为3 分)时的最低压力值作为内脏痛阈值[11]。 每个压力值重复3 次检测,取平均值整个检测过程中为防止球囊对大鼠肠粘膜有所损害,球囊压力控制在0 ~80 mmHg 之间。
(4)大鼠结肠组织病理观察
在上述检测结束后,使用颈椎脱臼法处死大鼠后,迅速取距肛门4 ~5 cm 处约1 cm 的远端结肠,用4%多聚甲醛中固定,石蜡包埋,切片,用苏木精-伊红染色,在光学显微镜下观察切片:炎性细胞(主要是中性粒细胞)在全层中浸润化及浸润的程度,各细胞间质之间的水肿情况,并根据结肠病理组织评价炎症分级[12]标准进行评分,如表1 所示。
1.3 统计学分析
采用SPSS 21.0 软件对实验数据进行统计学分析。 首先对数据进行正态性分析,符合正态分布的数据采用平均值± 标准差()描述,采用单因素方差分析进行比较。 由于多个时间点比较,故组间和组内差异同时采用重复测量进行比较。 不满足正态分布的数据采用中位数(P25,P75)描述,采用秩和检验进行比较,以P <0.05 表示差异具有显著性。
2 结果
2.1 一般情况
由表2 中所示,各组大鼠间体重无显著性差异(P>0.05)。 由于不同性别大鼠在发育过程中体重增长会存在差异,因此我们对各组同性别大鼠的体重做了比较,结果显示在7 周龄及11 周龄时,各组同性别大鼠间体重无显著性差异(P>0.05)(见图1)。 此外,与C 组比较,A 组和B 组大鼠精神较差,毛发枯黄无光泽,活动减少,且进食量也有所减少(表3)。

表1 结肠病理组织评价炎症分级Table 1 Evaluation of colonic pathological tissue inflammation grade
2.2 大便情况
表2 不同时间点各组大鼠体重比较( , n =10, g)Table 2 Comparison of the weight of rats in different groups at different time points( , n =10, g)

表2 不同时间点各组大鼠体重比较( , n =10, g)Table 2 Comparison of the weight of rats in different groups at different time points( , n =10, g)
组别Groups 5 周龄5 weeks 7 周龄7 weeks 9 周龄9 weeks 11 周龄11 weeks母婴分离组Neonatal maternal separation group 121.52 ± 13.63 136.58 ± 4.69 240.67 ± 60.01 296.76 ± 74.02不可预测性母婴分离组Unpredictable neonatal maternal separation group 135.47 ± 13.37 133.47 ± 8.31 215.73 ± 49.83 294.34 ± 74.77白对照组Control group 130.72 ± 12.11 138.63 ± 11.25 195.00 ± 39.92 287.78 ± 64.12 P 0.069 0.406 0.149 0.958
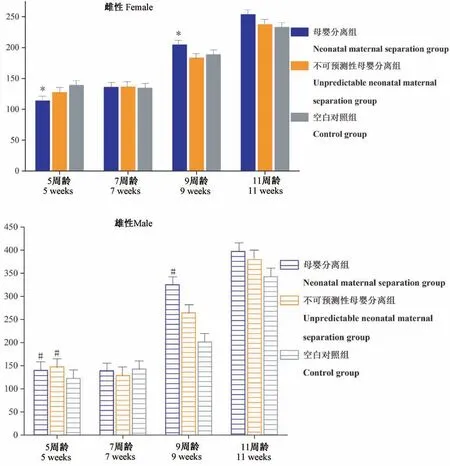
注:与空白对照组大鼠比较,*P<0.05,#P<0.05。图1 各组间同性别大鼠在不同年龄段的体重(g)比较Note. Compared with the Control group,*P<0.05,#P<0.05.Figure 1 Comparison of body weight (g) of rats of the same sex between different groups at different ages
表3 各组大鼠进食量比较( , n =10, g)Table 3 Comparison of food intake of rats in each group( , n =10, g)

表3 各组大鼠进食量比较( , n =10, g)Table 3 Comparison of food intake of rats in each group( , n =10, g)
注:与空白对照组比较,*P<0.05。Note. Compared with Control group,*P<0.05.
组别Groups 5 周龄5 weeks 7 周龄7 weeks 9 周龄9 weeks 11 周龄11 weeks母婴分离组Neonatal maternal separation group 4.00 ± 0.000 4.20 ± 1.033 2.80 ± 1.135* 3.60 ± 0.966不可预测性母婴分离组Unpredictable neonatal maternal separation group 4.60 ± 0.843 3.80 ± 1.033 2.40 ± 1.647* 4.20 ± 1.033空白对照组Control group 4.60 ± 0.843 4.40 ± 0.966 4.40 ± 0.966 5.00 ± 0.000
表4 各组大鼠大便颗粒数、性状及含水量比较( , n =10)Table 4 Comparison of the number of stool particles, characters and water content of rats in each group( , n =10)

表4 各组大鼠大便颗粒数、性状及含水量比较( , n =10)Table 4 Comparison of the number of stool particles, characters and water content of rats in each group( , n =10)
注:与空白对照组比较,*P<0.05;与不可预测性母婴分离组比较,▲P<0.05。 (下表同)Note. Compared with Control group,*P< 0.05. Compared with unpredictable neonatal maternal separation group,▲P< 0.05.(The same in the following Tables)
组别Groups大便颗粒(颗)Stool particles(Pieces)大便性状(分)Stool characteristics(marks)粪便含水量(%)Fecal water content(%)母婴分离组Neonatal maternal separation group 6.400 ± 5.720▲ 4.323 ± 0.74 1.124 ± 1.160▲不可预测性母婴分离组Unpredictable neonatal maternal separation group 15.700 ± 8.520* 3.887 ± 0.35 2.581 ± 1.190*空白对照组Control group 6.900 ± 5.950▲ 3.847 ± 0.27 0.789 ± 0.700▲
2.3 内脏高敏测定
2.3.1 腹壁撤退反射评分
由图 2 所示,与 C 组相比,A 组及 B 组大鼠AWR 评分更高,且在9 周龄时达到峰值,而在11 周龄,A 组及B 组大鼠AWR 评分较之前降低。 此外,各组同周龄大鼠AWR 评分比较,在5 ~9 周龄期间,以A 组大鼠的AWR 评分最高。
2.3.2 内脏痛阈值
由表5 所示,与 C 组比较,在5 ~ 9 周龄期间,A组和B 组引起腹部抬起与背部拱起的压力值更低,但是在11 周龄时痛阈值较C 组更高。
2.4 大鼠结肠组织病理观察
如图3 所示,A 组和B 组动物结肠组织形态较为完整,分层较为明显,结构清晰;黏膜层结构完整,单层柱状上皮细胞排列紧密,形态正常,胞质染色均匀,胞核轮廓清晰,未见变性或坏死脱落,部分动物固有层内少量肠腺出现变性坏死,长单管状结构消失,少量炎细胞呈小灶状聚集,包括中性粒细胞及淋巴细胞;间质内未见明显水肿;黏膜下层可见少量炎细胞散在分布;黏膜下层、肌层和外膜连接紧密,结构完整清晰,其他未见明显病理变化。 C组未见异常。 最后统计结果显示,与C 组相比,A组和B 组病理评分稍有升高,但均不具有统计学意义(P>0.05)。
3 讨论
本研究将新生期母婴分离的造模方法与慢性不可预测性应激当中的时间应激相结合,制作了不可预测性母婴分离模型。 旨在将母婴分离这一种单一因素的造模方法与其他刺激因素相结合,更能体现出IBS 发病复杂性的特点。 同时,大量实验中母婴分离模型的分离时间相对固定(一般为上午)[13-14],此分离时间存在局限性,易对幼鼠产生耐受,故我们在母婴分离模型中加入了时间随机这一不可预测性应激刺激,使幼鼠不能提前感知母婴分离刺激的到来,不易产生耐受。

注:与空白对照组比较,*P<0.05。图2 不同时间点不同直肠扩张压力下各组大鼠AWR 的比较( x¯± s, n =10)Note. Compared with Control group,*P<0.05.Figure 2 Comparison of AWR of rats in different groups under different rectal dilatation pressure at different time points( x¯± s, n =10)
表5 不同时间点各组大鼠内脏痛阈值的比较( , n =10, mmHg)Table 5 Comparison of visceral pain thresholds of rats in different groups at different time points( , n =10,mmHg)

表5 不同时间点各组大鼠内脏痛阈值的比较( , n =10, mmHg)Table 5 Comparison of visceral pain thresholds of rats in different groups at different time points( , n =10,mmHg)
组别Groups 5 周龄5 weeks 7 周龄7 weeks 9 周龄9 weeks 11 周龄11 weeks母婴分离组Neonatal maternal separation group 69.67 ± 10.83 68.67 ± 7.40 55.67 ± 12.77*▲ 74.67 ± 4.77不可预测性母婴分离组Unpredictable neonatal maternal separation group 72.00 ± 4.21 66.00 ± 15.78 76.80 ± 5.18 75.97 ± 4.66空白对照组Control group 74.00 ± 5.16 75.00 ± 8.18 76.90 ± 8.18 73.00 ± 6.75

注:中性粒细胞(↑);淋巴细胞浸润(↑)。图3 各组结肠组织病理光镜观察图(× 400,标尺=100 μm)Note. Neutrophils (↑). Lymphocyte infiltration (↑).Figure 3 Pathological observation of colonic tissue in each group (× 400, Scale bar=100 μm)
从本研究的结果可以看出,母婴分离法与不可预测性母婴分离法均可复制IBS 模型,但各自的侧重点不同,从大便情况来看,与母婴分离组及空白对照组比较,不可预测性母婴分离组大鼠大便颗数更多,多为软稀便,且粪便含水量增加更多,这说明与其余两组相比,不可预测性母婴分离模型更符合制作腹泻型IBS 模型。 而从IBS 内脏高敏测定上,与空白对照组和不可预测性母婴分离组大鼠比较,5~9 周龄期间,母婴分离组大鼠的AWR 评分最高,这说明母婴分离组的内脏高敏程度高于其余两组,更适合制作IBS 内脏高敏模型。 从IBS 内脏高敏持续性测定可以看出,内脏高敏状态具有时间依赖性。 在造模后,大鼠呈现出内脏高敏状态,且在9 周龄时达到峰值,而在大鼠11 周龄时有所下降。 这一现象提示在研究IBS 幼鼠模型内脏高敏状态时,应严格注意时间。 造模后,模型在9 周龄之前呈现出稳定的内脏高敏状态,在这之后便出现内脏高敏自愈倾向。 同时,这一现象也提示在研究相关干预措施对内脏高敏状态的治疗作用中,应该充分考虑模型自愈可能带来的效力评价准确性、客观性问题。从实验结果可以看出,幼鼠在造模结束后,内脏高敏感性仅能维持到成年后3 周内,而幼鼠模型需在其成年后(即8 周龄)才能施加干预措施,因此我们在造模后施加干预措施时,应在幼鼠模型成年后3周以内施加,才能准确观测到干预措施对模型内脏高敏状态的影响。
综上所述,母婴分离法及不可预测性母婴分离法均可模拟IBS 内脏高敏模型,但各具优劣及其适合的研究症状。 此外,本研究发现幼鼠模型内脏高敏状态存在时间依赖性,最佳研究时间为大鼠9 周龄以内。 本研究创新性的制作不可预测性母婴分离模型,弥补了传统母婴分离模型分离时间存在耐受性不足,并且观察了该模型的内脏高敏持续性,这在前期文献研究中鲜有研究及说明,对今后该疾病的模型评价及干预措施研究提供证据。
然而本研究尚存在一些不足,在研究中仅对模型的一般情况、大便性状、内脏敏感性及肠道病理情况进行测定,未针对模型的心理状态进行深入研究,在后期研究中可以增加高架十字迷宫、旷场试验等动物模型精神行为学的检测,以检测母婴分离模型及不可预测性母婴分离模型对幼鼠的精神活动有无影响。 另外,使用腹壁撤退反射评分及内脏痛阈值进行内脏高敏评价具有一定的主观性,因此在后期可加入腹壁肌电活动或脊髓诱发电位等检测对内脏敏感性测定有更为客观的评价。 本文对通过不同方法制作IBS 内脏高敏幼鼠模型,并对其内脏高敏情况及模型持续性进行了评价,为今后IBS 内脏高敏模型的建立、运用及治疗评价等基础研究提供思路。

