miR-181b 调控Mex3B 蛋白对动脉粥样硬化斑块形成及分子机制研究
张诗渊
(南昌大学第二附属医院超声科,南昌 330006)
动脉粥样硬化(atherosclerosis,AS)作为一种具有潜在致命性的累及全身动脉脂质代谢紊乱的慢性炎症疾病,是造成心脑血管恶性事件的主要原因之一,其中颈动脉为多发部位。 颈动脉粥样硬化(carotid atherosclerosis,CAS)是缺血性脑卒中的危险因素。 研究表明[1]AS 是一种炎症性疾病,其发生、发展与动脉内膜中的脂质沉积密切相关,但目前AS 的病理生理机制尚未完全明确。 微小核糖核酸(microRNA,miRNA)是一种内源性的具有调控功能的非编码 RNA。 研究表明[2]多种miRNA 参与调节心脑血管系统中细胞的增殖、分化、凋亡、衰老等细胞生物学行为。 Li 等[3]研究表明miRNA-21 增强血管平滑肌的细胞增殖,推动AS 的进程。 Gao等[4]报道血浆中的miR-126 和miR-143 的含量可以作为动脉粥样硬化的新型生物标志物。 近来miR-181b 与 AS 的关系引起关注。 Sun 等[5]研究表明miR-181b 调控Notch1 通路影响AS 血管内皮组织的炎性反应。 Zhong 等[6]研究证实 miR-181b 联合STAT3 通路影响 AS 细胞模型的凋亡率,但关于miR-181b 对AS 斑块影响的作用机制未见报道。 肌肉过量蛋白-3(muscle excess protein-3,Mex3)作为早期胚胎发展中的一种RNA 结合蛋白,可以抑制细胞内蛋白的表达。 研究表明[7]在四种人类Mex3 蛋白中,Mex3B 的表达与机体炎症应激密切相关。 本研究通过维生素D3 联合高脂饮食法构建动脉粥样硬化大鼠模型,探讨miR-181b 和Mex3B 对动脉粥样硬化斑块形成的调控机制,以期为临床研究提供数据支撑。
1 材料和方法
1.1 实验动物
7 ~8 周无特殊病原体(specific pathogen free,SPF)级雄性 SD 大鼠 40 只,(200±20)g,由江西中医药大学医学实验动物科学部提供[SCXK(赣)2018-0003],动物实验在南昌大学生命科学研究院[SYXK(赣)2015-0002]进行;依照南昌大学医学院医学实验动物科学部实验动物管理办法,室温21℃~25℃下,湿度维持在60%左右,自然光照、标准饲料、自由饮水、单笼饲养一周后用于实验。 所有动物福利和实验程序均严格遵守我院的《实验动物的护理和使用指南》及相关道德规范,本研究中涉及动物的使用及操作按3R 原则给与动物人道的关怀,并经本院实验动物管理伦理委员会批准(IACUC(赣)-2019-076)。
1.2 主要试剂与仪器
miR-181b 抑制物 miR-181b-inhibitor 及 miR-181b 抑制物阴性对照miR-181b-inhibitor-NC 由上海吉玛技术有限公司设计完成。
维生素D3 注射液(上海通用药业有限公司,国药准字:H31022404,规格:1 mL:7.5 mg,以维生素D3 计);高脂饲料(81.3%基础饲料+10%猪油+5%白糖+3% 胆固醇+0.5%胆酸钠+0.2%丙基硫氧嘧啶,总能量为6 kcal/g。 等级:A 级)由我院医学实验动物中心提供。
LipofectamineTMRNAiMAX 转染试剂(德国QIAGEN 公司);全蛋白抽提试剂盒(日本TOYOBO公司);PBS 缓冲溶液、双荧光素酶测定试剂盒、苏木精伊红(hematoxylin eosin,E) 试剂盒(美国Invitrogen 公司);肿瘤坏死因子-α(tumor necrosis factoR-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)抗体、基质金属蛋白酶-9(matrix metalloprotein,MMP-9)抗体(美国 Abcamn 公司);麻醉剂、Mex3B抗体(美国 Jackson 公司);反转录试剂盒、Western blot 试剂盒(美国 sigma 公司);油红 O 染色试剂盒(美国R&D 公司);脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal-deoxynucleotidyl transferase mediatednick end labeling,TUNEL)试剂盒(美 国 Amresco 公 司 );增 强 化 学 发 光(electrochemiluminescence,ECL)化学发光显色试剂盒(美国 Millipore 公司)。
YJ-875 A 医用净化工作台、高速低温离心机(北京六一仪器厂);LIOOS600T 荧光显微镜(日本尼康公司);Bio-rad 凝胶成像系统(Bio-rad 公司);-80℃深冷冰箱(德国维根斯公司);Leica RM2135 组织切片机(德国 Leica 公司);RT-PCR 仪(美国 Palo Alto 公司);LOGIQ7 型彩色多普勒超声成像系统(美国GE 公司);Vevo 2100 高分辨率小动物超声仪(加拿大 Visual Sonic 公司)。
1.3 实验方法
1.3.1 动脉粥样硬化动物模型构建及实验分组
将40 只 SD 大鼠随机分成 4 组,每组 10 只,分别为:正常组、模型组、miR-181b-inhibitor-NC 组(对照组)和miR-181b-inhibitor 组(实验组)。
准确量取2.5 μL 的 LipofectamineTMRNAiMAX分别与 9 μL 的 miR-181b-inhibitor-NC 和 miR-181binhibitor 混合均匀,37℃下静置2 h。 通过尾静脉分别注射7 μL 混合液到对照组和实验组动物体内,注射速度维持在2 μL/min,留针时长5 min,正常组和模型组注射等剂量的生理盐水,注射完毕24 h 后,模型组、对照组、实验组大鼠采用维生素D3 联合高脂饮食法构建动脉粥样硬化模型[8]。 具体操作如下:将维生素D3 以600000 U/kg 的剂量一次性腹腔注射进大鼠体内后每日以100 g 高脂饲料喂养,正常组大鼠始终以等量基础饲料喂养。 饮水、光照、温度恒定不变。
1.3.2 Vevo 2100 超声仪对各组大鼠的动脉检测
喂养60 d 后,颈动脉超声检查观察各组大鼠颈动脉内膜是否光滑、有无增生或者斑块、斑块部位、大小和回声点。 沿血管长轴测量管腔动脉后壁内膜-中层厚度(intima-media thickness of the posterior wall of the artery,IMT);将探头在中点采样,维持血流和声速小于60 度,测量大鼠血流动力学参数指标斑块面积(square,S)等。
1.3.3 HE 染色、油红O 染色检测各组大鼠AS 病理改变
超声检查完毕后,大鼠禁食12 h,麻醉处理并在显微镜下无菌剥离各组大鼠的全主动脉,剔除外膜的脂肪组织,80%的组织标本进行液氮封存,20%的组织标本,56℃水浴1 h,生理盐水冲洗10 min,10%甲醛溶液固定1 h,石蜡包埋10 min,切片,蒸馏水清洗3 次,依次进行HE、油红O 染色光镜下观察AS病变程度。
1.3.4 TUNEL 染色检测各组大鼠中动脉组织的细胞凋亡
取出10%各组组织标本,10%甲醛固定,二甲苯浸洗两次,梯度乙醇浸洗5 min,风干后3%双氧水-甲醇浸泡10 min,PBS 漂洗3 次,每次3 min,然后4℃预冷乙醇上进行如下操作:0.1% TritonX-100、0.1%缓冲液处理2 min,PBS 漂洗3 次,每次3 min,加入TUNNEL 反应混合液,加封口膜在暗湿盒中反应1 h,温度37℃,PBS 漂洗,梯度乙醇脱水,二甲苯透明,中性树脂封片,显微镜下观察。
1.3.5 免疫组化检测各组大鼠中动脉组织中IL-6、TNF-α 和 MMP-9 的表达
取出10%各组组织标本,常规方法固定,包埋,切片,脱蜡,修复,双氧水封闭,加入一抗,维持4℃孵育过夜,次日加入二抗,室温孵育30 min,清洗。加适量显色剂,苏木素复染,PBS 清洗,脱水,中性树胶封片,显微镜下观察并记录实验结果;染色评判标准以肿瘤细胞细胞膜和细胞质内出现黄色或棕黄色颗粒为阳性。
1.3.6 qRT-PCR 检测 miR-181b 和 Mex3B 蛋白的mRNA 的表达
取出10%各组组织标本,提取标本中细胞的总RNA,法测定RNA 浓度和检测RNA 完整性后[9],上RT-PCR 仪检测。 用 2-△△CT表示目的基因相对表达量;每个样本独立重复测量3 次,引物序列详见表1。
1.3.7 荧光素酶报告基因分析
取出10%各组组织标本,采用TRIzol 提取总RNA 并逆转录合成 cDNA,PCR 扩增 Mex3B 的 3’-非翻译区,并构建pGL3(pGL3-Mex3B-WT)载体,利用TaKaRa 技术在 pGL3(pGL3-Mex3B-WT)上 miR-181b 结合位点上构建(pGL3-Mex3B-MUT)载体,利用转染试剂Lipofectamine 2000 将报告载体、mimic control、miR-181b mimic 转染至人主动脉内皮细胞(human aortic endothelial cells, HAEC)中,转染成功48 h 后,用双重荧光素酶报告分析系统(dualluciferase reporter assay system)检测不同重组质粒的荧光活性从而评估启动子活性检测相对荧光素酶活性,报告基因活性为萤火虫荧光素酶/海肾荧光素酶活性值。
1.3.8 Western blot 检测各组标本中 Mex3B、IL-6、TNF-α 和 MMP-9 蛋白的表达
取出10%各组组织标本,采用常规方法提取目标蛋白 Mex3B、IL-6、TNF-α 和 MMP-9,经 BCA 试剂盒测定蛋白浓度后,准确量取50 μg,电泳结束后,将样品蛋白经湿转法转至PVDF 转膜上,加入10%脱脂奶粉封闭3 h,以(1 ∶1500)比例稀释后,维持4℃孵育过夜,洗涤加入二抗孵育3 h, 增强化学发光ELC 显色 30 min,经曝光、显影、定影后,以GAPDH 为内参来表示蛋白的表达水平。
1.4 统计学方法
本实验采用SPSS 16.0 软件进行数据统计分析,采用Graphpad 5.0 软件作图,两组间比较采用t检验,多组间比较采用方差分析,P<0.05 表示具有统计学意义。
2 结果
2.1 各组大鼠的颈动脉超声检测结果
各组大鼠颈动脉超声结果如图1 所示,与正常组相比,模型组大鼠颈动脉内膜增生明显,颈动脉IMT 明显增大,斑块S 明显增大;与模型组相比,实验组大鼠颈动脉内膜增生明显减小,颈动脉IMT 明显减小,斑块S 明显减小,差异均具有统计意义(P<0.05);模型组和对照组相比,差异无统计学意义(P>0.05)。
2.2 各组大鼠动脉病理改变检测结果
HE 染色结果如图2 所示,正常组动脉结构完整,胞核性状规则,内膜、中膜以及外膜界限清晰;模型组动脉管壁明显增厚,僵硬度增加,管腔内可见粥样或者纤维斑块,内膜可见白色条纹或者黄白色斑块;对照组动脉内膜细胞增厚明显,泡沫状的细胞大量填充;实验组动脉壁弹性明显恢复,内膜细胞性状较模型组明显好转,泡沫细胞的数量明显减少,管腔内脂斑沉积明显减少。
油红O 染色结果如图3 所示,正常组主动脉结构完整,未见斑块形成;模型组血管壁质地脆,弹性较差,主动脉内膜中可见大量破损的泡沫细胞,在动脉壁的中膜、内膜均产生明显的大小不等的AS斑块,管腔明显变窄小;对照组斑块脂质沉积明显,斑片状或点状的斑块向管腔凸起。 实验组的动脉壁斑块分布范围明显减小,内膜基本没有泡沫细胞,血管的弹性有所改善。
2.3 免疫组化检测各组大鼠AS 中斑块的稳定
MMP-9 是AS 的形成和维系斑块稳定性中起关键性调节作用的酶。 本研究中采用免疫组化和Western blot 法检测各组大鼠动脉中MMP-9 的表达情况,结果如图4 所示,与正常组相比,模型组大鼠MMP-9 的表达明显升高(P<0.05);与模型组相比,实验组大鼠动脉中MMP-9 的表达明显下降,差异均具有统计意义(P<0.05);模型组和对照组相比,差异无统计学意义(P>0.05)。 推断抑制miR-181b 的表达,能抑制 MMP-9 的表达,减小 AS 中斑块的形成。
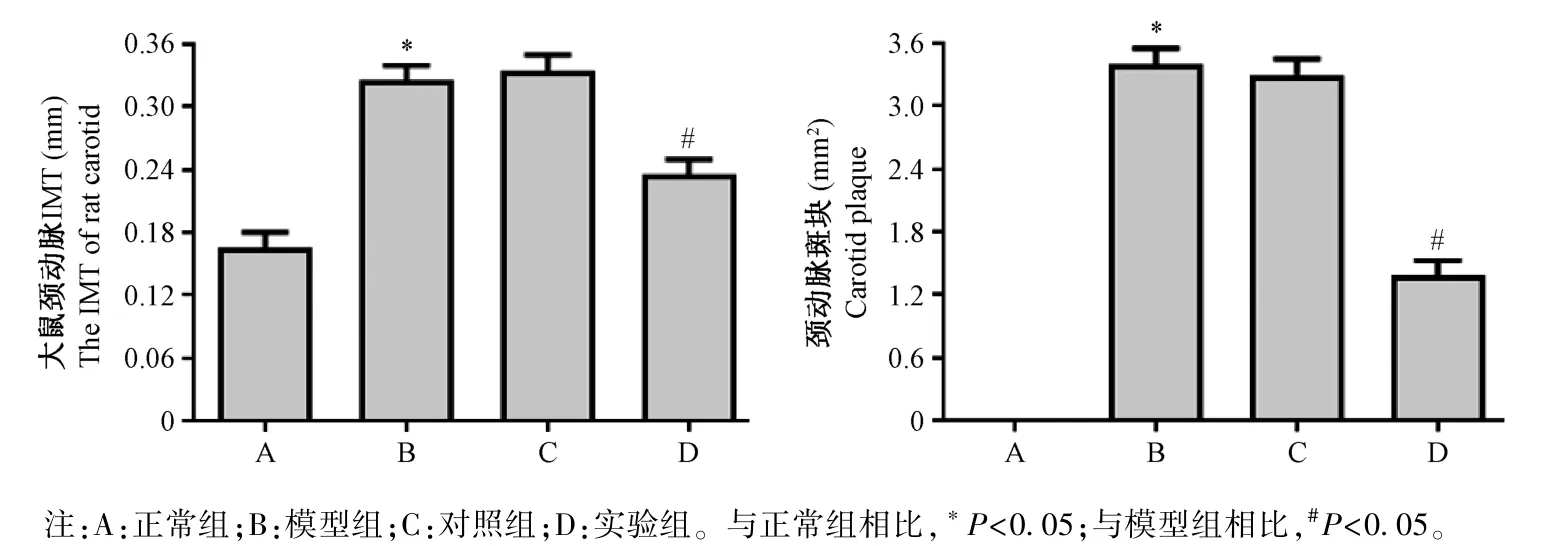
图1 各组大鼠颈动脉超声结果(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 1 Carotid ultrasound results of rats in each group
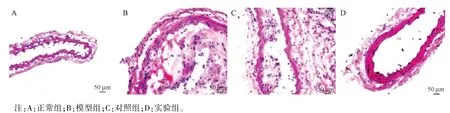
图2 HE 染色检测AS 病理改变(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Figure 2 HE staining to detect AS pathological changes
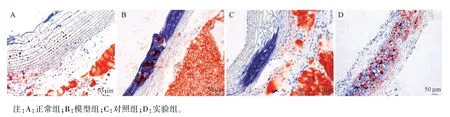
图3 油红O 染色检测各组大鼠动脉壁上的脂质沉积(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Figure 3 Oil red O staining to detect lipid deposition on the arterial wall of each group of rats

图4 免疫组化和Western blot 法检测各组大鼠动脉中MMP-9 的表达(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P <0.05.Compared with model group, #P<0.05.Figure 4 Detection the expression of MMP-9 in the arteries of rats in each group by immunohistochemistry and Western blot
2.4 TUNEL 染色检测各组大鼠动脉细胞的凋亡
TUNEL 染色结果如图5 所示,与正常组相比,模型组大鼠动脉上的细胞凋亡率明显上升(P<0.05);与模型组相比,实验组大鼠动脉上的细胞凋亡率明显下降,差异均具有统计意义(P<0.05);模型组和对照组相比,差异无统计学意义(P>0.05)。
2.5 各组大鼠动脉中 IL-6 和 TNF-α 的表达
IL-6 和TNF-α 作为在AS 中炎症反应的代表因子,本研究中采用免疫组化和Wetern blot 法检测各组大鼠动脉中IL-6 和TNF-α 的表达情况,结果如图6、图7 所示,与正常组相比,模型组大鼠 IL-6 和TNF-α 的表达明显升高,与模型组相比,实验组大鼠动脉中IL-6 和TNF-α 的表达明显下降,差异均具有统计意义(P<0.05),模型组和对照组相比,无明显差异,不具有统计学意义(P>0.05)。
2.6 Western blot 检测各组大鼠动脉中Mex3B 蛋白的表达
Western blot 法检测各组大鼠动脉中蛋白Mex3B 的表达水平如图8 所示:与正常组相比,模型组动脉中蛋白Mex3B 的表达明显升高(P<0.05),与模型组相比,实验组大鼠动脉中蛋白中Mex3B 的表达明显下降(P<0.05)。 模型组和对照组相比,无明显差异,不具有统计学意义(P>0.05)。
2.7 qRT-PCR 检测各组大鼠动脉中miR-181b 和Mex3B 蛋白的 mRNA 的表达
本研究中采用RT-PCR 检测各组大鼠动脉中miR-181b 和 Mex3B 的 mRNA 表达水平,如图 9 所示:与正常组比较,模型组 miR-181b 和 Mex3B 的mRNA 表达水平明显升高(P<0.05);转染 miR-181b-inhibitor 后,与模型组和对照组相比,实验组miR-181b 和Mex3B 的mRNA 表达水平明显降低(P<0.05);模型组和对照组相比,无明显差异,不具有统计学意义(P>0.05)。
2.8 荧光素酶报告基因分析结果
miR-181b 和Mex3B 蛋白的表达和mRNA 的变化趋势一致,通过生物信息网站(www.microrna.org)上查询miR-181b 和Mex3B 存在结合位点(如图10示)。 采用双荧光素酶报告基因分析来观察两者的关系结果如图 11 示,转染 miR-181b 后,野生型Mex3B 的荧光素酶活性被抑制(P<0.05),突变型Mex3B 的荧光素酶活性无明显变化(P>0.05),说明miR-181b 与Mex3B 具有靶向调控关系。
3 讨论
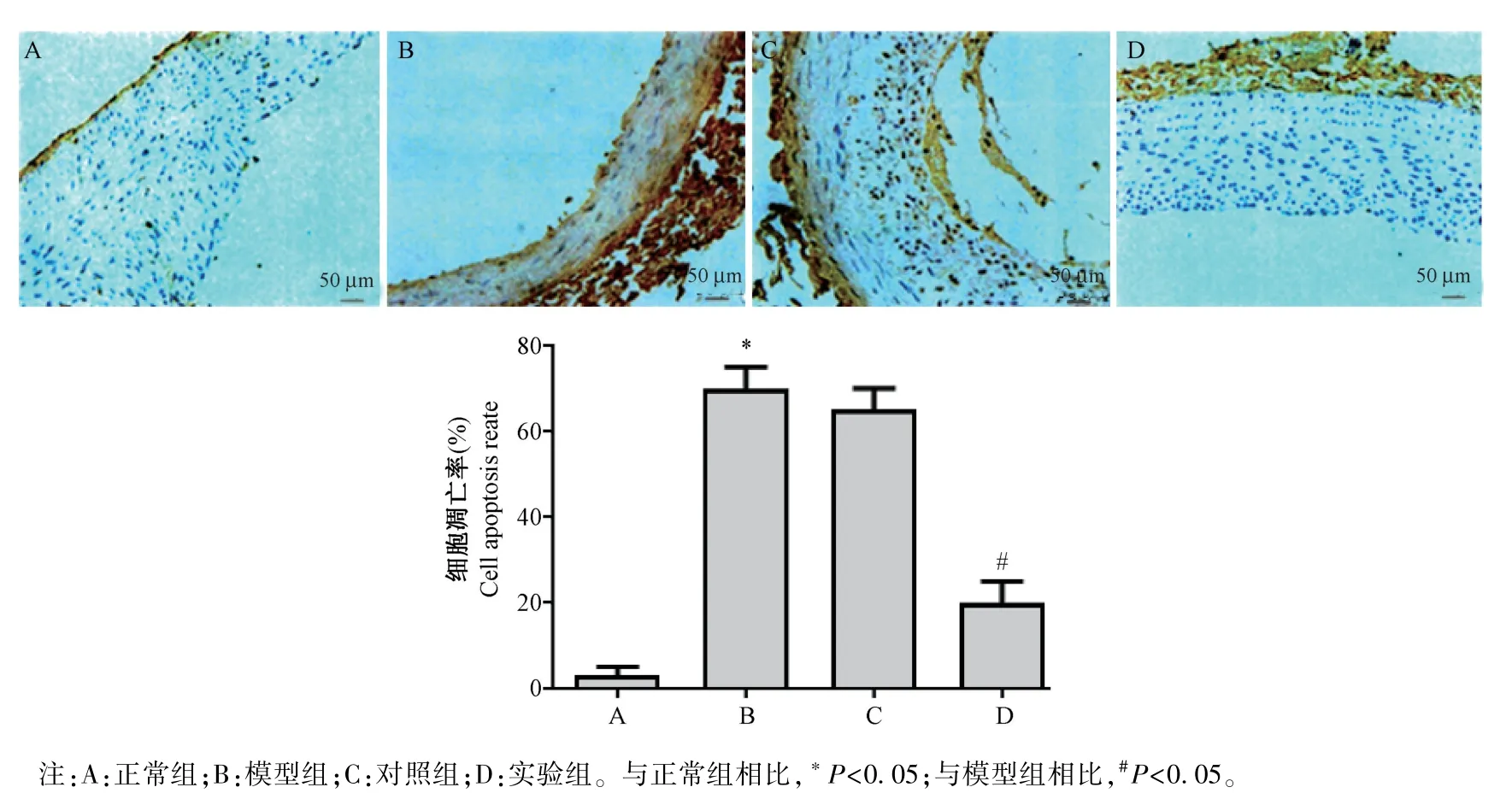
图5 TUNEL 染色检测各组细胞的凋亡(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 5 TUNEL staining to detect cell apoptosis in each group
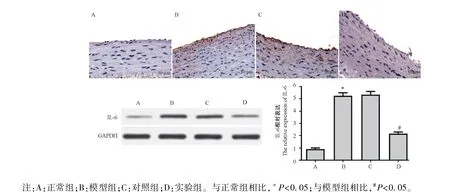
图6 免疫组化和Western blot 法检测各组大鼠动脉中IL-6 的表达(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 6 Detection the expression of IL-6 in the arteries of rats in each group by immunohistochemistry and Western blot

图7 免疫组化和Western blot 法检测各组大鼠动脉中TNF-α 的表达(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 7 Detection the expression of TNF-α in the arteries of rats in each group by immunohistochemistry and Western blot
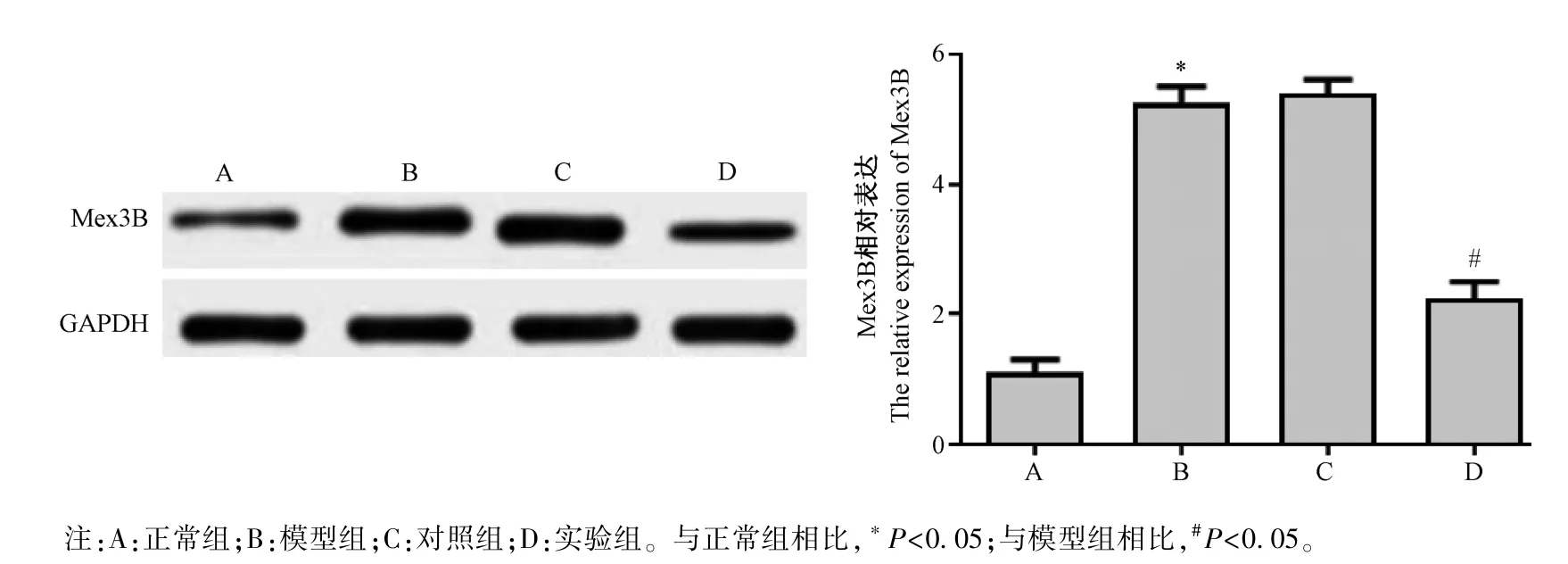
图8 各组大鼠动脉中Mex3B 蛋白的表达(n=10)Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 8 Protein expression of Mex3B in the arteries of each group of rats

图9 各组大鼠动脉中miR-181b 和Mex3B 的mRNA 表达水平Note.A, normal group.B, model group.C, control group.D, experimental group.Compared with normal group, *P<0.05.Compared with model group, #P<0.05.Figure 9 mRNA expression levels of miR-181b and Mex3B in the arteries of rats in each group

图10 生物信息网站预测miR-181b 和Mex3B 的关系Figure 10 Relationship between miR-181b and Mex3B predicted by bioinformatics websites

图11 双荧光素酶报告基因检测结果Figure 11 Detection results of the double luciferase reporter gene
AS 能通过引起动脉血管管腔狭窄、循环血流量减少等进而导致机体器官因供血不足而出现各种功能障碍。 因AS 而造成的易损斑块、血栓脱落当发生脑部位时极易诱发短暂性缺血性脑卒中危及患者生命[10]。 目前临床上主要通过改善患者的生活方式、调节患者血脂、血糖和血压缓解病程进展,但尚无根治性手段。 因此开展针对AS 的靶向治疗的研究在临床上具有重大研究意义。
目前,针对AS 的靶向治疗尚处于实验室研究阶段。 研究证实[11]miRNA 不仅在AS 中细胞增殖与凋亡、自噬与分化中扮演重要角色,miRNA 作为调控因子影响AS 的各个阶段,诸如动脉内皮细胞损伤与功能障碍、泡沫细胞形成与表型转换、脂质沉积和斑块形成等[12]。 Ma 等[13]研究证实miRNA-155 参与ApoE-/-小鼠颈动脉粥样硬化中的细胞自噬。 miR-181b 是miR-181 家族中与心血管疾病关系密切的成员。 研究表明[14]miR-181b 主要通过对血管炎症以及免疫反应的调控来参与AS 进程。 Di等[15]研究表明miR-181b 能调控基质金属蛋白酶组织抑制剂-3(tissue inhibitor of metalloproteinase-3,TIMP-3)的表达,影响AS 中微血管壁的稳定。 Sun等[16]研究报道miR-181b 参与调控ApoE-/-小鼠AS中由炎性诱导的细胞凋亡。 黄志勇等[17]研究证实抑制miR-181b 的表达能明显减轻ox-LDL 诱导的人脐静脉细胞炎症损伤。 本研究中转染miR-181binhibitor 后采用维生素D3 联合高脂饮食法构建动脉粥样硬化大鼠模型,结果表明抑制miR-181b 的表达能明显改善大鼠AS 病理症状,改善大鼠动脉的脂质沉积情况,降低动脉中MMP-9 的表达,缩小动脉中斑块的面积。
研究表明[18]动脉血管壁进展性、慢性的炎症反应是导致AS 累及全身动脉血管形成斑块的重要原因。 Zampino 等[19]报道内毒素诱导的炎性反应更容易导致动脉血管发生AS 斑块病变。 Yang 等[20]研究表明降低炎性因子的表达有助于改善AS 动物模型的症状。 Gong 等[21]研究证实抑制AS 中炎性的发展能明显改善AS 的斑块的病变面积,促进斑块的消退。 纪利利等[22]临床研究结果表明抑制炎性反应能明显降低颈动脉粥样硬化患者发生脑梗死的风险。 而MEX3B基因是四种人类同源MEX3 基因的一种。 最新研究表明[23]Mex3B 蛋白是新近发现的细胞质小体的组成部分,与炎性因子的mRNA转录、降解等生理过程密切相关。 He 等[24]研究表明在食管癌中,miR-181b 能够与Mex3B 特异性结影响癌细胞 DNA 的复制以及细胞增殖。 Moududee等[25]研究指出Mex3B 蛋白中环指结构域是泛素E3连接酶的特征结构域,Mex3B 蛋白能通过泛素化作用参与细胞的炎性应激。 Sun 等[26]研究指出miR-181b 影响泛素E3 连接酶的表达降低动脉粥样硬化中血管内皮中炎性因子的表达。 本研究中RT-PCR和Western blot 结果表明在AS 模型组中 Mex3B 的mRNA 和蛋白的表达升高,炎性因子IL-6 和TNF-α大量表达,AS 损伤明显。 通过生物信息网站预测miR-181b 和Mex3B 存在靶向结合位点,荧光素酶报告基因分析证实 miR-181b 靶向调控 Mex3B 的表达,Western blot 法结果表明抑制miR-181b 的表达后,Mex3B 的表达明显下降,炎性因子表达下调。推断说明miR-181b 通过靶向调控Mex3B 的表达参与AS 中炎性应激,来抑制由炎性导致的AS 斑块病变。
综合上述,miR-181b 通过靶向调控Mex3B 的表达参与动脉粥样硬化中的炎性应激,抑制miR-181b的表达能明显抑制炎症反应,减小动脉粥样硬化中斑块的形成。 但如何将miR-181b 的靶向作用应用到临床对动脉粥样硬化的治疗中还需进一步的研究。

