1,25(OH)2D3对高糖诱导的人肾小球系膜细胞株增殖能力、周期分布影响及其机制
王丽媛,唐小铁,戚婷,于洋,崔学彬,徐洁
1武汉科技大学医学院,武汉 430000;2武汉科技大学附属普仁医院
文献[1]报道,我国慢性肾脏病(CKD)患病率较高,肾小球滤过率<60 mL/(min·1.73 m2)的人群中糖尿病(DM)患者占19.1%,蛋白尿人群中DM患者占17.3%[2],DM已经成为CKD的首要病因。糖尿病肾病(DN)作为DM最常见的微血管并发症之一,患病人数占DM总数的20%~40%[3]。研究[4]表明,DN、系膜增生性肾小球肾炎等多种CKD均能导致系膜细胞(Mc)过度增殖、系膜外基质大量沉积、肾脏正常生理结构破坏,最终发展为肾小球硬化(GS)、肾功能衰竭。当前DM患者基数巨大,DN发病率高,然而对于DN的治疗方式单一,以控制血糖血脂血压等高危因素、避免肾毒性食物药物、延缓肾功能恶化为主,尚缺乏特异性治疗药物。肾小球系膜细胞是肾小球最主要的固有细胞之一,对维护肾小球毛细血管床结构完整性、维持系膜基质代谢平衡、保护肾脏正常免疫功能有重要的作用。肾小球系膜细胞的过度增殖可导致肾脏系膜区增生、系膜外基质异常积蓄,这几乎是所有CKD存在的病理特性,同样也是DN发病的中心环节。因此,设法调控肾小球系膜细胞的增殖活性,有助于改善肾脏病理损伤、延缓DN的发生及演变[5]。1,25二羟基维生素D3[1,25(OH)2D3]是最具生物活性的维生素D,不仅具有调节钙磷代谢作用,还具有调节机体免疫、抑制细胞增殖、促进细胞凋亡、诱导细胞分化等多种生物学效应[6]。2017年12月~2018年6月,我们观察了1,25(OH)2D3对高糖诱导的人肾小球系膜细胞株增殖能力、周期分布影响,并探讨其可能机制。
1 材料与方法
1.1 细胞株及主要试剂 人肾小球系膜细胞株(上海拜力生物人肾小球系膜细胞供应商)。磷酸盐缓冲液(PBS),低糖DMEM粉剂,无支原体胎牛血清,0.25%胰蛋白酶,碘化丙啶,1,25(OH)2D3,D-葡萄糖,甘露醇,LY294002,CCK-8试剂盒,兔抗人mTOR单克隆抗体,小鼠抗人p-mTOR单克隆抗体,山羊抗小鼠二抗,兔抗人Akt单克隆抗体,山羊抗兔二抗,兔抗人p-Akt单克隆抗体。
1.2 人肾小球系膜细胞培养 复苏后的人肾小球系膜细胞接种于盛有低糖DMEM完全培养液的无菌培养瓶中,细胞在瓶内呈贴壁生长。将培养瓶置于37 ℃、5%CO2、饱和湿度环境下,当细胞生长至70%~80%融合时放弃原有培养液,先用PBS工作液轻柔地洗涤2次,再添加0.25%胰蛋白酶消化传代,之后将培养瓶放置在37 ℃、5%CO2、饱和湿度环境下继续培养,取第3~8代用于实验。向生长良好的对数期人肾小球系膜细胞中添加0.25%的胰蛋白酶进行消化处理。处理完成后统计数目并接种于培养板中,待观察到细胞全部贴壁后,放弃原有培养基,加入无血清DMEM进行同步化处理24 h。
1.3 1,25(OH)2D3干预后人肾小球系膜细胞增殖抑制率测算 采用CCK-8试剂盒。取生长良好的对数期人肾小球系膜细胞,以1×104个/mL接种于96孔板内,200 μL/孔,培养至细胞贴壁后,用无血清DMEM同步化24 h。按照实验设计将细胞分为6组,干预组加入30 mmol/L的D-葡萄糖和10-8mol/L的1,25(OH)2D3,1,25(OH)2D3组加入10-8mol/L的1,25(OH)2D3[7],高糖组加入30 mmol/L的D-葡萄糖[8],高渗组加入25 mmol/L的甘露醇,LY294002组加入2 μg/mL的LY294002,正常对照组未加任何刺激物,各组继续培养48 h。各组结束干预前4 h每孔分别加入10 μL的CCK-8溶液,继续培养4 h,用酶标仪测定各孔在450 nm波长处的吸光度值(A450),以上实验重复3次,每次均设置无细胞组作为空白调零组,实验结束后计算细胞增殖抑制率,细胞增殖抑制率=(A对照组-A实验组)/A对照组×100%。
1.4 1,25(OH)2D3干预后人肾小球系膜细胞周期分布观察 采用流式细胞术。取生长良好的对数期人肾小球系膜细胞,以2×105个/mL接种于6孔板内,2 mL/孔,培养至细胞贴壁后,无血清DMEM同步化24 h,实验分组及干预同“1.3”,各组继续培养48 h,48 h后收集细胞,用预先冻存的70%冰乙醇重悬细胞,吹打混匀,-20 ℃固定过夜。过夜后离心去除乙醇,PBS洗涤一遍,再用PBS重悬细胞,加入RNAseA(终浓度10 μg/ μL)及碘化丙啶染液(终浓度50 μg/ mL),37 ℃避光保存40 min,上机检测。以上实验重复3次,每次试验每个实验组均设置4个复孔。测得数据按以下公式计算系膜细胞增殖指数,系膜细胞增殖指数=S期和G2/M期细胞比例之和/(G1期、S期和G2/M期细胞比例之和)。
1.5 1,25(OH)2D3干预后人肾小球系膜细胞Akt、p-Akt、mTOR、p-mTOR蛋白检测 实验分组及干预同“1.3”将各组细胞裂解后,高速离心25 min,后取上清,按BCA试剂盒说明书进行配平,加入合适比例的Loading Buffer后煮沸8 min使蛋白质变性,依次经过上样电泳,PVDF转模,5%奶粉封闭,PVDF置于一抗孵育,TBST洗涤6×5 min,二抗室温孵育2 h,滴加ECL发光试剂,X线片曝光,冲洗和扫描后,采用Gelpro软件比较各组条带的相对灰度值即可表示蛋白的相对表达量。

2 结果
2.1 各组细胞A450及增殖抑制率比较 细胞A450及增殖抑制率见表1。

表1 各组细胞A450及增殖抑制率比较
2.2 各组细胞G1期、S期、G2/M期个数及Mc细胞增殖指数比较 各组细胞G1期、S期、G2/M期个数及Mc细胞增殖指数比较见表2。
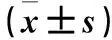
表2 各组G1期、S期、G2/M期占比及Mc细胞增殖指数比较
2.3 各组细胞Ap-Akt/Akt、p-mTOR/mTOR蛋白相对表达量比值比较 各组细胞p-Akt/Akt、p-mTOR/mTOR蛋白相对表达量比值比较见表3。
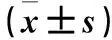
表3 各组细胞p-Akt/Akt、p-mTOR/mTOR比较
3 讨论
肾小球系膜细胞是肾小球最主要的固有细胞之一,对于肾脏的正常生理活动具有重要意义。研究[9]证实,肾小球系膜细胞的增殖及层黏蛋白、Ⅳ型胶原在系膜基质的集聚是DN的病理性特征。体外细胞实验发现,暴露于高糖环境中会使肾小球系膜细胞加速增殖,并大量分泌各种细胞因子、胶原蛋白及其他细胞外基质。动物实验发现,STZ诱导构建的DN小鼠模型尿白蛋白排泄水平较正常组明显升高,而且模型组小鼠肾脏病检提示肾脏的系膜区扩大、纤连蛋白表达增多[10]。临床观察也证实,5~7年病程的DM患者行肾脏病检即能发现肾小球Mc增殖和肾小球肥大[11]。大量研究均证实,高糖可促进人肾小球系膜细胞的增殖,刺激多种促生长、促增殖的细胞内信号因子产生增多,诱导氧化应激反应,导致系膜细胞的过度增殖、系膜外基质的病理集聚,最终使肾小球正常结构被破坏,致肾功能衰竭。因此采取干预措施抑制高糖对肾小球系膜的促增殖作用,对于保护肾脏功能,延缓DN的进展具有至关重要的作用。
1,25(OH)2D3是生物活性最强的维生素D,通过遍布全身各处的VitD受体施展生物效应。除了被大众熟知的调节钙磷代谢的作用外,目前1,25(OH)2D3在免疫调节、细胞增殖分化、抗肿瘤、抗衰老等众多领域也被广泛应用。1,25(OH)2D3可通过Runx2的过表达促进成骨细胞向脂肪细胞的转分化[12];通过下调Toll样受体4介导的炎症通路减轻DM大鼠肝脏损伤[13];通过PI3K/Akt/mTOR通路对神经起保护作用[14]。一项为期3年纳入530例T2DM患者的前瞻性研究结果提示,合并VitD缺乏的T2DM患者DN发生率明显高于VitD含量正常的T2DM患者,且这一结果相对独立,不受高血压、高脂血症、吸烟、ACEI/ARB类药物使用史等外围因素的干扰。范乐平等[15]发现,T2DM人群体内血清活性VitD含量随尿蛋白程度的上升而下降,与血肌酐、尿素氮等反映肾功能的指标呈负相关。多项研究已经证实,VitD缺乏是DN的独立危险因素,其在从DM、到DN、ESRD的疾病演变过程中发挥重要作用,因此足量的1,25(OH)2D3具有肾脏保护效应。动物实验发现,1,25(OH)2D3作用于5/6肾切除动物模型,可抑制肾小球细胞增生,延缓GS[16];作用于DN大鼠模型,可降低尿白蛋白排泄,抑制肾小球系膜增殖[17]。胡婧等[18]发现,给予骨化三醇治疗组尿蛋白排泄率、24 h尿蛋白量、血肌酐、白介素-6水平均低于安慰剂组,提示骨化三醇有助于DN患者减轻蛋白尿、缓解炎性反应状态。本研究显示,1,25(OH)2D3能够有效对抗高糖介导的肾小球系膜细胞增殖。
文献[19]报道,PI3K/Akt/mTOR通路是蛋白质合成的主要信号调节通路。各种生长因子、胰岛素受体及外界刺激等作用可使PI3K激活,活化的PI3K生成PIP3进一步激活AKT,PIP3含有与AKT相同的PH结构域,两者相互识别并结合,将AKT由胞浆转位至胞膜,同时使AKT的构象发生变化,进而AKT被磷酸化,活化的AKT直接激活mTORC1或通过TSC1/2复合物进一步激活其下游分子MtorC1,从而实现对细胞增殖的调控[20]。Rane等[21]发现,PI3K/Akt/mTOR通路参与了高糖诱导的肾小管上皮细胞凋亡。邢玲玲等[22]认为,高糖可能通过激活该通路诱导足细胞分泌Ⅳ型胶原。实验证实,高糖可活化PI3K、诱导mTOR上调,促进系膜细胞的肥大增殖[23]。本文结果显示,给予高糖处理后p-Akt、p-mTOR的表达明显增多,系膜细胞增殖加速。临床研究[24~26]表明,利拉鲁肽可上调PI3K/Akt通路改善高糖诱导的内皮细胞凋亡,番茄红素能通过PI3K/Akt通路改善高糖诱导的足细胞损伤,非洛贝特、乌索酸通过抑制PI3K/Akt/mTOR通路活化而抑制高糖诱导的系膜细胞增殖,雷帕霉素可明显抑制高糖诱导的系膜细胞增殖。本研究显示,与高糖组比较,1,25(OH)2D3干预组p-Akt/Akt、p-mTOR/mTOR相对表达量比值降低,表明1,25(OH)2D3对抗高糖介导的系膜细胞增殖的作用可能与下调PI3K/Akt/mTOR信号通路相关。
总之,1,25(OH)2D3可抑制高糖诱导的人肾小球系膜细胞的增殖活化,并将细胞阻滞于G1/S期,作用机制可能与其可下调PI3K/Akt/mTOR通路的表达有关。

