转化生长因子β相关激酶1抑制剂对人肝癌细胞系HepG2脂滴积累的影响及其机制
王坤,陈奥,马石楠,3
1湖北医药学院,湖北十堰 442000;2武汉科技大学;3十堰市太和医院
肝脏是脂质代谢的重要场所,如果代谢出现问题会导致肝内脂肪细胞堆积。脂肪肝是一种慢性肝脏疾病,以脂滴在肝细胞中的异常累积为特征,可发展为脂肪性肝炎、肝纤维化和肝硬化,甚至演变为肝癌。转化生长因子β相关激酶1(TAK1)是一种蛋白激酶,除在炎症免疫反应中发挥重要作用[1],也参与细胞增殖、分化、生存的调控[2]。有研究[3]指出,在小鼠脂肪细胞中特异敲除TAK1可以有效减少肥胖的发生。TAK1在脂质细胞代谢方面发挥重要作用,然而其具体调控机制尚不清楚。过氧化物酶体增殖物激活受体γ(PPARγ)是PPAR亚型,抑制PPARγ可以减轻由饮食所诱导的肥胖和糖尿病[4],PPARγ在脂肪肝以及肝脏变性中发挥重要作用。研究[5~7]显示,诱导细胞凋亡DNA分裂因子样效应因子C(CIDEC)在促进甘油三酯积累、调控脂滴融合、抑制甘油三酯分解方面发挥重要作用。文献[8]报道,敲减TAK1能够减少3T3L-1前脂肪细胞的脂肪分化,而PPARγ是脂肪细胞分化过程的关键转录因子。因此,在HepG2细胞脂滴积累的过程中,TAK1很可能通过PPARγ影响肝细胞的脂滴积累。TAK1抑制剂(NG25)是一种合成的Ⅱ型TAK1抑制剂,可有效抑制TAK1活性[9~11]。靶向TAK1作为一种提高肿瘤治疗效果的策略,已经在几种恶性肿瘤中进行了研究,但目前关于NG25对脂滴积累的作用以及其对肝癌潜在治疗作用鲜有报道。2018年10月~2019年11月,我们观察了NG25对人肝癌细胞系HepG2脂滴积累的影响,并探讨其作用机制。
1 材料与方法
1.1 细胞及主要试剂 HepG2细胞、人胚肾细胞系HEK-293T购自美国模式培养物集存库(ATCC)。PPARγ、GAPDH、CIDEC抗体购自美国Abcam公司,NG25 trihydrochloride购自美国Sigma公司。
1.2 NG25处理的HepG2细胞油红O染色红光强度观察 取HepG2细胞,用含有10%胎牛血清的DMEM高糖培养基培养在37 ℃、5%CO2环境中。将细胞分为处理组和对照组,处理组细胞加入2 μmol/L NG25处理24 h,对照组加入等体积DMSO处理24 h,两组均同时用终浓度为250 μmol/L脂肪酸(OA、PA各125 μmol/L)共同孵育。采用油红O染色检测细胞内脂滴积累情况:0.5 g干粉溶解到100 mL异丙醇中,37 ℃温育溶解配制成油红O原液,油红O原液与ddH2O以3∶2混合,混合过滤染液静置10 min后。细胞用预冷的PBS洗3次,每次5 min,再使用4%多聚甲酸固定30 min,随后用混合过滤染液染色10~15 min,PBS洗3次之后可进行DAPI复染后明胶固定,最后用预冷PBS洗3次并进行封片。显微镜下进行观察采图,图像用Image J软件分析,以单位面积内的红色光强度表示细胞内脂质积累。
1.3 NG25处理的HepG2细胞PPARγ mRNA、蛋白及PPARγ启动子转录活性检测 细胞培养、分组和干预方法同“1.2”。①PPARγ mRNA:取对数期生长的的HepG2细胞,吸去培养基,24孔板每孔加入600 μL的TRIzol试剂,室温静置5 min,转移至离心管中,加入0.2倍体积的氯仿(4 ℃预冷),用力振摇15 s,静置5 min,4 ℃环境下以12 000 r/min速度离心15 min,转移上清至新离心管中,加入等体积的异丙醇(4 ℃预冷),颠倒混匀,静置10 min,4 ℃环境下以12 000 r/min速度离心15 min,弃上清,沉淀用500 μL的75%乙醇(4 ℃预冷)清洗,4 ℃环境下以8 000 r/min的速度离心5 min,弃上清,沉淀自然晾干,用适量DEPC水溶解,-80 ℃保存,用M-MLV逆转录酶和T18将提取的RNA反转录成cDNA。采用AlleleID 7软件与Primer Premier 5软件设计定量PCR引物,分别为GAPDH正向引物5′-TGGACCTGACCTGCCGTCTAG-3′,反向引物5′-GTGGGTGTCGCTGTTGAAGTC-3′,PPARγ正向引物5′-CATTCTGGCCCACCAACTTTGG-3′,反向引物5′-TGGAGATGCAGGCTCCACTTTG-3′。定量PCR引物,cDNA模板和SYBR Green mix(Takara)共同配制20 μL反应体系在CFX96定量仪器(Bio-Rad)中进行扩增,反应结束后,得出各组样品的Ct值,以GAPDH为内参,利用2-ΔΔCt法计算目的基因的相对表达量,每组重复3次,取平均值。②PPARγ蛋白:贴壁的HepG2细胞收取蛋白样品时,弃去培养基,PBS清洗1次,加入1 mL蛋白裂解液,冰浴15 min,4 ℃环境下以12 000 g/min的速度离心15 min后取上清备用。用BCA法测定蛋白浓度,并将蛋白浓度调整一致后再与含有溴酚蓝的上样缓冲液充分混合后在100 ℃沸水中煮5 min使蛋白变性。按萨姆布鲁克方法配制8%分离胶和5%浓缩胶。在电泳装置加入适量SDS电泳缓冲液,在加样孔中加入处理好的蛋白样品,每孔上样20 μL。接通电源,电压调至80 V,待溴酚蓝指示剂跑到分离胶底部时断电,结束电泳。取SDS-PAGE电泳后的凝胶,用转印装置将蛋白带转印到PVDF膜上,在低温环境下,100 V电压转膜1 h。将膜置于5%的BSA封闭液中封闭8 h,弃去封闭液后,用TBST洗涤3次,每次5 min,加入适当稀释的一抗溶液,4 ℃孵育超过8 h,弃去一抗,TBST洗涤3次,每次5 min,加入适当稀释的二抗溶液,37 ℃孵育1 h,弃去二抗,TBST洗涤3次,每次5 min。加入配制好的化学发光液滴于膜上,待充分反应后,用成像系统采图,用Image J软件分析各组蛋白条带的灰度值,以目的蛋白与内参GAPDH蛋白灰度值的比值作为目的蛋白相对表达量。③PPARγ启动子荧光素酶活性:取HEK-293T细胞,用含有10%胎牛血清的DMEM高糖培养基培养于37 ℃、5%CO2环境中。将PPARγ的启动子(2200/ 1)片段构建到pGL3-Basic质粒上,将HEK-293T细胞接种于24孔板中培养,每孔加入500 μL细胞生长培养基,待细胞密度达到80%~90%时,进行细胞转染:将1 μg 该重组质粒与1 μL脂质体分别溶于50 μL Opti-DMEM培养基中,混匀后室温静置5 min;将脂质体与质粒轻柔吹打混匀,总体积为100 μL,室温静置20 min;将孔板中细胞用DMEM无血清培养基清洗,然后加入100 μL质粒—脂质体复合物,并加入400 μL的Opti-DMEM培养基,培养于37 ℃、5%CO2环境下;转染6 h后,更换成细胞生长培养基。将实验分为2组,分组和干预方法同“1.2”。荧光素酶活性检测:HEK-293T细胞弃去培养基,用1×PBS清洗细胞,24孔板的每孔加入80 μL的1×Passive Lysis Buffer,用细胞刮铲刮下细胞,冰上静置30 min。收集样品至1.5 mL离心管中,以3 000 r/min速度离心5 min,转移上清至新离心管中。配制Luciferase Assay BufferⅡ与Stop&Glo试剂,避光放置。取10 μL细胞裂解样品置于新离心管中,加入40 μL Luciferase Assay BufferⅡ,轻柔混匀,放入荧光光度计中,反应时间为5 s,检测荧光素酶活性,记录数据,该数据为萤火虫荧光素酶的活性;将离心管取出,加入40 μL Stop&Glo试剂,轻柔混匀,放入荧光光度计中,反应时间为5 s,检测荧光素酶活性,记录数据,该数据为海肾荧光素酶的活性。将测得的萤火虫荧光素酶的活性值与相应的海肾荧光素酶的活性值的比值作为荧光素酶的相对表达活力。
1.4 NG25处理的HepG2细胞CIDEC mRNA、蛋白检测 HepG2细胞培养、分组和干预方法同“1.2”。CIDEC mRNA检测方法同“1.3中的①”,CIDEC正向引物5′-GCAAGCTGCTCAGGAATAAAG-3′,反向引物5′-GCTGGAGGGCTCAAAATGGT-3′。CIDEC蛋白检测方法同“1.3中的②”。
1.5 超表达PPARγ的HepG2细胞CIDEC mRNA、蛋白检测 HepG2细胞培养同“1.2”。实验共分为3组。恢复组:HepG2细胞预先转染1 μg质粒PPARγ后再加入2 μmol/L NG25处理24 h,转染步骤见“1.3中的③”;处理组:HepG2细胞加入2 μmol/L NG25处理24 h;对照组:HepG2细胞加入等体积DMSO处理24 h。3组均同时用终浓度250 μmol/L脂肪酸(OA、PA各125 μmol/L)共同孵育。CIDEC mRNA相对表达量的检测方法同“1.3中的①”,CIDEC蛋白相对表达量的检测方法同“1.3中的②”。

2 结果
2.1 处理组和对照组油红O染色红光强度比较 处理组及对照组油红O染色红光强度分别为154±10、202±12,两组比较,P<0.05。
2.2 处理组和对照组PPARγ mRNA、蛋白相对表达量及PPARγ启动子荧光素酶活性比较 处理组和对照组PPARγ mRNA、蛋白相对表达量及PPARγ启动子荧光素酶活性比较见表1。
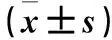
表1 处理组和对照组PPARγ mRNA、蛋白相对表达量及PPARγ启动子荧光素酶活性比较
2.3 处理组和对照组CIDEC mRNA、蛋白相对表达量比较 处理组和对照组CIDEC mRNA、蛋白相对表达量比较见表2。
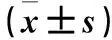
表2 处理组和对照组CIDEC mRNA、蛋白相对表达量比较
2.4 恢复组、处理组、对照组CIDEC mRNA和蛋白相对表达量比较 恢复组、处理组、对照组CIDEC mRNA和蛋白相对表达量比见表3。
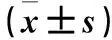
表3 恢复组、处理组、对照组CIDEC mRNA和蛋白相对表达量比较
3 讨论
脂滴是细胞内中性脂的主要贮存场所,脂滴异常积累引起会肥胖、脂肪肝、心血管疾病、糖尿病、中性脂贮存性疾病等诸多代谢病变,而非酒精性脂肪肝是其中最为常见的一种。目前,非酒精性脂肪肝的治疗手段主要是控制饮食,控制体质量和增加运动。非酒精性脂肪肝病开始于肝脏甘油三酯的过度积累,而且非酒精性脂肪肝病患者肝脏通过募集并活化巨噬细胞分泌IL1β、IL18、IL12、TNF-α和CCL2、CCL5等炎症因子,导致肝脏炎症和纤维化的发生,从而进一步促进肝癌的形成[12]。研究显示,TAK1在脂肪肝和脂肪肝炎的发展中发挥着重要作用。文献[13]报道,E3连接酶TRIM8可以通过引起TAK1的泛素化,进而促进TAK1的磷酸化,从而促进由高脂饮食诱导产生的脂肪肝以及脂肪肝炎。TAK1的激活可以显著的促进非酒精性脂肪肝的发生和发展[14]。基于以上研究成果,我们推测通过抑制TAK1的活性可以抑制脂滴的积累,从而起到阻遏肝病的作用。
NG25是一种新型的TAK1抑制剂,可以有效抑制TAK1活性。研究[15,16]表明,NG25可作为乳腺癌、结肠癌等恶性肿瘤的潜在治疗策略,但关于NG25对脂滴积累和对肝癌等相关疾病的治疗效果的作用还没有相关报道。本研究为了探索NG25对HepG2细胞中脂滴积累的影响,我们将处理组和对照组细胞用油红O进行染色,并在显微镜下观察,结果显示NG25能够显著降低细胞中的脂滴积累,提示NG25对HepG2细胞脂滴积累有抑制作用。
据报道,肥胖小鼠PPARγ表达量显著上调[17],而ob/ob小鼠中特异的抑制PPARγ的表达可以改善脂肪肝[18]。CIDEC定位于脂滴表面,其能够通过促进单室大脂滴形成增加脂滴积累[19]。为了研究NG25在HepG2细胞中是否通过PPARγ和CIDEC来影响肝细胞的脂滴积累,我们检测了细胞PPARγ和CIDEC mRNA、蛋白,结果显示与对照组相比,处理组细胞PPARγ和CIDEC mRNA、蛋白相对表达量均下调,且通过抑制TAK1的活性能够降低PPARγ启动子的转录活性。有研究表明,在3T3L-1细胞中PPARγ能够作为一个转录因子促进CIDEC启动子的转录,而我们前期数据显示抑制TAK1活性能同时下调PPARγ和CIDEC的表达,我们推测在HepG2细胞中TAK1抑制剂可能通过PPARγ调控CIDEC的表达。为进一步验证这一推测,我们收集3组细胞RNA和蛋白进行检测,结果显示超表达PPARγ能够有效的逆转由NG25处理引起的CIDEC的基因和蛋白水平的下调。这表明在HepG2细胞中,NG25通过PPARγ调控CIDEC的表达,进而调节肝脂积累,即NG25调节肝脏脂滴积累的分子机制是NG25通过PPARγ-CIDEC信号通路来抑制肝脏脂滴的积累。
总之,NG25对HepG2细胞脂滴积累有抑制作用,机制可能是抑制PPARγ的转录,进而下调CIDEC表达,即通过PPARγ-CIDEC信号途径最终抑制HepG2细胞脂滴积累。

