37 家实验室新型冠状病毒核酸检测室间质评结果分析
姜青龙,曾黎峰,李胜远,王征勇,李蓉
(1.江西省临床检验中心,江西 南昌330006; 2.江西省人民医院检验科,江西 南昌330006)
为加强江西省新型冠状病毒(2019 novel coronavirus,2019-nCoV)核酸检测的质量管理,验证各实验室的检测能力,保证检测结果的准确性和可比性, 对37 家临床基因检测实验室进行一次2019-nCoV 核酸检测室间质评活动。
1 材料与方法
1.1 标本来源 广州邦德盛生物科技有限公司(江西万点生物技术有限公司惠赠),每家实验室发放5个批号,即:202011,202012,202013,202014,202015;所有质控物为假病毒,均冷链运输(江西乐成生物科技有限公司惠赠)至各实验室。
1.2 仪器与试剂 仪器:ABI 系列,DA7600,line-Gene,SLAN; 试剂: 中山大学达安基因股份有限公司,上海复星医学科技发展有限公司,上海伯杰生物科技有限公司,湖南圣湘生物科技有限公司。
1.3 检测方法 37 家临床实验室采用临床基因扩增实时荧光定量法进行检测。
1.4 统计方法 采用厂家提供靶值,PT 方案评定。
2 结果
质控物分发给37 家实验室, 结果回报37 家,回报率100.0%。 2019-nCoV 核酸检测室间质评各批号质控物靶值及实验室PT 成绩合格率见表1。2019-nCoV 结果Ct 值统计情况分别见表2 及表3。
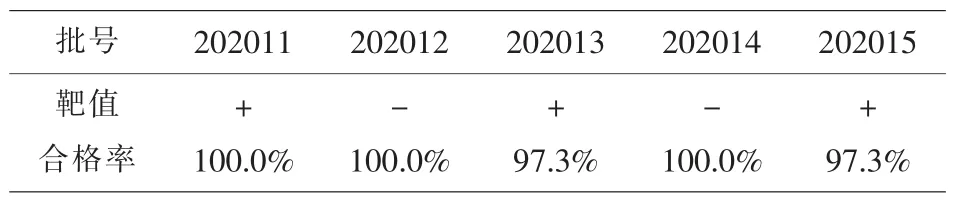
表1 各批号质控物靶值及PT 成绩合格率

表2 2019-nCoV ORFlab 基因Ct 值概况
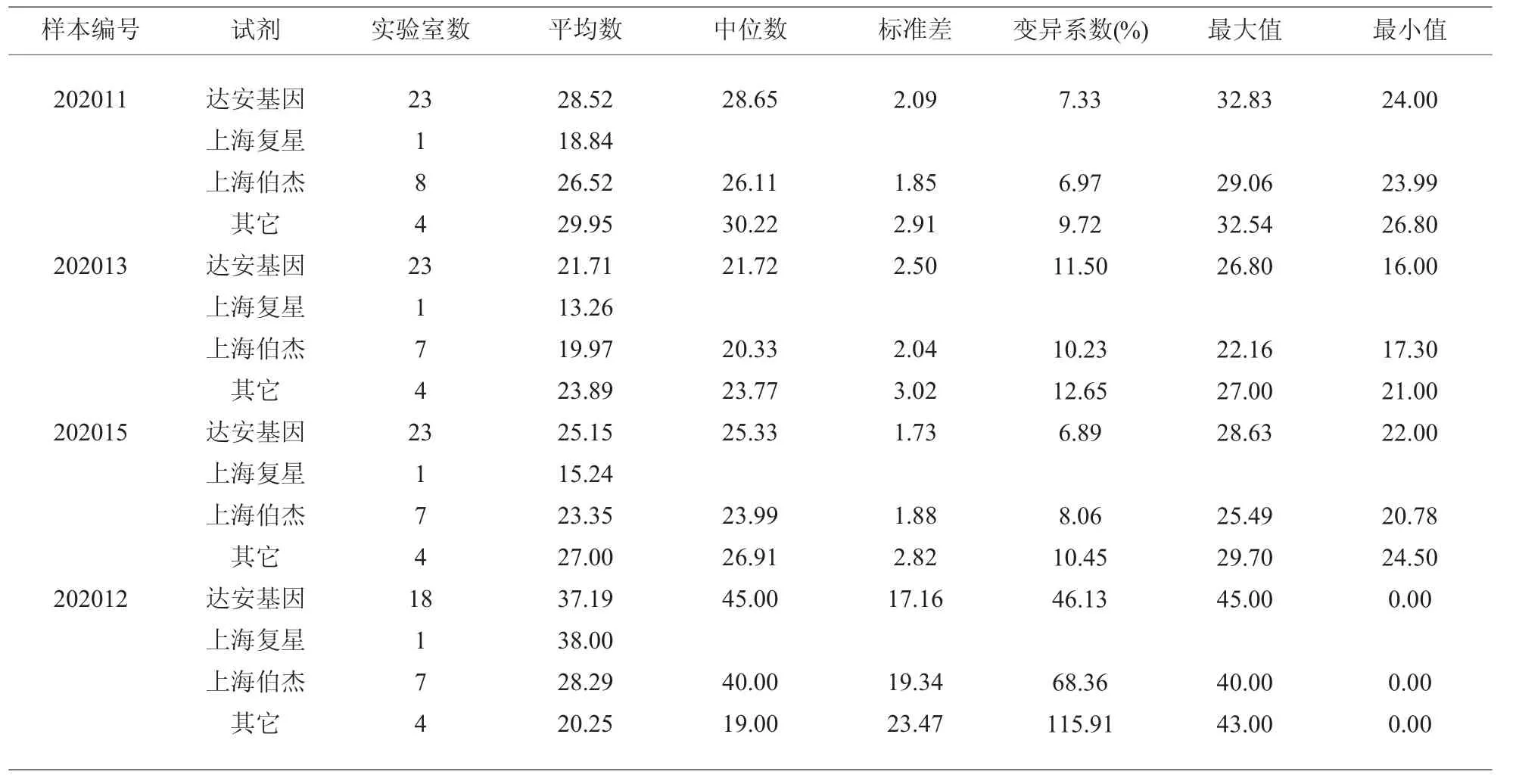
表3 2019-nCoV N 基因Ct 值概况
3 讨论
新型冠状病毒肺炎(Corona Virus Disease 201 9,COVID-19)是SARS-CoV-2 感染导致的肺炎。 主要的传播途径是呼吸道飞沫传播和接触传播。2019-nCoV 属套式病毒目,冠状病毒科,β 冠状病毒属[1]。 基因组有30kb 序列,与真核细胞mRNA 结构非常相似[2]。 当前获批的核酸检测产品普遍采用实时荧光定量PCR 法, 检测靶标涉及SARS-CoV-2基因组序列中的核衣壳蛋白(N)基因、开放阅读框1ab(ORF1ab)基因、包膜蛋白(E)基因、刺突蛋白(S)基因等[3]。 呼吸道标本或血液标本中实时荧光RT-PCR 检测新型冠状病毒核酸阳性作为重要的依据。 同时,测定SARS-CoV-2 核酸也是与流感病毒、腺病毒、呼吸道合胞病毒感染等其他病原体鉴别诊断的重要依据。 经治疗后,患者出院的标准也将连续2 次呼吸道病原核酸检测阴性 (间隔≥24 h)作为解除隔离出院的重要依据[4]。 对于实现快速确诊感染病例、排除疑似病例,促进疫情的防控与临床救治至关重要[5]。
3.1 2019-nCoV 肺炎属乙类传染病按甲类管理病毒核酸检测需在二级生物安全并通过验收的PCR 实验室进行,操作人员按三级生物安全防护[6]。为了保证安全,本次室间质评活动质控物采用新型冠状病毒假病毒作为样本,仅对江西省卫健委公布的37 家核酸检测实验室分发了质控品,按《新型冠状病毒肺炎实验室检测技术指南》 第五版要求进行检测。 根据我省各实验室使用的2019-nCoV核酸检测试剂盒可能来源于不同厂商,本次室间质评只回报ORF1ab 基因和N 基因检测结果。
3.2 目前各厂商主要提供定性检测试剂 因本次室间质控物为均一物质, 每支质控物病毒含量一致,Ct 值有一定的可比性,并且通过Ct 值可以了解试剂盒的一些相关性能,所以要求同时回报定性结果和Ct 值。
3.3 结果的真实性 本次室间质评未提前通知参评实验室,结果回报率为100.0%,体现出各实验室对室间质评的重视。 除202013 和202015 这两个批号合格率为97.3%外,其它三个批号合格率均为100.0%,36 家实验室2019-nCoV 核酸检测能力均合格,本次室间质评成绩优秀,见表1。
3.4 不同品牌试剂批内变异系数有差异 可能与不同品牌试剂盒引物设计不同、各位点检测灵敏度不同有关[7],从表2 和表3 可以看出2019-nCoV OR Flab 基因202013 批号样本浓度最高,202011 批号最低;2019-nCoV N 基因202013 批号样本浓度最高,202011 批号最低;达安基因组、上海伯杰组和其它组结果均一致。 达安基因组的产品使用率显著性高于其它产品, 且中间浓度的Ct 值标准差和变异系数最小。 上海伯杰在各组中标准差和变异系数最小,可能是用户数量相对较少的原因。
3.5 样本202012 和202014 为阴性样本 回报时,有5 家实验室未填报Ct 值,有7 家回报“0”,有25家回报试剂说明书规定的非特异性扩增的最小循环数,故未做进一步分析;这两个批号结果反映问题较为一致,所以只列出202012 批号数据。
3.6 循环阈值Ct 值与病毒模板起始拷贝数的对数存在线性关系[8]相同浓度的样本不同厂家检测Ct 值略有不同。 影响检测结果Ct 值的因素贯穿整个试验:靶RNA 降解、提取试剂盒的质量,耗材污染、移液器的准确性、人员操作、仪器扩增效率、引物设计和结果判读等均可以影响Ct 值,见表2、表3。 例如图1,阈值线选在L1 水平的Ct 值明显大于L2 水平。 所以,在日常核酸检测中,实验室一定要有规范的管理文件,操作人员严格遵守标准化程序文件执行,把各种误差降到最低。
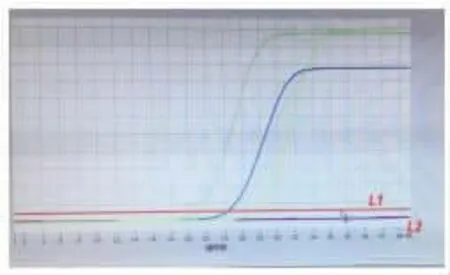
图1 阈值线对判读结果Ct 值的影响
3.7 其它情况 组主要为湖南圣湘,因室间质评系统未录入该试剂信息,所以在回报过程中归为其它组。上海复星组用户只有1 家,未做分析。在回报的数据中,有1 家实验室未填写检测方法、仪器、试剂等信息,在分组统计过程中未列入任何组。
3.8 假阴性结果分析 有一家实验室202013 和202015 这两批号回报假阴性结果, 导致这两批号合格率为97.3%。 通过查看这家实验室回报数据,发现定性结果检测方法为 “其它”, 仪器为“DA7600”,只有202011 批号回报了Ct 值,其它批号空白;一方面可能是回报错误,另一方面可能是实验室人员操作不规范引起的假阴性,也可能是试剂耗材中存在抑制剂或其它因素引起的假阴性。结合此次检测结果和回报数据, 该实验室存在管理不规范的问题,希望能通过此次室间质评体现出来的问题查找原因。
本次室间质评未涉及临床样本采集、 运送和报告发放环节,只考核实验室样本处理、提取和检测过程。 在感染者的肺泡灌洗液、鼻腔、痰液、粪便和血液样本均可用于2019-nCoV 核酸检测[9]。同一个病人作为临床定性检测项目,采样时机不合适,不同病程、不同病情患者机体中不同采样部位病毒载量可能不同[10]。此外2019-nCoV 为RNA 病毒,容易降解,样本采集后应严格按照要求运送。
目前新冠病毒所致疾病其病理过程及临床病程还未完全阐明,实验室检测路径未标准化,加上其核酸检测试剂盒研发时间紧迫,没有足够的评估及大样本量的临床验证[11],室间质评活动对于验证各实验室检测结果的准确性和可比性极其重要,针对此次2019-nCoV 核酸检测的质量管理, 江西省卫健委医政医管处委托江西省临床检验中心开展的室间质评活动,表明了省卫健委推荐开展冠状病毒核酸检测的37 家临床基因检测实验室核酸检测能力合格,同时也进一步提示了临床实验室制定样本采集及运送标准操作规程及对相关人员进行培训,以提高检测准确性的重要性和必要性。

