小鼠过敏性哮喘模型肺组织中Th9 细胞相关因子的变化及意义
付宗强,牛小斌,张汇征,李永伟
(1.河南省中医院 河南中医药大学第二附属医院检验科,河南 郑州450002;2.重庆市公共卫生医疗救治中心中心实验室,重庆 重庆400036)
过敏性哮喘是哮喘的主要类型,它以慢性气道炎症为特征,多种细胞及细胞因子参与,包括T 淋巴细胞、嗜酸性粒细胞、肥大细胞等,及这些细胞所分泌的细胞因子所形成的复杂的免疫调节网络[1,2]。目前研究认为Th2 细胞及其细胞因子谱可以调节过敏性气道炎症,导致气道的高反应性,Th1/Th2细胞失衡对于气道重构有促进作用[3]。 最近研究表明IL-9 在过敏性哮喘的进展过程中也起到重要的调节作用,IL-9 起初被认为是Th2 类细胞因子,它可以由IL-2、IL-4 和TGF-β 诱导产生,而被IFNγ 抑制[4],但是研究发现IL-9 主要来自于一个新的细胞亚群,这个新的CD4+细胞亚群并不表达现有Th 细胞亚群的转录因子[5,6],因此被称为Th9 细胞。本研究建立了小鼠哮喘模型, 检测小鼠肺组织中Th9 细胞相关因子的变化,进一步探讨Th9 细胞及其细胞因子在过敏性哮喘中的免疫调节作用。
1 材料与方法
1.1 小鼠过敏性哮喘模型的建立 SPF 级雌性BALB/c 小鼠24 只(购自河南省实验动物中心),6~8w 龄,体重18~22g,用随机数字表将其分为对照组和哮喘模型组, 每组12 只。 模型组小鼠在第1天和第14 天腹腔注射0.2ml 卵白蛋白溶液(OVA,Grade Ⅴ,Sigma A5503)进行致敏,在第28~30 天将小鼠置于自制的5L 容器中超声雾化吸入1%浓度的OVA 进行激发,每天激发一次,每次20min,对照组则用同等体积的生理盐水代替处理。0.2mlOVA 致敏液含20μg OVA 和0.1ml 液态铝佐剂(Imject Alum,Thermo Pierce)。
1.2 小鼠气道反应性检测 末次激发24h (第31天)后,应用全身体积描记仪无创肺功能检测系统(Whole-body Plethysmograph, WBP,Buxco 公司)检测小鼠气道增强的呼吸间歇 (enhanced pause,Penh)。 将两组小鼠分别用生理盐水和梯度浓度的乙酰甲胆碱(Mch,Sigma A2251)进行激发后,转入WBP 中记录Penh 值, 并计算Penh%值 (Penh%=Mch 激发后的Penh/生理盐水激发后的Penh×100%),来反映小鼠气道阻力的变化程度。 所用的Mch 梯 度 浓 度 依 次 为6.25mg/ml、12.50 mg/ml、25.00 mg/ml 和50.00mg/ml。
1.3 小鼠标本的获取及处理 第32 天。
1.3.1 肺组织 摘取小鼠肺脏, 左侧肺叶用福尔马林固定,行HE 染色(n=6);右侧肺叶放入液氮中,提取RNA, 逆转录,SYBR GreenⅠ荧光定量PCR检测IL-9、IL-9R 和转录因子PU.1 mRNA 表达水平(RNA 提取、逆转录及荧光定量PCR 试剂盒均购自TaKaRa 公司)。 每个标本设3 个副孔,各引物来自Primer Bank,引物序列见表1,由上海生工生物有限公司合成。 各步操作严格按照试剂说明书进行。

表1 各指标引物序列及扩增片段长度
1.3.2 支气管肺泡灌洗液 (bronchoalveolar lavage fluid, BALF) 对小鼠进行气管插管, 用冷PBS(4℃)进行支气管肺泡灌洗3 次,0.8ml/次,收集灌洗液,回收率≥80%,3000r/min 离心5min, ELISA 法检测上清中各细胞因子(IL-4、INF-γ、IL-9 和OVA特异IgE,R&D 公司)的含量。各步操作严格按照试剂说明书进行。
1.4 统计分析 应用spss18.0 及GraphPad 7.0 进行数据分析和生成图表;所得数据以x±s 表示,数据正态分布和方差齐的, 两组间比较采用独立样本t检验,否则进行秩和检验;各因子间的相关系采用Pearson 线性相关分析;显著性检验水准为P<0.05。SYBR GreenⅠ荧光定量PCR 数据用2-ΔΔCt法计算mRNA 的相对表达量,相对表达量升高2 倍或降低0.5 倍,认为有意义。
2 结果
2.1 小鼠激发时的表现 哮喘模型组小鼠受OVA或Mch 激发时,起初表现为躁动不安,前爪搔鼻、呼吸急促,腹式呼吸、弓背呼吸,随后站立不动出现喘息症状;对照组小鼠受则没有这些表现,只是受到惊扰后的活动增加,偶有搔鼻,打喷嚏。
2.2 肺组织HE 染色 模型组小鼠支气管壁和肺泡壁明显增生,形态发生变化,更为狭窄不规则,并有大量炎症细胞浸润、充血水肿表现;而对照组小鼠的支气管和肺泡形态较规则, 无明显增生和细胞浸润表现。 见图1。
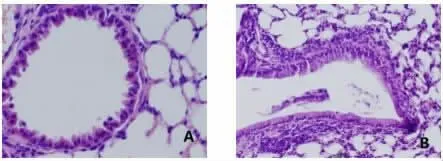
图1 小鼠肺组织HE 染色图片(×200)
2.3 Mch 激发后小鼠Penh 检测 对照组n=12,模型组n=12。 两组小鼠的Penh%随Mch 剂量的增加都有升高的趋势, 但是模型组小鼠上升的更快,特别是在受到25.00mg/ml 和50.00mg/ml Mch 激发后,两组的Penh%具有显著性差异。 见图2。

图2 两组小鼠受梯度剂量Mch 激发后Penh%的变化
2.4 BALF 上清中各细胞因子及OVA 特异IgE 含量 与对照组相比,过敏性哮喘小鼠BALF 上清液中Th2 类细胞因子IL-4、IL-9 水平显著升高,而Th1 类细胞因子INF-γ 则显著下降;另外对于OVA 特异的抗体IgE 的含量也是显著升高的。 对照组n=6,模型组n=6。

图3 小鼠BALF 中各细胞因子及OVA 特异IgE 的水平
2.5 模型组小鼠肺组织中Th9 相关分子mRNA 的相对表达量 采用SYBR GreenⅠ荧光定量PCR 检测了两组小鼠肺组织中Th9 相关分子mRNA 的相对表达水平,结果显示,在模型组小鼠肺组织中IL-9、IL-9R 及Th9 细胞的关键性转录因子PU.1 mRNA 表达水平与对照组相比均显著增高,增高的倍数分别为2.64~4.42 倍、5.32~9.36 倍、4.89~8.67倍。 对照组n=6,模型组n=6。

图4 模型组小鼠肺组织中IL-9、IL-9R 及PU.1 mRNA 相对表达水平
2.6 小鼠肺组织中各个因子间的相关性分析 小鼠肺组织中PU.1 mRNA 的相对表达量与IL-9 mRNA、IL-9R mRNA 的相对表达量呈显著的正相关系(r=0.759,P=0.004;r=0.856,P=0.000),并且与小鼠BALF 上清液中的IL-9 及OVA 特异IgE 含量也有明显的正相关系(r=0.882,P=0.000;r=0.848,P=0.000),见图5a、b、c、d;小鼠BALF 中OVA 特异IgE 的含量与IL-9 mRNA、IL-9R mRNA 相对表达量及BALF 中的IL-9 含量呈显著的正相关系 (r=0.807,P=0.002;r=0.851,P=0.000;r=0.918,P=0.000),见 图5e、f、g; 小 鼠BALF 中IL-9 含 量 与 传 统 的Th2 类细胞因子IL-4 的含量呈正相关关系 (r=0.912,P=0.000),而与传统的Th1 类细胞因子INFγ 有明显的负相关系(r=-0.799,P=0.002),见图5h、i。
3 讨论
过敏性支气管哮喘是一种常见的慢性炎症性疾病,儿童的发病率高于成人,并具有遗传倾向,过敏性哮喘患者及其家人往往也患有其他过敏性疾病,如湿疹、过敏性鼻炎等[2,7],患者体内IgE 水平升高,肺部有嗜酸性粒细胞、肥大细胞等浸润,并有Th 细胞亚群及其细胞因子谱的紊乱[8,9]。 大量的研究表明,过敏性哮喘患者体内存在Th1 细胞与Th2细胞的比例失衡,Th2 细胞过度分化及其相关的Th2 类细胞因子参与了哮喘的发生、发展,研究发现患者肺部高浓度的IL-4 可以诱导机体发生免疫球蛋白的类别转换(产生大量的IgE)[7],另一种Th2类细胞因子IL-5 可以诱导和募集嗜酸性粒细胞在肺部聚集,Th2 细胞及细胞因子也参与了肺部组织细胞的重构[2,10],然而传统的Th1/Th2 比例失衡理论并不能完全解释过敏性哮喘的发病机制。

图5 小鼠肺组织中Th9 相关因子与其他分子间的相关性分析
近年来的研究发现,IL-9 可能在过敏性哮喘的发生、发展中起到重要的作用,IL-9 常常与Th2类细胞因子相伴升高,人们往往将其归为Th2 类细胞因子[11]。然而Veldhoen[6]等人研究发现TGF-β 可以使IL-4、IL-5、IL-13 和转录因子GATA-3 表达缺失,转而产生大量的IL-9,将其归为Th2 类细胞因子并不妥当。与此同时,Dardalhon[5,12]的研究团队发现IL-4 与TGF-β 共存时可诱导IL-9+IL-10+Foxp3-的T 细胞产生,这一细胞亚群不同于传统的Th 细胞亚群,它以分泌IL-9 为主要特点,并不表达传统Th 细胞亚群的转录因子,因此将其定义为Th9 细胞。 与TH9 细胞相关的因子众多,主要包括转录因子PU.1、IRF1、IRF4 等,TH9 细胞分泌的细胞因子IL-9、IL-10,与其分化密切相关的细胞因子TGF-β、IL-4,IL-6、IL-21、IFN-γ 等, 以及TH9 细胞发挥免疫调节作用的相关受体, 目前研究表明TH9 的细胞表型与PU.1 的关系密切,它为TH9 特异的转录因子, 另外与小鼠TH9 细胞不同的是人类的TH9 细胞分泌IL-9 并不分泌IL-10[1,16,18]。 本研究复制了小鼠哮喘模型,并通过WBP 系统验证了哮喘模型小鼠气道的高反应性,以及哮喘患者呼气时相延长的特征,并对小鼠的肺组织进行了病理染色,结果显示模型组小鼠肺组织中有充血水肿表现,并有大量炎症细胞浸润,这与哮喘患者的肺组织病理表现一致。 本文以此为基础来探讨小鼠肺组织中Th9 细胞相关分子间相互关系。
有研究发现在过敏性哮喘患者肺组织中Th9数量与气道反应性呈正相关,IL-9 水平升高[13]; 有关动物实验显示,应用抗体中和IL-9 后,小鼠气道高反应性得到下降,肺组织中细胞浸润减少,气道炎症状态得到改善[14],IL-9 可以促进由Th2 类细胞因子IL-4 诱导的免疫球蛋白的类别转换,然而IL-9 对抗体的单独作用并不清楚[15]。PU.1 是转录因子ETS(E26 transformation specific or E-twenty-six)家族成员,它可以和Th9 细胞的IL-9 基因启动子直接结合,促进分泌IL-9,并在Th9 细胞的分化和功能的维持方面起到重要的作用, 因此PU.1 被认为是Th9 细胞关键性的必需的转录因子[16,17]。 但PU.1作为转录因子,已经确认110 多个直接的靶基因,这其中不仅包括细胞因子、细胞增殖分化基因,还包括受体、抗体以及补体基因,PU.1 与Th1 类、Th2类细胞因子及IgE 的关系并不十分清楚[18-20]。
本研究发现哮喘小鼠肺组织PU.1 mRNA 的相对表达量明显高于对照组,并与IL-9 mRNA、IL-9R mRNA 呈显著的正相关关系, 同时与其呈明显正相关的还有小鼠肺组织中的OVA 特异性IgE 抗体。 这些结果提示PU.1 可能在这些分子的表达过程中起到重要的作用。 本研究还检测了小鼠BALF上清中IL-4、IL-9、INF-γ 及OVA 特异的抗体IgE的含量, 以及小鼠肺组织中IL-9 mRNA、IL-9R mRNA 的相对表达水平,研究发现与对照组相比在小鼠哮喘模型肺组织中除INF-γ 水平显著下降外,其他分子均明显上升,小鼠哮喘模型肺组织中存在着IL-4/INF -γ 失衡,这与以往的研究结果一致。进一步的因子相关性分析发现IL-9 含量及其mRNA相对表达量与IL-4 及OVA 特异IgE 含量呈显著的正相关关系,但与INF-γ 具有明显的负相关系,这提示在小鼠哮喘模型肺组织中也存在着IL-9/INF-γ 紊乱,这些分子的改变可进一步通过受体作用于细胞,可能在哮喘的发病、发展中起到重要的调节作用。
Th9 细胞亚群的发现,及其相应的细胞因子谱的研究,使我们对许多疾病有了新的认识,它为Th细胞亚群的研究注入了新的活力,对于过敏性支气管哮喘来说,本研究及以往的结果提示Th9 及其相关的因子在哮喘的发生、发展中可能起到重要的调节作用,Th9 及相关分子也为过敏性哮喘的诊断和治疗提供了潜在靶点。

