PDE-4 抑制剂对氯胺酮导致幼年大鼠学习记忆障碍的改善作用
冀会娟,毕彦博,孟慧芳,李鹏超,樊青,胡振华
(1.河南中医药大学附属郑州人民医院麻醉科,河南 郑州450002;2.河南省人民医院麻醉科,河南 郑州450005)
氯胺酮是肌肉松弛等小手术常用麻醉药物之一,具有诱导快,镇痛效果优良,患者苏醒快,呼吸系统抑制作用小等优势[1]。 但动物实验显示,氯胺酮可导致幼年大鼠短期、 远期学习记忆能力下降[2,3]。 磷酸二酯酶-4(Phosphodiesterase-4,PDE-4)抑制剂是一种具有抗炎效应的药物,目前常用的PDE-4 抑制剂有Ro20-1724、罗氟司特和西洛司特等。临床研究表明[4],PDE-4 抑制剂对氯胺酮引发的学习记忆障碍具有显著疗效。 海马区是人学习、记忆的重要脑组织,该区域内EGFR、CREB 和BDNF 蛋白是cAMP/PKA-CREB-BDNF 信号通路的重要介质,与人学习、记忆功能密切相关。 为探讨PDE-4抑制剂对氯胺酮导致幼年大鼠学习记忆障碍的实际疗效及对大鼠海马区EGFR、CREB 和BDNF 表达水平的影响,本组研究选取21d 40 只SD 大鼠进行研究。 报告如下。
1 材料与方法
1.1 实验动物及试剂 选取21d SD 大鼠40 只,雌雄各半,购自中科院上海实验动物中心,适应性喂养一周,室内温度22~26℃,湿度50~60%,自由摄食及饮水,昼夜各12h,随机分为对照组,氯胺酮组,氯胺酮+PDE-4 抑制剂组,氯胺酮+PDE-4 抑制剂溶媒组,各组10 只后分笼饲养。兔抗鼠p-CREB抗体、 兔抗鼠EGFR 抗体以及兔抗大鼠BDNF 抗体由武汉伊艾博科技有限公司提供;氯胺酮由浙江九旭药业有限公司提供;PDE-4 抑制剂Ro20-1724 由美国Sig-ma 公司提供;羊抗兔IgG 由北京庄盟国际生物基因科技有限公司提供。
1.2 实验方法
1.2.1 干预措施 对照组大鼠给予2ml 生理盐水腹腔注射,30min 后再次注射2ml 生理盐水; 氯胺酮组大鼠给予腹腔注射65mg/kg 氯胺酮(浙江九旭药业有限公司,国药准字:H20023609),30min 后注射2ml 生理盐水; 氯胺酮+PDE-4 抑制剂组大鼠给予同上氯胺酮注射,30min 后腹腔注入0.5mg/kg Ro 20-1724(美国Sig-ma 公司,进准字:070M1976V);氯胺酮+PDE-4 抑制剂溶媒组大鼠给予同上氯胺酮注射,3min 后腹腔注射2ml 0.1%乙醇(Ro20-17 24 溶媒),随后给予所有大鼠正常喂养7~8d。
1.2.2 Morris 水迷宫测试 各组大鼠Morris 水迷宫实验:于160cm 直径,75cm 高度的圆形水池内进行实验,水深50cm,水温约为25℃,滴入墨水染色,将水池分为4 个象限, 于第一象限放置一个低于水面2cm 的面积6×8cm 的长方形平台。 于给药9d后每天8:00 按1~4 象限顺序将大鼠放入水池,记录120s 内大鼠从各入水点爬到平台的时间, 并将其判定为逃避潜伏期。如大鼠于120s 内找到平台,则让大鼠于平台上留置30s,记录相应的逃避潜伏期;如大鼠未找到平台,则引导其寻找平台,让大鼠于平台上留置30s, 并将其逃避潜伏期记录为120s。 连续实验5d,于第6d 撤去平台,同前入水实验,记录120s 大鼠穿过平台原位置的次数。
1.2.3 Western blot 检测 Morris 水迷宫实验结束后脱颈处死大鼠,打开颅脑取出海马组织,选用细胞裂解液提取海马组织蛋白, 选用BCA 法进行蛋白定量,并电泳转膜,10ml 脱脂奶室温下封闭60min,分别选用兔抗鼠p-CREB 抗体(l:500)、兔抗鼠EG FR 抗体(1:1000)以及兔抗大鼠BDNF 抗体(l:1500)进行一抗,摇床孵化60min,选用酶标羊抗兔IgG(1:2000)进行二抗,孵化60min,曝光成像,选用美国Bio-Rad ChemiDoc MP 成像系统读取结果。
1.3 统计学处理 统计分析采用SPSS19.0 软件,计量资料采用(±s)表示,多组间比较使用方差分析,两两比较采用LSD-t 检验。 P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠逃避潜伏期比较 氯胺酮+PDE-4 抑制剂组第2d、 第3d 和第4d 逃避潜伏期明显低于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组(P<0.05),与对照组比较差异无统计学意义(P>0.05)。 见表1。
2.2 各组大鼠穿越平台次数比较 氯胺酮+PDE-4抑制剂组穿越平台次数明显高于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组(P<0.05),与对照组比较差异无统计学意义(P>0.05)。 见表2。
2.3 各组大鼠海马CA1 区EGFR、CREB 和BDNF水平比较 氯胺酮+PDE-4 抑制剂组海马CA1 区EGFR、CREB 和BDNF 蛋白相对表达量分别为0.761±0.100、0.370±0.081 和0.418±0.092,明显低于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组(P<0.05),与对照组比较差异无统计学意义(P>0.05)。 见表3、图1。
3 讨论

表1 各组大鼠逃避潜伏期比较(s)
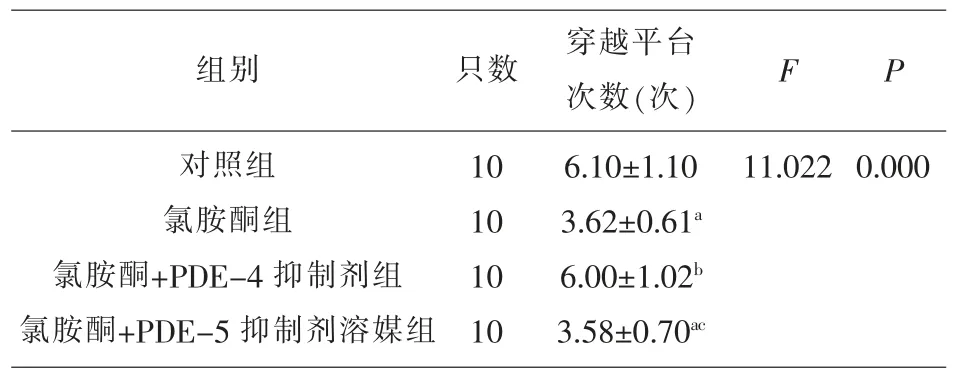
表2 各组大鼠穿越平台次数比较

表3 各组大鼠海马CA1 区EGFR、CREB 和BDNF 水平比较

图1 Western blot 检测图
磷酸二酯酶(phosphodiesteras,PDEs)具有促环磷酸腺苷或环磷酸鸟苷等细胞第二信使水解功能,并以此终止第二信使介导的生化反应[5]。PDE-4抑制剂则可抑制PDEs 活性,并增强环磷酸腺苷或环磷酸鸟苷表达[6]。PDE-4 抑制剂具有多种效应,如抗炎,其可抑制Th2 生成IL-4、IL-5 等炎症介质,抑制细胞粘附因子表达。 PDE-4 抑制剂还可诱导细胞凋亡, 促进内源性激素及儿茶酚胺类物质表达[7,8]。Ro20-1724 是新型PDE-4 抑制剂,本品可改善睡眠障碍, 并可改善链脲霉素及3-硝基丙酸引发的大鼠认知功能障碍,其机制可能与现cAMP/PKA-CREB-BDNF 信号通路有关[9]。但对于Ro20-1724是否可改善氯胺酮引发的幼儿认知功能障碍症状及其机制,临床研究较少,为此,我们进行了本组研究。
本组研究发现, 氯胺酮+PDE-4 抑制剂组第2d、第3d 和第4d 逃避潜伏期明显低于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组,与对照组比较差异无统计学意义;并且氯胺酮+PDE-4 抑制剂组穿越平台次数明显高于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组,与对照组比较差异无统计学意义,表面氯胺酮注射可引发大鼠学习、记忆功能障碍,而给予提示PDE-4 抑制剂治疗后,大鼠学习、记忆障碍可得到有效恢复。 由于Ro20-1724 无法被水溶解,为此本组研究选用乙醇作为助溶剂[10]。 需要注意的是, 高剂量的乙醇给药也可能引发脑组织学习、记忆障碍,因此本组研究将乙醇配置成1%浓度。
人脑学习、记忆等高级神经活动主要通过海马区实现,当大脑皮质内的神经元接受到视觉、触觉等感觉信息时,神经元会将这些信息传递至海马区[11]。如海马区存在反应,神经元将因此形成网络,并存储(记忆)/删除(遗忘)某些信息。 EGFR 是表皮生长因子受体的一种,广泛存在于上皮、胶质以及成纤维细胞内。 EGFR 介导的信号路径与细胞生长、增殖以及分化密切相关[12]。 CREB 是一种具有基因转录调节能力的蛋白质,当环磷腺苷活化并诱导PKA 转入细胞核后,CREB 将被活化,并调控靶向基因表达。BDNF 是脑组织内生成的一种蛋白质,主要存在于中枢神经系统内,是神经元分化、生长以及存活的重要介质[13]。 临床研究显示,海马区记忆形成依赖于CREB 诱导下游BDNF 基因活化[14]。 本组研究中,氯胺酮+PDE-4 抑制剂组海马CA1 区EGFR、CREB 和BDNF 蛋白相对表达量明显低于氯胺酮组和氯胺酮+PDE-5 抑制剂溶媒组,与对照组比较差异无统计学意义, 提示PDE-4 抑制剂可通过抑制PDEs 活性, 增强神经元细胞环磷腺苷表达,并激活PKA,活化CREB,最终作用BDNF 表达,激活整个cAMP/PKA-CREB-BDNF 信号通路, 逆转氯胺酮引发的大鼠学习、记忆障碍[15]。
综上所述,PDE-4 抑制剂可改善氯胺酮导致的幼年大鼠学习记忆障碍,可能与其影响大鼠海马CA1 区EGFR、CREB 和BDNF 蛋白表达有关,PDE-4 抑制剂Ro20-1724 或可用于治疗氯胺酮等麻醉药物引发的学习、记忆障碍。

