一种基于琼脂糖凝胶电泳法检测SARS-CoV-2的新方法
刘军花, 李学龙, 刘茜阳, 于 琳, 吴珊珊, 尹秀山, ,3,4,5*
(1.沈阳化工大学 制药与生物工程学院,辽宁 沈阳 110142;2.拜澳泰克(沈阳)生物医学集团有限公司,辽宁 沈阳 110142;3.江苏谱录瑞医疗科技有限责任公司,江苏 徐州 221000;4.海耐诺生物科技有限公司,上海 200000;5.拜澳泰克(江西)生物科技有限公司,江西 赣州 341000)
自2019年12月以来,在我国武汉地区突发的新型肺炎疫情的重要病原体是一种新型的人与其他灵长类共患性冠状病毒(2019 novel coronavirus,2019-nCoV)[1-3]。经相关测序鉴定,该冠状病毒为一种含包膜结构且呈单股正链的RNA病毒,与SARS[4](严重急性呼吸综合征)和MERS[5](中东呼吸综合征)的病毒同属一个冠状病毒亚科(Coronaviridae)[6-7]。随后,世界卫生组织(WHO)将此次新型肺炎事件命名为“COVID-19(Coronavirirus disease-2019)”,并且相应的新型冠状病毒被更名为SARS-CoV-2(Severe Acute Respiratory Syndrome Coronavirus 2)。Jasper等通过进化分析发现SARS-CoV-2基因组与源于蝙蝠SARS-like-CoVZXC21和源于人SARS-CoV的核苷酸序列的同源性分别为89%和82%[8]。据临床报道,该病毒感染者常表现为高热、咳嗽、胸闷、乏力、肌肉酸痛和呕吐腹泻等不同症状[9],主要通过飞沫、气溶胶、密切接触或粪口传播[16]等方式传播,传染力极强,潜伏期较长(一般为7~14 d)[10]。在Liu 等[11]的报告中显示,该病毒的感染增长指数(reproduction number,R0)远高于SARS,2020年2月8日之前,在全国范围内该病毒已确诊感染人数高达3.4万。根据中国疾控中心疫情实时报告数据显示,截至2020年2月25日感染人数达7.8万。诊断病毒感染疾病的主要手段包括病毒分离鉴定、CT影像学和分子生物学检测等。病毒分离鉴定方法操作复杂,耗时费力,不利于诊断和治疗效率[12]。而临床的胸部CT扫描结果难以直接判断显影结果是由SARS-CoV-2病原感染所导致的真实性[13],甚至无症状携带者的CT显示呈阴性等。目前,SARS-CoV病毒特异性核酸检测被认为是其诊断的金标准[14]。通过SARS-CoV-2病毒核酸鉴定,再联合CT扫描结果进而获得真实可靠的确诊情况。Corman等[15]研究表明,实时定量逆转录PCR技术可以用于检测SARS-CoV-2,但缺乏临床适用性测试,本研究旨在建立一种基于琼脂糖凝胶电泳法检测SARS-CoV-2的新方法,并逐一进行条件优化过程,为临床诊断提供一个更简便、省时且准确的分子检测方法。
1 材料与方法
1.1 材料
1.1.1 实验材料 临床COVID-19阳性样本/病毒核酸RNA,由中国疾控中心CDC提供。
1.1.2 试剂 反转录试剂盒Superscript III Reverse Transcription First-Strand Synthesis System(货号:18080051)购自thermo公司;DNATaq聚合酶 (货号:KT201) 购自北京天根公司;核酸染料购自北京GenStar公司;琼脂糖购自上海生工公司。
1.1.3 仪器与设备 PCR扩增仪(BIORAD-C1000,美国Bio-Rad公司);凝胶成像系统(美国Bio-Rad公司);多功能电泳仪(北京六一公司);离心机(Eppendorf-5424R,德国Eppendorf公司)。1.2 方法
1.2.1 引物设计与合成 参考GenBank提供的来自武汉的COVID-19代表性病例的基因组序列WH-human_1 genome,与其同源的几种冠状病毒SARS、Bat SL-CoV ZC45 和Bat SL-CoV ZXC21的序列进行同源性比对,针对SARS-CoV-2核酸序列的特异性区域[1](如orf1ab和surface glycoprotein)而进行设计。实验采用的PCR扩增引物为N519引物(322 bp)和Wuhan 引物(547 bp),序列见表1。以上涉及的引物均送至上海生工公司进行合成。
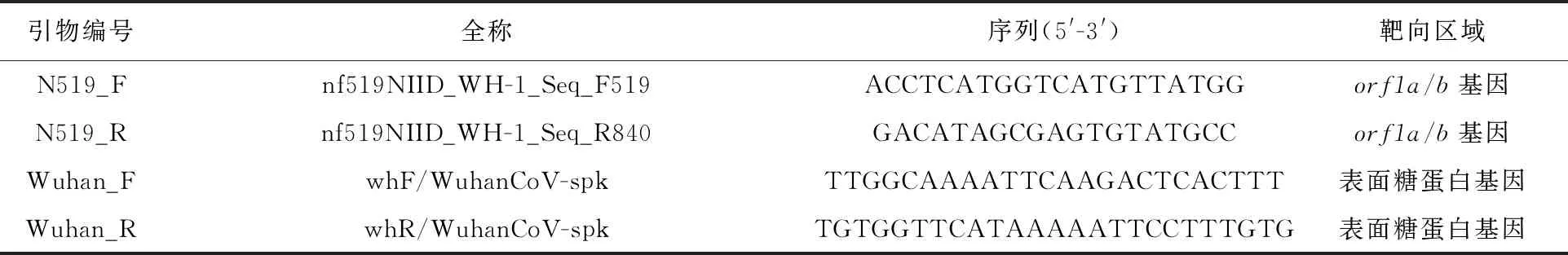
表1 实验所涉及的引物序列
1.2.2 样品处理 利用thermo反转录试剂盒将经过处理的COVID-19阳性患者RNA(通常-80 ℃保藏),逆转录成cDNA,并于-20 ℃保存备用。
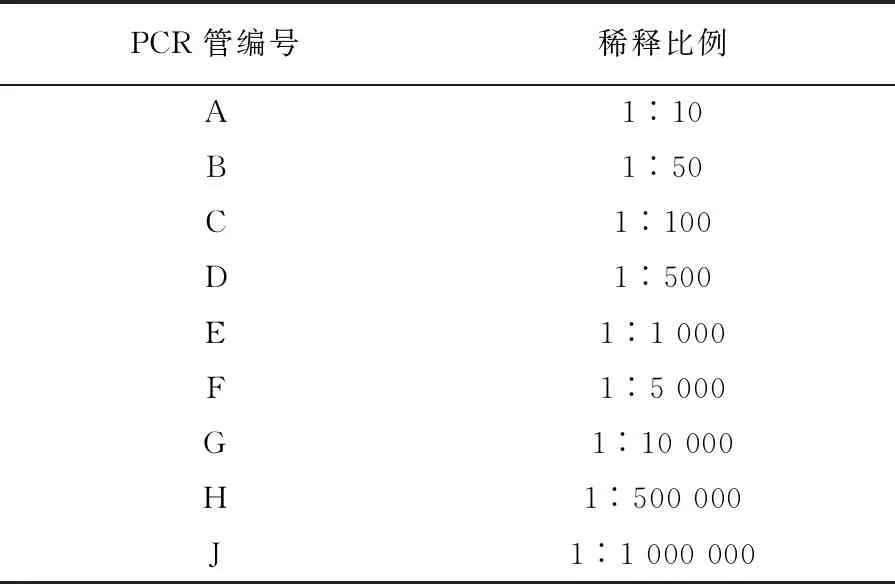
表2 cDNA最优浓度稀释比例
1.2.3 检测时间的优化反应条件 试剂盒KT201反应体系为cDNA模板1 μL(样品cDNA终浓度4 ng/μL),2×TaqPCR Mastermix 10 μL,F/R引物(10 μmol/L)各0.5 μL,其他由无菌水补至20 μL,阴性对照模板均用无菌水代替,标为NC。将含有样品的PCR管经过涡旋混匀并微离心,移至PCR仪进行扩增。扩增体系设置如下:第一阶段94 ℃ 3 min;第二阶段94 ℃ 变性30 s,56 ℃退火30 s,72 ℃延伸 30 s,循环35次;继续72 ℃保持5 min,恢复至4 ℃孵育。 将PCR扩增反应产物加入适量核酸染料,经2% 琼脂糖凝胶电泳130 V, 15 min后,结果进行紫外成像分析。为了提高检测效率,针对PCR扩增第二阶段的时间缩短至10 s、5 s,以获得最优的检测时间。
1.2.4 检测浓度的优化反应条件 最佳浓度优化实验流程同1.2.3的操作一致,在确定最优扩增时间的基础上,通过稀释cDNA模板浓度,确定最优的模板浓度。初始cDNA为4 ng/每个反应,稀释比例见表2。
2 结果与分析
2.1 最优检测时间
最优检测时间结果分析见图1,根据凝胶成像结果,在20 μL 的cDNA扩增反应体系中,当PCR第二阶段反应时间缩短至5 s时,图像显示的结果与最初设置的30 s所反映的情况基本一致,条带清晰,未出现条带缺失现象。因此,可以确定在特定的条件下,当扩增时间缩短,理论上仅改变的是扩增产量,但在不丢失条带的前提下,最短时间可以缩短至5 s,整体扩增反应时间将减少至20~30 min以内。
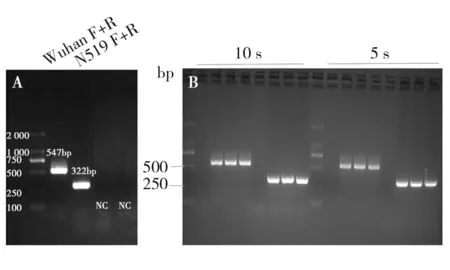
图1 检测时间优化后的结果图Fig.1 The result image after testing time optimizationA图为表面糖蛋白基因和非结构蛋白区域ORF1a/b的特定引物扩增阳性结果,扩增后的片段大小分别为547 bp和322 bp;B图为PCR第二阶段扩增时间缩短至10 s、5 s的两组结果,其中每组实验的样品顺序为DNA Marker,阴性对照,针对表面糖蛋白基因引物的扩增阳性样品以及针对ORF1a引物的扩增阳性样品,且每个条件设置有3个生物重复(初始病毒cDNA剂量为4 ng)The figure A shows the positive results of amplification with ORF1a/b and surface glycoprotein gene primer, and the fragment size after amplification is 547 bp and 322 bp respectively. The figure B show that when the second phase of the PCR amplification time reduced to 10 s, 5 s, Marking two groups, the order of samples is marker, negative control, three positive reapeats with primers, containing three biological duplication(initial viral cDNA dosage is 4 ng)
2.2 最佳检测浓度
通常情况下,采集患者样本(上呼吸道中的鼻咽拭子或下呼吸道中的痰液、支气管肺泡灌洗液)的COVID-19病毒载量,可以间接地反映COVID-19病毒感染的严重程度。当样本源于轻度感染者或者正处于潜伏期间的患者,则从上呼吸道中的病毒核酸获得率较低。通过条件优化检测样品浓度,以获得采用最少量核酸而获知最有效最准确的信息。图2为最佳核酸浓度凝胶成像图,从图2可以看出,当稀释比大于1∶5 000时,会出现阳性样本条带丢失现象,由此确定最佳检测核酸浓度为(1∶1 000)~(1∶5 000)之间(初始值为4 ng/μL)。
根据以上所建立的方法,对COVID-19重症感染病人所提取的病毒核酸进行检测,结果表明扩增条带清晰,可以初步用于疑似病例中是否感染COVID-19病原的检测。
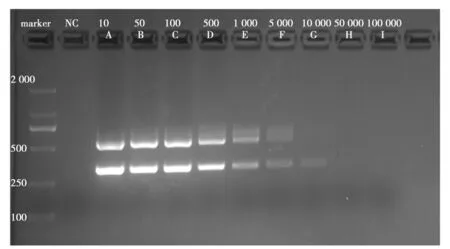
图2 最佳检测核酸浓度范围Fig.2 The result image of the optimal detection concentration range A=1/10, B=1/50, C=1/100, D=1/500, E=1/1 000, F=1/5 000, G=1/10 000, H=1/50 000, and I=1/100 000(初始病毒cDNA剂量为4 ng)A=1/10, B=1/50, C=1/100, D=1/500, E=1/1 000, F=1/5 000,G=1/10 000, H=1/50 000, and I=1/100 000(initial viral cDNA dosage is 4 ng)
3 讨 论
目前,国内的COVID-19发病率及传染力极其强大。感染SARS-CoV-2病毒的人群,通常会出现与流感病毒引起的感冒相似的症状,尤以发热为主,少数也出现无症状感染者,但仍然具有在人群间感染的风险。因此,寻找一种有效且快速检出SARS-CoV-2的方法,对SARS-CoV-2病毒感染者进行早期筛查并实施隔离防控是十分关键的。本研究建立了一种低成本且高效鉴定COVID-19的新方法——电泳法。该方法操作简便、特异性强,适合病毒载量较小的样本,可以直观反映COVID-19病原在体内的入侵情况,为SARS-CoV-2感染患者进行早期防控、临床用药及预后诊断提供分子技术参考。
说明本文第一作者受所有作者委托,对此前提交论文“一种基于琼脂糖凝胶电泳法检测SARS-CoV-2的新方法”的有关内容做了印刷前的修改,特此说明。