基于分级过滤的自然水体原核微生物群落分析
宋家梁, 张汝毅, 邹 斌, 全哲学
(复旦大学 生命科学学院, 上海 200438)
自然水体是各种生命活动的主要场所之一,其中包含各种大小的微生物。它们在地球物质循环、能量流动中起到巨大作用[1-2],与人类的生产生活密切相关。在制药生产和科研领域一般使用截留孔径为0.22 μm的过滤膜作为除菌手段之一。但有研究者不断发现能穿透0.22 μm过滤膜的新类型微生物,称之为超微小微生物[3-4],这已成为一个热门而富有挑战的研究方向。一项格陵兰岛冰川微生物类群研究中发现某些超微小微生物能够在冰川中聚集形成狭窄的液体脉路,以非常低的速率进行代谢,该微生物很好地适应了冰川中的多种恶劣环境[5]。美国研究者在一个冰湖水下16 m盐卤水中提取到的样品中也发现了一些超微小微生物[6],这些研究认为超微小微生物是受严酷的环境压力和生命周期等因素影响而呈现超微小的状态。此外地下水[4]和热液口[7]环境中也发现了超微小微生物。超微小微生物不仅包括一般细菌,还包括放线菌[8]和古生菌[9-10]。美国加州大学Banfield课题组对地下深井中的超微小微生物宏基因组分析,发现了由15个以上候选门组成的细菌超门,并通过地下水样品的进一步分析发现了47个新的细菌候选门[11-12]。常见的水体微生物研究多着眼于某类水体,基于分级过滤对不同自然水体中的微生物群落进行比较分析的研究相对少见。本研究选择上海市周边秋季的湖水、河水、海(岸)水、井水这四类自然水体各取两处样品,共8个水样。通过一套自主研制的半自动分级过滤装置将水体中的微生物在1.2、0.22、0.1 μm三级不同截留孔径、不同过滤面积的膜上分离富集,使用原核微生物16S rRNA基因通用引物进行扩增,并高通量测序,分析了不同水体的微生物群落结构和超微小原核微生物的优势群落类型。
1 材料与方法
1.1 材料
1.1.1 水样 每类自然水体采集两个不同地点的水样各15 L,水样编号与采水点地理位置见表1。测序样品编号,首字母代表水样类型,后缀“A”代表0.1 μm孔径过滤膜,“B”为0.22 μm孔径过滤膜,“C”为1.2 μm孔径过滤膜,例如“W1A”代表井水1号水样0.1 μm孔径过滤膜截留的微生物样品。
1.1.2 仪器与设备 自制半自动分级过滤装置(见图1):聚丙烯材质管路;自吸式隔膜泵(EC-304-50B,佛山市三角洲电器科技有限公司);压力表(Y-100型,常州朗德压力表有限公司);压力开关(HPS-1,浙江科博电器有限公司);5 μm预澄清过滤器(PS5-10,滨特尔水处理有限公司);316 L不锈钢碟片式过滤器(定制,适合于142 mm直径膜片,海盐新东方塑化科技有限公司);东胜龙PCR仪(EDC-810,北京东胜创新生物科技有限公司);核酸电泳装置;pH仪(FE28-Standard,梅特勒-托利多);电导仪(FE38-Standard,梅特勒-托利多);超净台等。
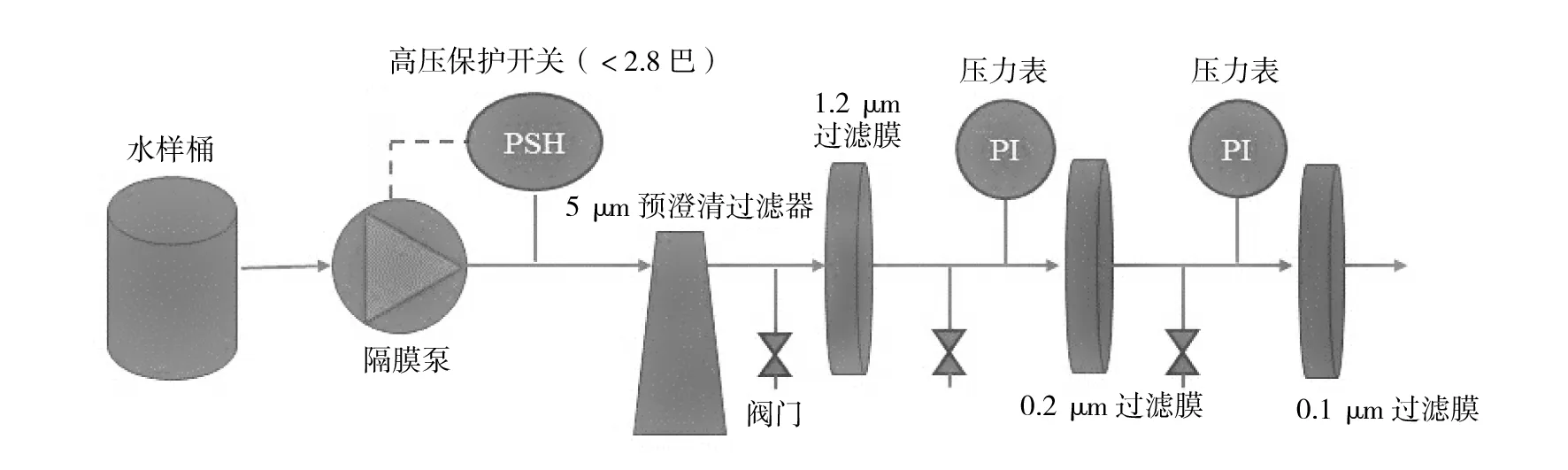
图1 半自动分级过滤装置管路及仪表流程图Fig.1 Piping & instrumentation diagram of semi-auto grading filtration device
1.1.3 耗材 分级过滤主要使用1.2 μm (直径142 mm)、0.22 μm (直径142 mm)、0.1 μm (直径47 mm)3种孔径聚醚砜过滤膜(Pall Filtration, Port Washington, New York, USA),DNA的提取使用DNeasy PowerSoil DNA提取试剂盒(QIAGEN, Hilden, Germany);KAPALTP Libray试剂盒(Kapa Biosystems, Wilmington, Massachusetts, USA)。
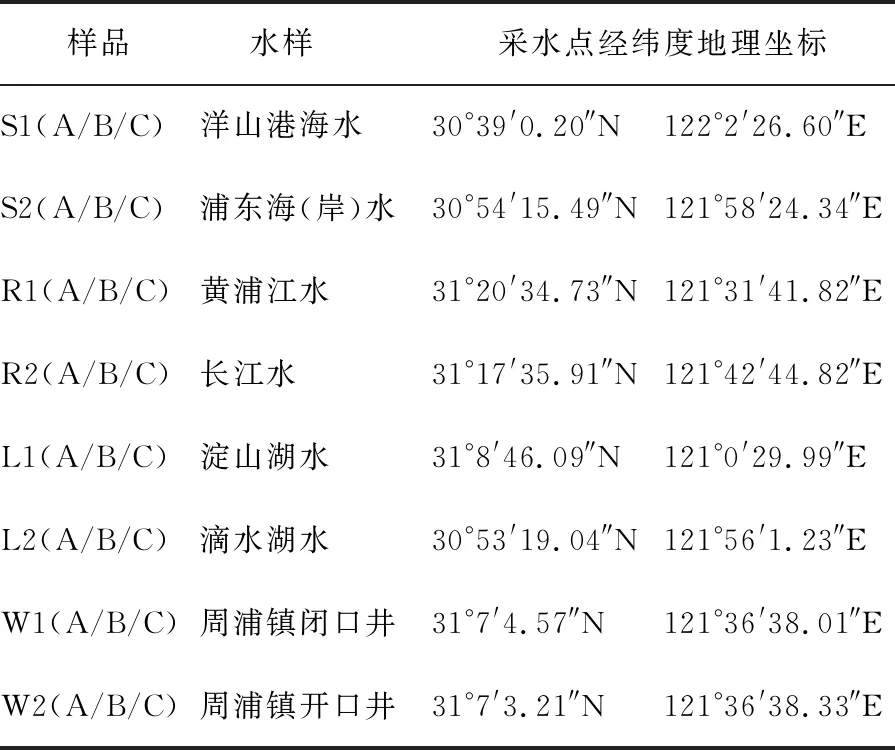
表1 四类自然水体8个水样
1.2 方法
1.2.1 分级过滤 充分润湿滤膜并排除管路空气后进行连续过滤。在过滤起始、中段、结束三个时间点测滤速,过滤结束后将3个孔径的过滤膜分别保存于-80 ℃超低温冰箱。
1.2.2 提取DNA 每种截留孔径过滤膜分别剪取半径为23 mm的半圆型并剪碎,按照DNeasy PowerSoil试剂盒说明书提供的方法提取膜上DNA,但在膜碎片与磁珠混匀震荡的步骤加长至60 min。从四类水体8个水样的3个孔径滤膜中获得共计24个DNA样品,因河水1.2 μm样品R2C在提取DNA过程中被破坏,所以未能包括在后面的分析中。
1.2.3 PCR扩增 使用原核生物通用正向引物Pro341F(5′-CCTACGGGNBGCASCAG-3′)和反向引物Modified Pro806R(5′-GGACTACNVGGGTWTCTAAT-3′)对提取的23个样品DNA进行16S rRNA基因V3+V4区扩增[13-16],把不同barcode加在反向引物5′端区分不同样品,并在barcode和引物之间加入两个碱基(CA)作为连接。扩增反应体系为50 μL,变性温度95 ℃,退火温度55 ℃,延伸温度72 ℃,每步各30 s,共33个循环,再72 ℃延伸10 min。得到的PCR产物直接进行琼脂糖凝胶电泳检测,根据条带的位置判断PCR结果。
1.2.4 文库构建与高通量测序 依照电泳条带亮度按比例混样后电泳切胶回收纯化PCR产物。使用KAPA LTP Library 试剂盒进行二代高通量测序文库构建,并使用Illumina Miseq高通量测序平台测序。相关序列信息已提交到NCBI (PRJNA576040)。
1.2.5 高通量测序结果处理 测序获得的基因序列数据,首先使用Fast QC软件进行整体测序质量查看以及污染情况分析。序列整体分析主要使用QIIME(http://www.qiime.org)平台软件[17]。使用extract barcodes.py切除barcode序列;使用split libraries fastq.py根据切下的barcode序列进行分库;以Greengenes 13.8数据库为参照,使用identify chimeric seqs.py识别并移除嵌合体序列。采用Usearch V6.1方法,以Greengenes数据库作为参考序列[18],以97%的相似度cut-off,对序列进行可操作分类单元(Operational Taxon Units,OTU)分析。使用SILVA 132数据库注释OTU代表序列[19-21],获取分类信息表。通过各个样品进行alpha多样性分析,在计算alpha多样性的过程中,按照序列数最低的样品,对每个样品进行随机抽样后,分别给出Chao1、ACE、Shannon和Simpson数值。通过主成分分析(Principal Component Analysis,PCA)描述了各个样品各孔径滤膜上微生物群落之间的beta多样性,展示不同样品之间的聚类关系。
2 结果与分析
2.1 不同水体和不同截留孔径上的微生物多样性分析
通过对23个测序样品高通量测序获得46万多条序列,除去Singleton后共获得14 442个OTU,各样品测得序列进行抽样数为6 000的随机抽样后的alpha多样性见表2。其中井水的Chao1和ACE指数随着截留孔径的缩小而上升,表明井水样品微小微生物的多样性更高,特别是井水0.1 μm滤膜的Chao1、ACE、Shannon、Simpson指数比其他水体样本高,说明井水是研究超微小微生物的良好样本。
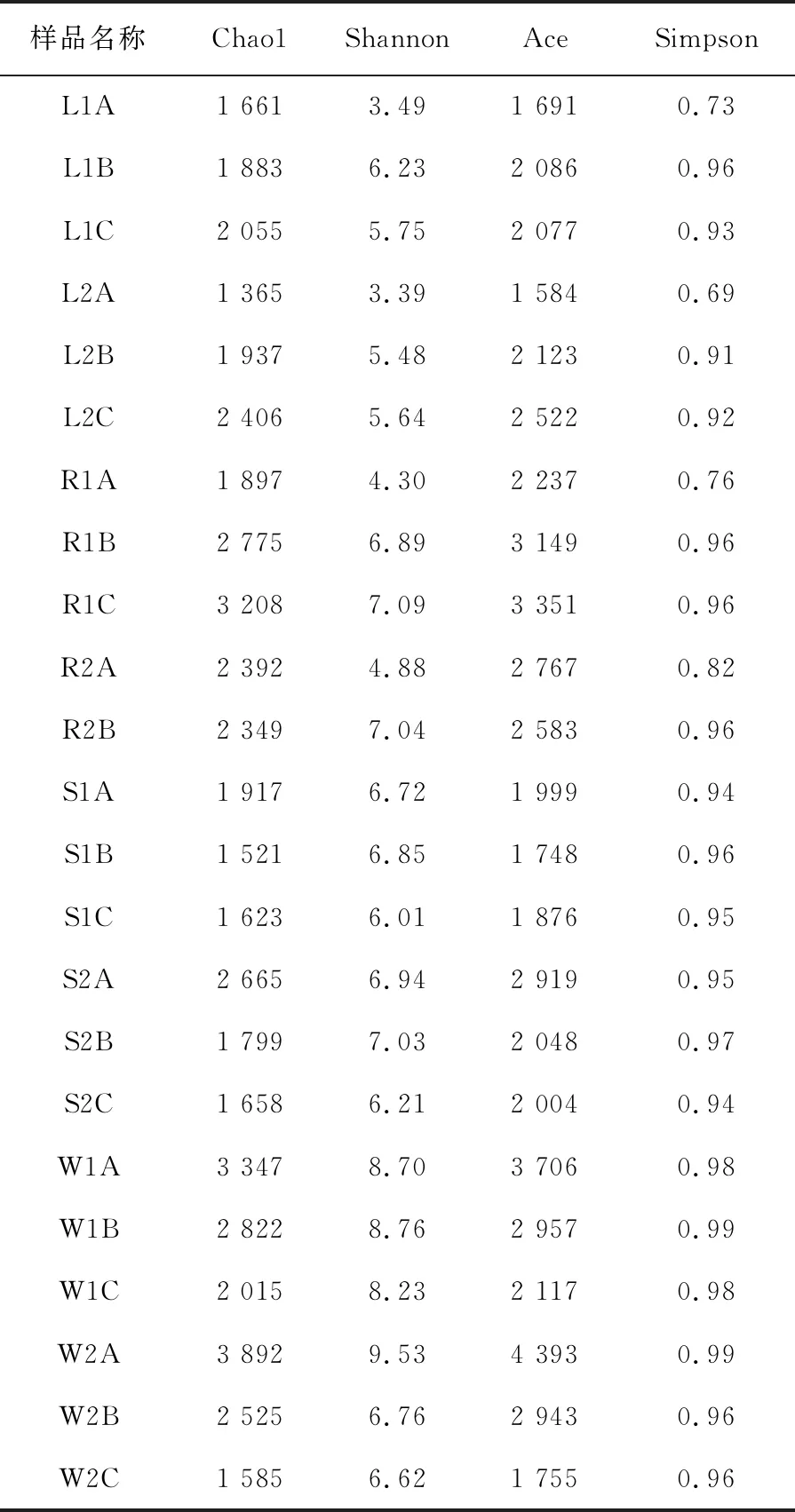
表2 四类自然水体多样性指数
样品微生物群落的PCA图(图2)表示了各类水体在不同孔径滤膜上微生物群落之间的聚类关系。湖水和河水同属于淡水和地表水,它们的微生物组成更加相似,海(岸)水与井水远离湖水和河水分别形成独立的聚类;相比湖水/河水/海(岸)水的不同孔径,井水中两个0.1 μm孔径(W1A、W2A)上所截留微生物群落明显区别于0.2 μm、1.2 μm的样品,结合alpha多样性分析的结果推测,井水中超微小微生物种类更多,具有与其他水样测序样品不同的微生物群落结构。
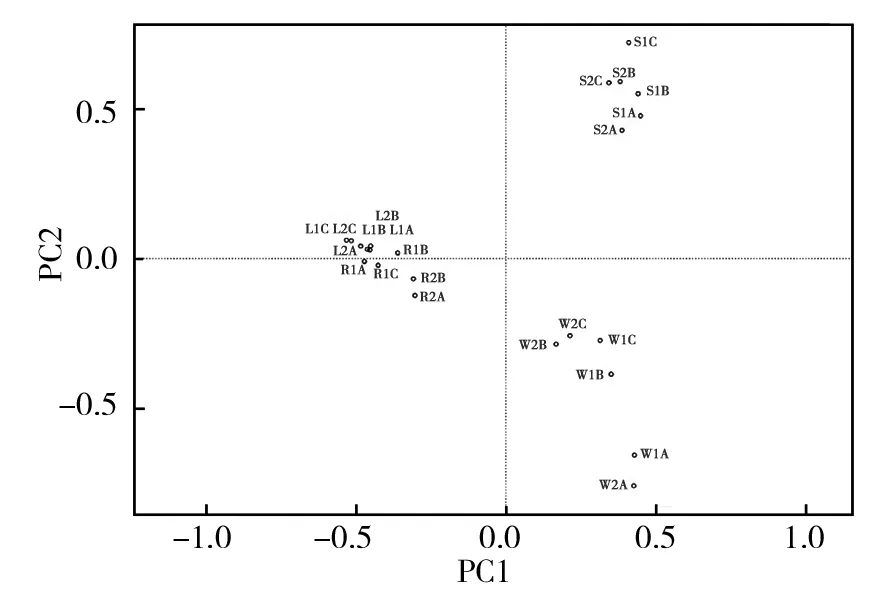
图2 四类自然水体PCA图Fig.2 PCA analysis of four type natural waters
2.2 不同水体和不同截留孔径上的优势微生物群落组成
由图3可知,湖水0.1 μm(L1A、L2A)中优势微生物依次是Proteobacteria门(51.8%、55.8%)和Actinobacteria门(44.1%、41.5%)细菌;0.22 μm(L1B、L2B)中优势微生物依次是Actinobacteria门(75.2%、79.7%)与Proteobacteria门(11.6%、8.1%)细菌;1.2 μm(L1C、L2C)中优势微生物依次是Actinobacteria门(50.9%、57.9%)、Proteobacteria门(27.4%、25.5%)和Cyanobacteria门(12.6%、6.0%)细菌。在属水平,湖水两个0.1 μm滤膜上优势的微生物均为Proteobacteria门SAR11 Clade目的Clade III,相对丰度为49.7%和54.3%;在0.22 μm和1.2 μm滤膜上均为Actinobacteria门Sporichthyaceae科的HgcI clade,相对丰度均在30%~40%左右。
河水中,0.1 μm(R1A、R2A)中优势微生物依次为Proteobacteria门(51.8%、65.9%)和Actinobacteria门(37.1%、25.1%)细菌;0.22 μm(R1B、R2B)中优势微生物依次是Actinobacteria门(69.1%、48.6%)和Proteobacteria门(21.1%、35.3%)细菌。在属水平,河水两个0.1 μm滤膜上优势的属为Proteobacteria门SAR11 clade目的Clade III,相对丰度为49.4%和40.6%;0.22 μm(R1B、R2B)中优势的属是Actinobacteria门Sporichthyaceae科的HgcI clade(34.1%、22.1%)和Actinobacteria门Ilumatobacteraceae科的CL500-29 marine group,相对丰度为29.2%和23.8%。河水与湖水不同孔径上的优势群落有相似性。
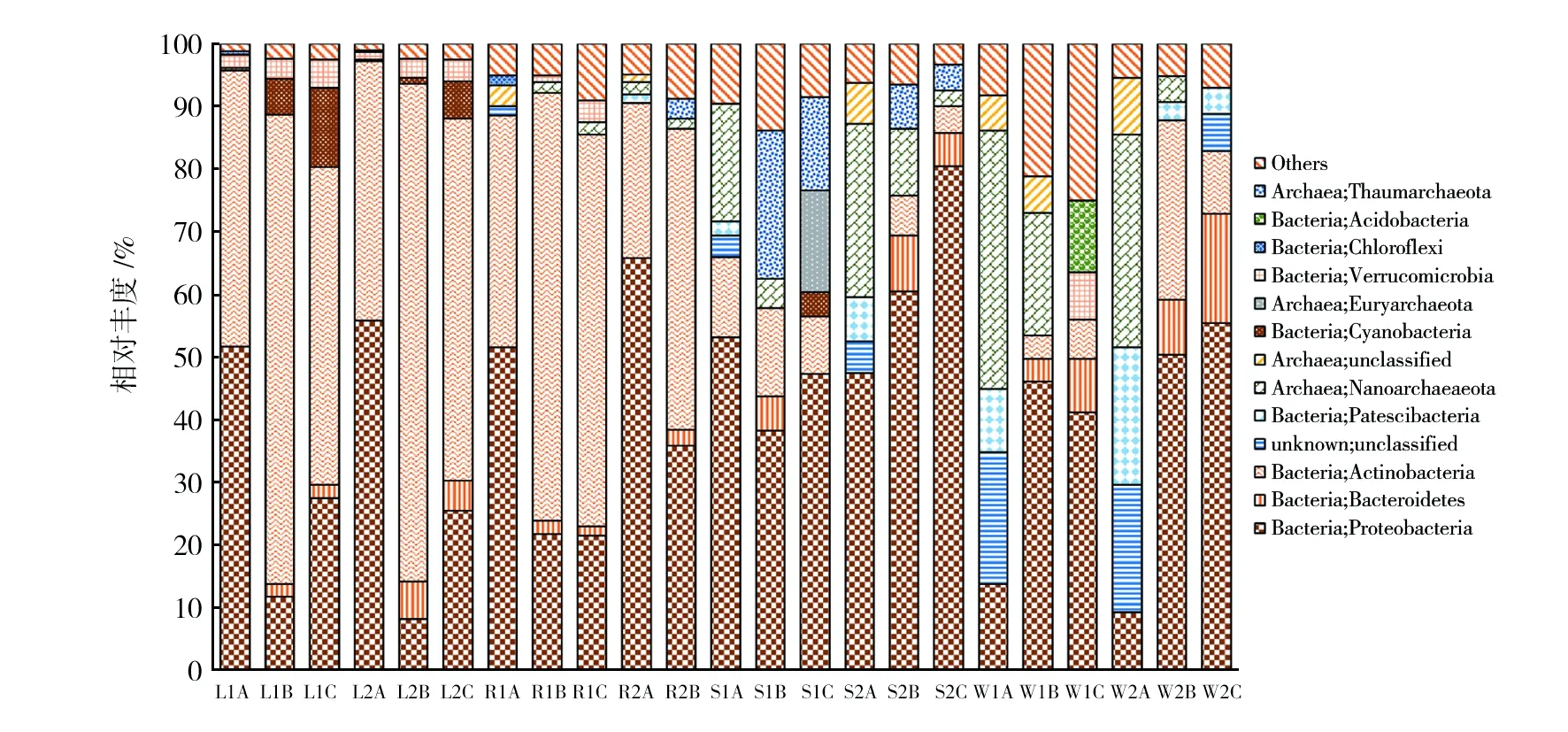
图3 不同截留孔径样品中优势原核微生物(门水平)Fig.3 Major prokaryotes in different retention filters (Phylum)
海(岸)水中,0.1 μm两个样品(S1A、S2A)中优势微生物依次是Proteobacteria门(53.1%、47.5%)和古菌Nanoarchaeota门(18.9%、27.8%);0.22 μm(S1B、S2B)中优势微生物是Proteobacteria门细菌(38.0%、60.4%),其次是Thaumarchaeota门古菌(S1B, 23.9%)或Nanoarchaeota门古菌(S2B,10.7%);1.2 μm(S1C、S2C)上丰度最高的是Proteobacteria门细菌(47.3%、80.5%),1.2 μm中第二优势的微生物是Euryarchaeota门古菌(S1C,16.3%)或Bacteroidetes门细菌(S2C,5.4%)。在属水平,海(岸)水样品两个0.1 μm(S1A、S2A)上优势的属为Proteobacteria门SAR11 clade的Clade Ia,相对丰度为34.6%和32.1%,以及Nanoarchaeota门Woesearchaeia古菌(17.7%、27.1%);但S1样品和S2样品在0.22 μm和1.2 μm滤膜上的属水平优势微生物差异较大,S1B优势的属是相对丰度为23.2%的Thaumarchaeota 门Nitrosopumilaceae科CandidatusNitrosopumilus属,S2B优势的属是相对丰度为17.5%的Proteobacteria门Rhodobacteraceae科Marivivens属;S1C上优势的属是Proteobacteria门SAR11 clade目的Clade Ia(18.2%),S2C上优势的属是相对丰度为27.6%的Proteobacteria门Rhodobacteraceae科一个未定的属。S1采自杭州湾远端的洋山港区,远离浦东海岸线近37 km,与采自浦东南汇东滩的海岸水S2优势微生物群落在门水平上有一定的相似性,在属水平出现差异;但是0.1 μm上的优势微生物的相似性无论是门水平还是属水平都比更大孔径高。
井水0.1 μm(W1A、W2A)两个样品前四位优势微生物相似,均为Nanoarchaeota门古菌、未定域微生物、Patescibacteria超门和Proteobacteria门细菌,相对丰度合计大于80%。其中W1A和W2A上前三位的优势属一致,依次为Nanoarchaeota门Woesearchaeia属古菌(41.0%、34.3%)、未定域微生物(22.1%、21.8%)以及未分类古菌(6.0%、9.7%)。在0.22 μm(W1B、W2B)中优势微生物一致的是Proteobacteria门(46.3%、50.5%),W1B中第二优势的微生物是Nanoarchaeota门古菌(19.8%),W2B中第二优势的微生物是Actinobacteria门细菌(29.2%);W1B上优势的属是Nanoarchaeota门Woesearchaeia属古菌(17.5%),其次是相对丰度16.9%的Proteobacteria门Sphingomonadaceae科未分类细菌,W2B上优势的属是相对丰度34.7%的Proteobacteria门Burkholderiaceae科未分类细菌,其次是Actinobacteria门Sporichthyaceae科候选属细菌(14.5%)。在1.2 μm(W1C、W2C)中优势微生物都是Proteobacteria门细菌(41.0%、55.6%);在W1C中优势的属是相对丰度9.1%的Acidobacteria门Blastocatellia[Subgroup 4]纲11-24候选属、Proteobacteria门Xanthobacteraceae科未分类属(8.7%)、Proteobacteria门Sphingomonadaceae科未分类属(8.5%),在W2C上优势的属是Proteobacteria门Methylomonaceae科未分类属(15.7%)、Bacteroidetes门Chitinophagaceae科Sediminibacterium属(14.4%)和Proteobacteria门Sphingomonadaceae科未分类属(14.2%)。
整合每类水体3个孔径上古菌的相对丰度,古菌在湖水样品中仅为1%左右,河水样品中约为4%,海(岸)水样品中约为25%,井水样品中约为23%。在不同截留孔径上(见图4),井水0.1 μm滤膜上的古菌丰度相对于1.2、0.22 μm有明显的优势,优势种类是一类超微小古菌Nanoarchaeota门[22],在W1A和W2A中的丰度分别为41%和34%。
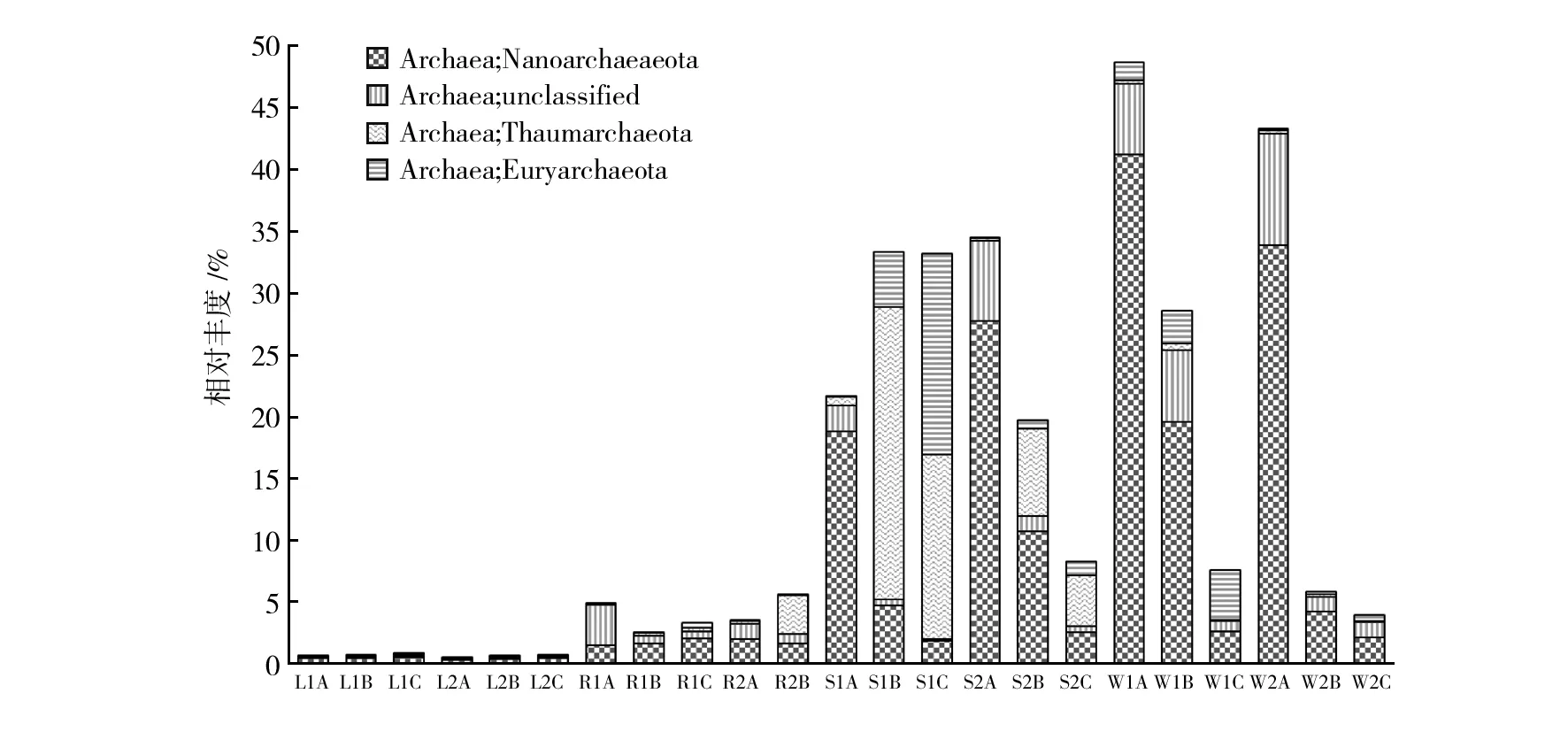
图4 不同截留孔径样品中优势古菌丰度Fig.4 Relative abundance of major archaea in different retention filters
在属水平观察四类水体0.1 μm上前两位优势超微小微生物分布其他截留孔径上的相对丰度,井水中的Nanoarchaeota门Woesearchaeia古菌和一类unclassified的微生物明显受到孔径的影响;河水与湖水中的Actinobacteria门Sporichthyaceae科的HgcI clade在3个孔径上丰度相近,未受不同截留孔径的影响;河水、湖水和海(岸)水三类水体中都是优势群落的SAR11 clade在0.1 μm上的丰度远高于0.22 μm,但是1.2 μm上的丰度也略高于0.22 μm。具体数据分布见图5。另外,属于超微小细菌Patescibacteria超门[4,11,23]在井水中其丰度随滤膜孔径的缩小而大幅上升(W1A/B/C:9.3%、2.4%、2.0%;W2A/B/C:20.9%、2.5%、3.7%)。
2.3 未定域原核微生物的分析
井水、海(岸)水中的未定域原核微生物(即软件分析结果不能准确定义是属于细菌域还是古生菌域)相对丰度分别为9%和2%,河水和湖水中则不到1%。进一步细分井水和海(岸)水不同的截留孔径,海(岸)水S1A中未定域原核生物的相对丰度为3.5%,S2A中为5%;而0.22 μm与1.2 μm样品中均不到1%;井水W1A中未定域原核微生物的相对丰度为21%,W2A中为20%,而0.22 μm与1.2 μm样品中均不超过6%,大部分未定域微生物集中在0.1 μm拦截的超微小微生物群落中。
将所有未定域和门水平未分类原核微生物的序列绘制系统发育树,展现这些未分类微生物与其他各类已知生物之间的亲缘关系。由图6可知,未定域微生物的16S rRNA基因聚类在古生菌(DPANN超门)附近形成了一个新的簇(Cluster)。
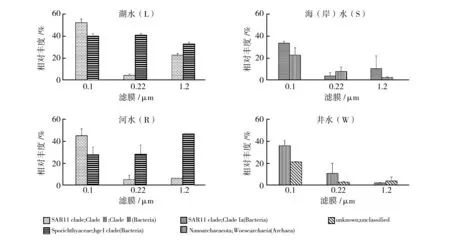
图5 0.1 μm滤膜上优势原核微生物在分级过滤中的分布(属水平)Fig.5 Distribution of 0.1 μm retained major prokaryotes in grading filtration (Genus)
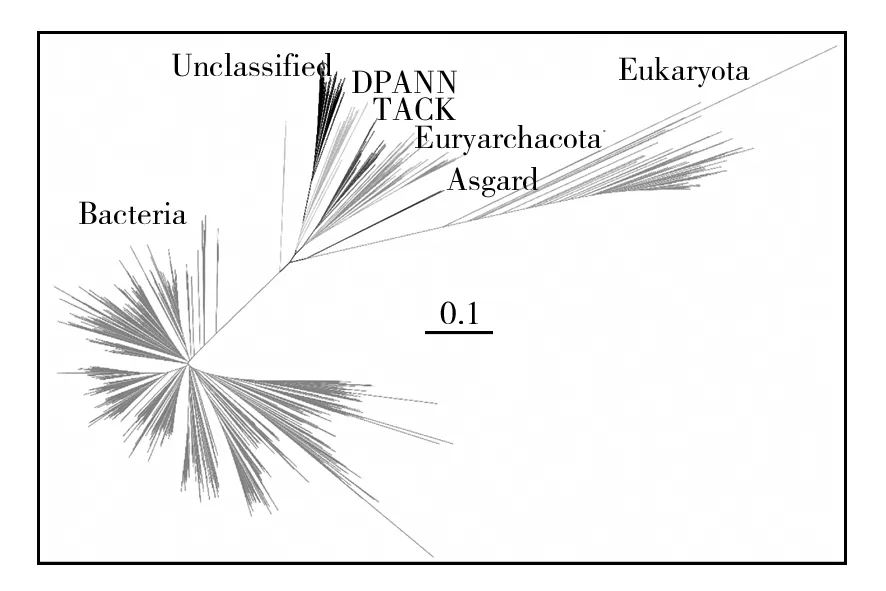
图6 未分类原核微生物系统发育树Fig.6 Phylogenetic trees of unclassified prokaryotes
3 讨 论
使用三种不同截留孔径、不同过滤面积的分级过滤装置,按照截留孔径和过滤面积从大到小分级梯度排布,以0.1 μm (直径47 mm)为终端截留孔径,并且滤膜过滤面积仅为上游0.22 μm滤膜面积的10%,等同于10倍浓缩了单位水体积里的超微小原核微生物浓度。多层次的分级过滤设计与传统的单级过滤相比增加了样品过滤量(容污量),从多样性指数看也提高了微生物群落的分辨率。相对于更大孔径,0.1 μm上古菌和未分类或未定域的微生物群落较为丰富。如果没有引入0.1 μm截留,研究中所发现的很多超微小微生物可能会被忽略。
本研究验证了分级过滤能将一些微生物群落根据尺寸大小进行相对分离的特性,但也发现并不能按照滤膜的标称孔径实现对微生物群落的精准分离[24-26]。一部分微生物群落在不同孔径上有不同丰度的分布,比如两个湖水样品中一类已有报道的超微小微生物Proteobacteria门SAR11 Clade微生物[27]在3个截留孔径上的丰度大不相同(L1A/B/C:49.7%、4.8%、23.6%;L2A/B/C:54.3%、3.2%、21.2%),0.1 μm(L1A、L2A)上高达50%的丰度验证了分级过滤的设计思想,但在1.2 μm滤膜上出现了比0.22 μm更高的丰度,这可能因为这些微生物更容易附着在颗粒物上或者成簇[28];同样湖水样品中另一类优势微生物Actinobacteria门Sporichthyaceae科hgcI clade属在3个截留孔径上的丰度却都相近(L1A/B/C:41.5%、41.7%、33.8%;L2A/B/C:38.3%、39.6%、30.7%)。这可能是同类微生物在不同生长阶段其大小和形态也可能不同[28],从而表现出不同的可过滤性。
井水0.1 μm上检测到的未定域微生物值得深入研究。从系统发育树上看这部分微生物序列单独聚成一簇,区分于其他古生菌门。可使用全长rRNA翻转建库的方法[29]获取全长rRNA进一步明确其分类地位,并通过宏基因组测序获得基因组信息,了解这些微生物功能基因以及代谢功能。
0.1~0.22 μm是原核微生物和病毒个体大小的交界区域[30],小于0.1 μm粒径的多是病毒类微生物,所以本研究设计之初选取了0.1 μm作为超微小微生物终端截留孔径,而不是更小的截留孔径,但是否有能穿过0.1 μm截留孔径的原核微生物,过往有研究和实践证明了这种可能性的存在[31-35]。未来对于水体超微小微生物群落的研究可以进一步引入小于0.1 μm的纳米级过滤膜,比如50 nm和20 nm过滤膜,更小的截留孔径能更完全地截留更微小的微生物。
但是更小的截留孔径意味着更大的过滤阻力(反压)、更慢的过滤速度和更小的单位膜面积处理的水样体积;这些因素给大体积水体过滤实验本身带来挑战,通过寻找可滤性和截留性能更优异的过滤材料以及优化实验工程设计,比如多级并联和分级串联过滤的结合,也许能探索出合适的整体解决方案。