一种快速高效获取丝状真菌PCR反应模板的方法
刘 柳, 张 琨, 邓百万*, 万 一*
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西省微生物研究所 分子生物学研究中心,陕西 西安 710043;3.陕西省科学院 秦岭天然产物工程中心,陕西 西安 710043)
丝状真菌种类繁多,广泛存在于地球生物圈中,是整个生态系统的重要组成部分[1]。作为重要的生物资源,丝状真菌在工业[2]、医药[3]、食品[4]、生物防治[5]、生态环境[6]等方面具有重要的应用价值。对丝状真菌的开发利用首先需要对菌种进行分类鉴定,高效获取丝状真菌PCR反应模板是对其进行分类鉴定的必要条件[7]。由于丝状真菌细胞壁成分复杂,结构特殊,尤其是较高的几丁质含量增加了细胞壁的抗逆性,难以释放出菌体DNA,因此,获取PCR反应模板的过程较为复杂[8]。目前,最常用的方法是利用十六烷基三甲基溴化铵(CTAB)法[9-10]、十二烷基磺酸钠(SDS)法[11]、氯化苄法[12]、尿素法[13]、蜗牛酶法[14]等获取丝状真菌基因组DNA作为PCR反应模板。上述方法虽然适用于绝大部分丝状真菌,但操作耗时费力,并且不同方法适用的丝状真菌类群存在差异[15],不适合丝状真菌的批量、快速鉴定。为了提高丝状真菌PCR鉴定效率,快速高效获取丝状真菌PCR反应模板显得尤为重要。研究表明,玻璃珠法可以借助玻璃珠之间相互振动挤压及剪切力快速破碎细胞壁[16];加热裂解法可以利用产生的高温达到裂解细胞壁的目的[17]。另有研究报道,Chelex-100作为阳离子螯合树脂在高温、低离子强度下可以络合金属离子,避免模板DNA 降解,快速获取用于PCR反应模板的DNA[18-21]。本文结合相关研究经验,通过多次实验摸索,利用机械破壁仪联合微波炉共同作用对丝状真菌细胞壁进行裂解,快速获得PCR反应模板,提高丝状真菌PCR鉴定效率。
1 材料与方法
1.1 材料
1.1.1 菌种 本实验室分离自秦岭昆虫体内13株不同种属的丝状真菌:绳状篮状菌(Talaromycesfuniculosus)、澳大利亚腔孢菌(Cochliobolusaustraliensis)、层生镰刀菌(Fusariumproliferatum)、易脆毛霉(Mucorfragilis)、鲁本斯青霉(Penicilliumrubens)、皱折裸胞壳(Emericelladentata)、链格孢菌(Alternariaalternata)、平脐蠕孢属(Bipolaristetramera)、黄曲霉(Aspergillusflavus)、枝状枝孢菌(Cladosporiumcladosporioides)、歧皱青霉(Penicilliumsteckii)、黑曲霉(Aspergillusniger)、拟康宁木霉(Trichodermakoningiopsis),如图1所示。

图1 实验菌株图片Fig.1 The pictures of experimental strain1:绳状篮状菌;2:澳大利亚腔孢菌;3:层生镰刀菌;4:易脆毛霉;5:鲁本斯青霉;6:皱折裸胞壳;7:链格孢菌;8:平脐蠕孢属;9:黄曲霉;10:枝状枝孢菌;11:歧皱青霉;12:黑曲霉;13:拟康宁木霉1:Talaromyces funiculosus;2:Cochliobolus australiensis;3:Fusarium proliferatum;4:Mucor fragilis;5:Penicillium rubens;6:Emericella dentata;7:Alternaria alternata;8:Bipolaris tetramera;9:Aspergillus flavus;10:Cladosporium cladosporioides;11:Penicillium steckii;12:Aspergillus niger;13:Trichoderma koningiopsis
1.1.2 主要试剂及仪器 引物ITS1、ITS4由上海捷瑞生物有限公司合成,ITS1:5′-TCCGTAGTTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGA-
TATGC-3′,10×Buffer TE由实验室自配,2×TaqMaster Mix(上海捷瑞生物有限公司),5×Loading Buffer(上海捷瑞生物有限公司),250 bp Maker(上海捷瑞生物有限公司),真菌基因组试剂盒(北京天根生化科技有限公司),Chelex-100(Sigma 公司),钢珠(d=5 mm,QIAGEN Hilden)机械破壁仪(TissueLyser LT、QIAGEN Hilden),微波炉(WD700TL23-K5,格兰仕微波炉电器有限公司),离心机(XI,基因公司),酶标仪(EPOCH2,BioTek),PCR扩增仪(T100TM,BIO-RAD),凝胶电泳仪(DYY-100,北京市六一仪器厂),凝胶成像系统(ChemiDoc XRS+,BIO-RAD)。
1.2 方法
1.2.1 菌种活化 将菌株接种于PDA培养基中,28 ℃恒温培养3~4 d。
1.2.2 PCR反应模板制备 在无菌操作台,取100 μL 10×Buffer TE(100 mmol/L Tris-HCl, 10 mmol/L EDTA, pH 8.0)于2 mL离心管中,用无菌接种环挑取少半环菌丝体,迅速震荡混匀,加一颗无菌钢珠,先采用机械破壁仪进行机械破壁,随后对其进行微波处理,待其温度降至室温,离心获取上清液作为PCR反应模板。
1.2.3 机械破壁联合微波法条件优化 选取常见丝状真菌黑曲霉Aspergillusniger为实验菌株,以PCR产物量为指标,以30 Hz机械破壁2 min,微波560 W裂解5 min为基础条件[22],采取单因素法对机械破壁频率(20、30、40、45、50 Hz)、机械破壁时间(0.5、1、2、3、4 min)、微波裂解功率(140、420、560、700 W)、微波裂解时间(1、3、5、8、10 min)进行优化,筛选出机械破壁联合微波法获取PCR反应模板的最佳条件。
1.2.4 ITS序列扩增及PCR产物量分析 分别将上述不同条件下得到的PCR反应模板进行ITS序列扩增。反应体系为30 μL:2×TaqMaster Mix 15 μL,引物ITS1 0.5 μL,引物ITS4 0.5 μL,DNA模板3 μL,ddH2O 11 μL。反应程序:94 ℃预变性5 min,94 ℃变性30 s,54.5 ℃退火30 s,72 ℃延伸30 s,35个循环,72 ℃终延伸10 min。PCR反应结束后,取3 μL PCR产物用于1%琼脂糖凝胶电泳检测扩增结果,并以Maker条带浓度为对照(标准带浓度为10 ng/μL、加亮带浓度为25 ng/μL),通过Image Lab进行PCR产量分析。
1.2.5 快速获取丝状真菌PCR反应模板方法的比较 采取上述实验得到的机械破壁联合微波法的最佳条件获取13株不同种属丝状真菌的PCR反应模板,同时与机械破壁法、Chelex-100法得到的模板作对比,以试剂盒抽提法得到的基因组DNA为模板作阳性对照,进行ITS序列扩增及目的条带浓度分析,目的条带清晰并在500~750 bp之间可认为扩增成功。将扩增产物送至上海生工进行测序,并对结果进行BLAST比对分析。
机械破壁法:参照文献[21],取少半环菌丝体于装有200 μL 10×Buffer TE的2 mL离心管中,加入一颗钢珠,涡旋震荡5 min后置于机械破壁仪中破壁2 min,12 000 r/min 离心2 min取上清液作为PCR反应模板。
Chelex-100法:参照文献[19],取少半环菌丝体于装有200 μL 10% Chelex-100溶液的2 mL离心管中,涡旋震荡10 s,沸水浴10 min,冷却至室温后12 000 r/min 离心2 min取上清液作为PCR反应模板。
2 结果与分析
2.1 机械破壁联合微波法条件优化结果
机械破壁联合微波法在不同条件下得到的结果如下:机械破壁频率在40 Hz时,目的条带最亮且PCR产物量最高为100.334 ng(图2A、表1);机械破壁时间在2 min时,目的条带最亮且PCR产物量最高为82.868 ng,但1 min时,目的条带清亮、PCR产物量为81.726 ng,与2 min时相差不大,从快速的角度考虑选取1 min为最佳机械破壁时间(图2B、表2);微波裂解功率在700 W时目的条带最亮且PCR产物量最高为76.872 ng(图2C、表3);微波裂解时间在3 min时目的条带最亮且PCR产物量最高为128.516 ng(图2D、表4)。综上所述,机械破壁联合微波法的最佳条件为40 Hz机械破壁1 min,微波700 W高温裂解3 min。
2.2 快速获取丝状真菌PCR反应模板方法的比较
2.2.1 ITS序列扩增结果 对4种方法得到的PCR反应模板进行ITS序列扩增后,经琼脂糖凝胶电泳检测,结果如图3所示。采用Chelex-100法获取的PCR反应模板可成功扩增6株丝状真菌的ITS序列,扩增率虽然较低,但目的条带明亮、清晰(图3A1、A2);采取机械破壁法获取的PCR反应模板,虽成功扩增9株丝状真菌的ITS序列,但目的条带明亮度和清晰度明显低于其他3种方法(图3B1、B2);试剂盒抽提法获取的PCR反应模板可成功扩增13株丝状真菌的ITS序列,且目的条带明亮、清晰(图3C1、C2);机械破壁联合微波法获取的PCR反应模板成功扩增13株丝状真菌的ITS序列,且目的条带明亮、清晰(图3D1、D2)。因此,机械破壁联合微波法可快速、高效获取丝状真菌PCR反应模板。
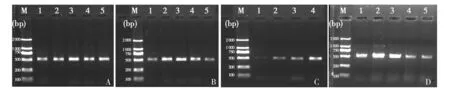
图2 ITS序列扩增结果Fig.2 The results of ITS sequence amplificationM:250 bp Maker; A:不同机械破壁频率(泳道1~5:20、30、40、45、50 Hz); B:不同机械破壁时间(泳道1~5:0.5、1、2、3、4 min); C:不同微波裂解功率(泳道1~5:140、420、560、700 W); D:不同微波裂解时间(泳道1~5:1、3、5、8、10 min)M: 250 bp Maker; A: Different mechanical wall-breaking frequency (lane1-5: 20,30,40,45,50 Hz); B: Different mechanical wall-breaking time (lane1-5: 0.5,1,2,3,4 min) ; C: Different microwave power (lane1-5: 140,420,560,700 W); D: Different microwave time (lane1-5: 1,3,5,8,10 min)
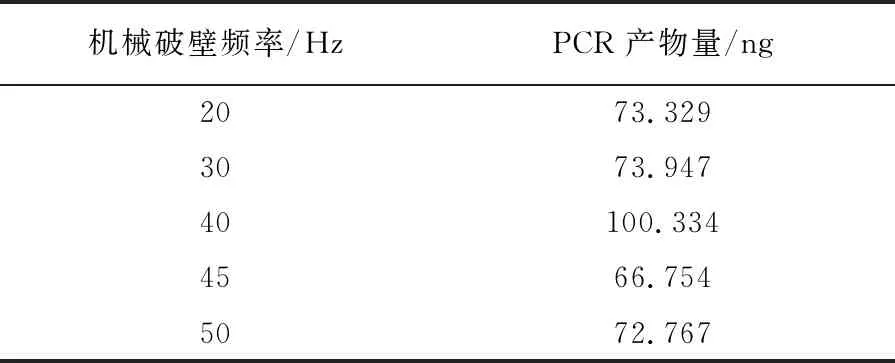
表1 不同机械破壁频率对PCR产物量的影响
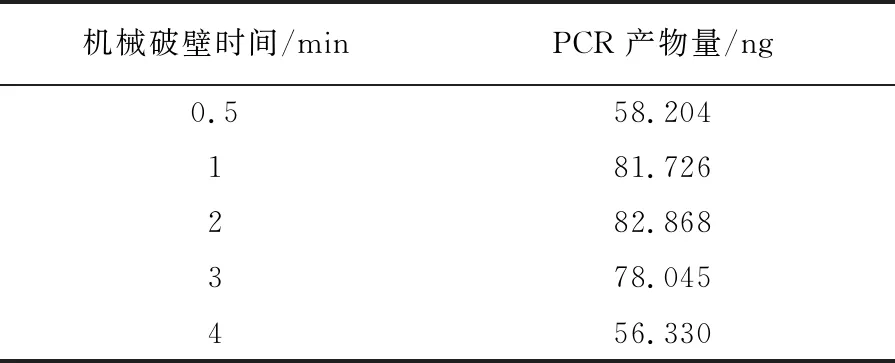
表2 不同机械破壁时间对PCR产物量的影响
2.2.2 PCR扩增量及产物测序结果分析 结果如表5所示,机械破壁联合微波法获取的PCR反应模板扩增后的目的条带质量浓度菌株1、2、8、10、11、12与试剂盒抽提法相当,菌株3、4、5、6、7、9、13虽低于试剂盒抽提法,但条带质量浓度均大于20 ng/μL。

表3 不同微波裂解功率对PCR产物量的影响
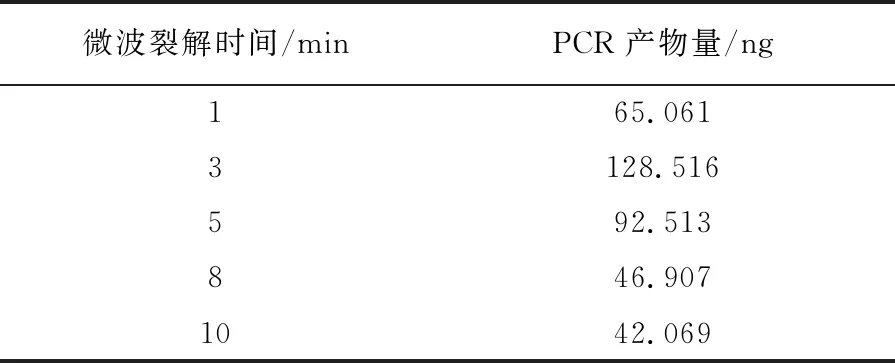
表4 不同微波裂解时间对PCR产物量的影响
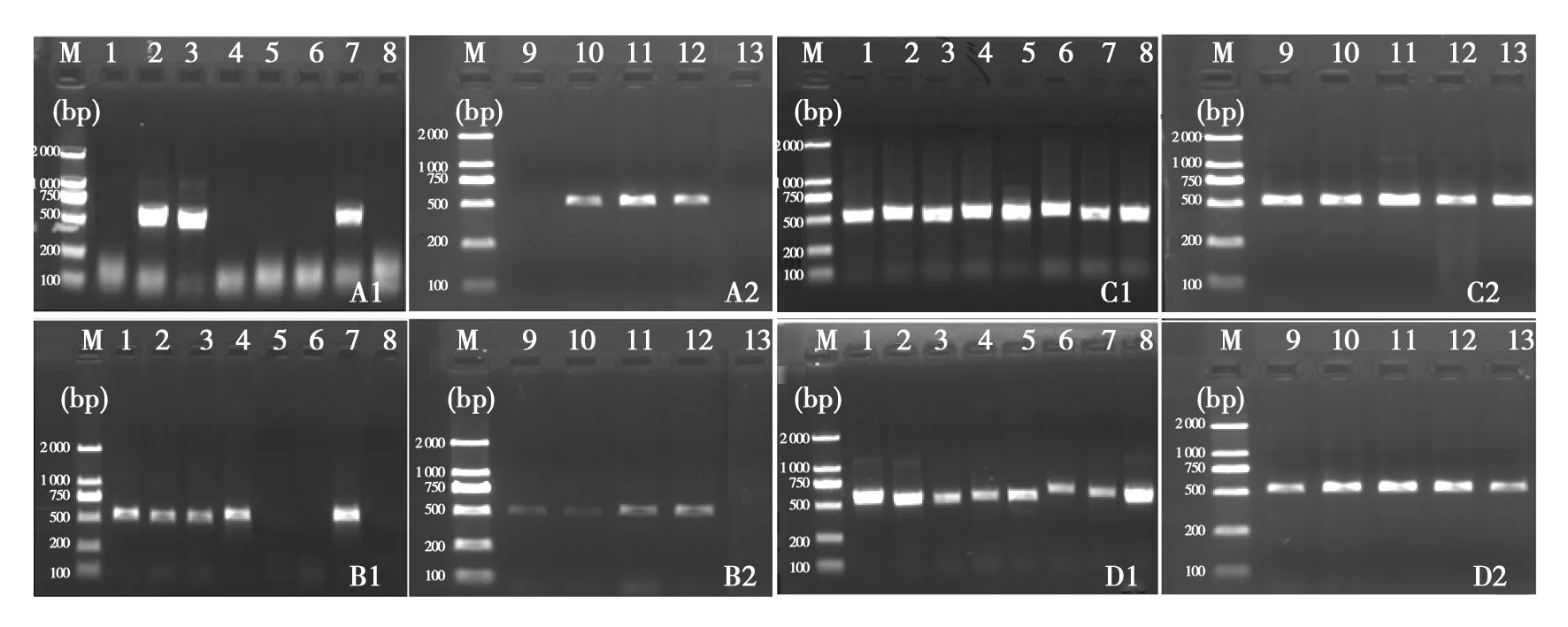
图3 ITS序列扩增结果 Fig.3 The results of ITS sequence amplificationM:250 bp Maker; 1~13:13株实验菌株; A1、A2:Chelex-100法; B1、B2:机械破壁法; C1、C2:试剂盒抽提法; D1、D2:机械破壁联合微波法M: 250 bp Maker; 1-13:13 experimental strains; A1,A2: Chelex-100 method; B1,B2: Mechanical wall-breaking method; C1,C2: Kit method; D1,D2: Mechanical wall-breaking united microwave method
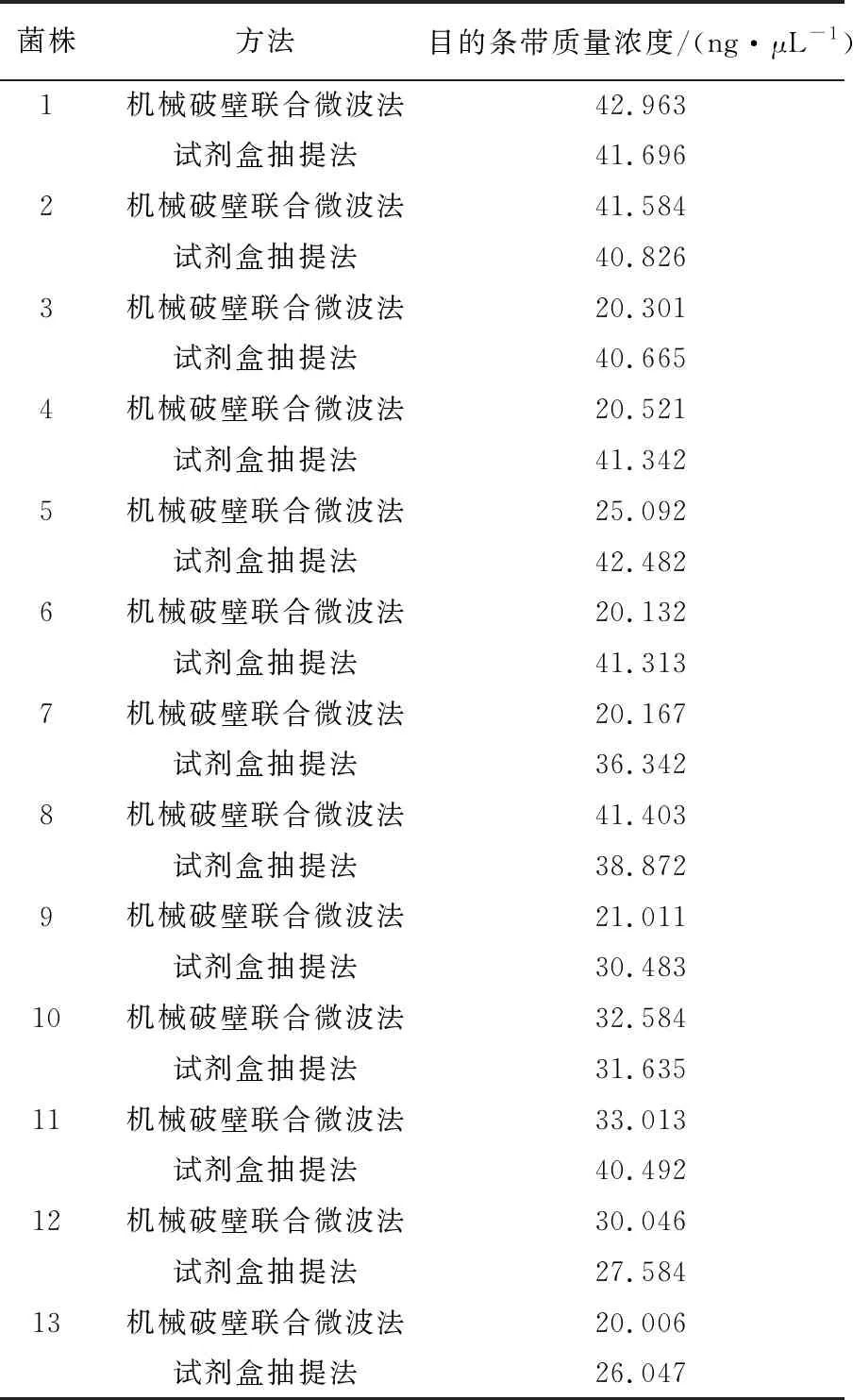
表5 目的条带质量浓度测定结果
机械破壁联合微波法、试剂盒抽提法获得模板的PCR扩增产物送上海生工测序,测序结果进行BLAST比对分析,机械破壁联合微波法同试剂盒抽提法得到的鉴定结果一致。因此,机械破壁联合微波法可快速、高效获取用于丝状真菌PCR反应的正确模板。
3 讨 论
要提高丝状真菌PCR鉴定效率,首先需要快速高效获取PCR反应模板。我们通过大量实验建立了机械破壁联合微波法获取丝状真菌PCR反应模板的方法,以PCR产物量为指标,以常见丝状真菌黑曲霉为实验菌株,对机械破壁联合微波法的机械破壁频率、机械破壁时间、微波裂解功率、微波裂解时间进行条件优化,得到了机械破壁联合微波法获取丝状真菌PCR反应模板的最佳条件:40 Hz机械破壁1 min,微波700 W高温裂解3 min。
采取优化的机械破壁联合微波法获取13株不同种属丝状真菌的PCR反应模板,与已报道的多个快速获取方法作比较,同时以试剂盒抽提法作为阳性对照,进行ITS序列扩增及结果分析。结果显示,Chelex-100法获取的模板进行扩增后虽然目的条带明亮、清晰,但扩增成功率较低(46.2%),与李焕宇等[15]研究结果一致;机械破壁法扩增成功率(69.2%)虽然高于Chelex-100法,但扩增结果不理想;机械破壁联合微波法获取的模板效果良好,13株不同属的丝状真菌ITS序列均成功扩增(扩增成功率100%),且条带清晰明亮,PCR鉴定结果与试剂盒抽提法完全一致。
试剂盒抽提法是目前获取丝状真菌PCR反应模板最常用方法,但首先需对大量菌体进行液氮研磨,提取过程约需1 h,提取费时且成本高,不适合丝状真菌的批量、快速鉴定。本研究建立的机械破壁联合微波法仅需10 min即可获得丝状真菌用于PCR反应的扩增模板,效果与试剂盒抽提法相同,具备高效、低成本的优点。因此,机械破壁联合微波法可快速高效获取丝状真菌PCR反应模板,提高丝状真菌PCR鉴定效率。