3种粪便标本保存方法对肠道菌群检测结果影响的比较研究
贠 航, 胡闭月, 王 健, 郭仁妹, 王 丽*
(1.苏州大学 医学部护理学院,江苏 苏州 215006;2.苏州硒泰克生物科技有限公司研究中心,江苏 苏州 215123)
肠道菌群由寄居在宿主肠道内的各类菌群组成,在宿主免疫调节、新陈代谢等方面发挥着重要作用[1-2]。越来越多的证据表明,肠道菌群对人类健康有着潜在的影响。目前发现,肠道菌群不仅与克罗恩病、溃疡性结肠炎等胃肠道疾病有关[3-4],还可能引发肥胖、糖尿病、高血压等慢性疾病[5,7]。随着研究的深入,肠道菌群逐渐成为研究者关注的领域之一。粪便标本是研究肠道菌群的首选,因为它易获取,且不具有侵入性。通过提取粪便标本中的细菌DNA,并进行高通量测序,是了解肠道菌群多样性、组成等信息的重要环节。但粪便中的细菌DNA稳定性差,暴露在空气中或高温环境下易发生降解。-80 ℃冷冻被认为是保存粪便标本的最佳方法[8]。但在实际研究中,很难即刻收集新鲜标本,多数标本会在室温或其他环境下暴露一段时间。如果保存不当,细菌DNA降解会造成标本中菌群种类和多样性下降,严重影响最终的实验结果。研究指出,粪便标本4 ℃下保存24 h,菌群结构和立即放入-80 ℃冻存相似性较高[9-10]。Tedjo等[11]提出新鲜粪便标本室温下保存24 h,菌群结构与-80 ℃保存10 min保持高度相似。但同年Bahl等[12]提出,粪便标本于室温下放置30 min,菌群中拟杆菌数量会明显减少,而厚壁菌数量会明显增加。以往研究报道,乙醇可以用来保存动物粪便标本[13-14],并进行肠道菌群研究。但乙醇是否适合短时间内保存人类粪便标本,相关报道较少。因此,本研究拟用4 ℃、室温(25 ℃)、无水乙醇依次保存同一受试者的粪便标本,比较3种保存方法对肠道菌群检测结果的影响。
1 材料与方法
1.1 材料
1.1.1 标本来源 2018年11月在苏州市双塔街道卫生服务中心招募10名社区居民作为志愿者,平均年龄(68.38±3.88) 岁。其中,男性4名,女性6名。
1.1.2 试剂与仪器 无水乙醇(市售,中国),QIAamp PowerFecal DNA Kit试剂(12830-50, QIAGEN公司),QIAquick PCR purification kit试剂(QIAGEN公司),PCR扩增所用试剂(PCR-grade water、PCR master mix、Reverse primer、Template DNA),分光光度计(723型, 上海精密仪器公司)。
1.2 方法
1.2.1 粪便标本采集 粪便标本由志愿者在家中自行留取,研究人员向其发放一次性无菌治疗巾和5 mL无菌采集管(内含无菌勺)。具体方法:每名志愿者留取当日新鲜粪便置于无菌治疗巾上,避免尿液及外界微生物的污染,然后用无菌勺从粪便内部相同部位留取1 g(约黄豆大小)标本放于提前做好标记的采集管内,盖紧盖子,共留取6份。其中,2份放于采集管内即可(室温组);2份放于研究人员提前倒入3~4 mL无水乙醇的采集管内(无水乙醇组);2份在室温组的基础上,将采集管放入研究人员提前准备好的冰盒中(4 ℃组)。所有标本采集在排便后15 min内完成,并在各自保存方法中保存4 h后,统一放入-80 ℃低温冰箱冻存。
1.2.2 DNA提取及检测 粪便标本统一使用QIAamp PowerFecal DNA Kit试剂盒进行细菌DNA提取,并用723型分光光度计检测提取到的DNA。全部DNA提取完成后,寄送至中国科学技术大学合作实验室进行PCR扩增和Illumina MiSeq平台高通量测序。
1.2.3 PCR扩增及高通量测序 使用引物515FB(GTGYCAGCMGCCGCGGTAA)和806RB(GGACTACNVGGGTWTCTAAT)对细菌16S rRNA V4区基因进行PCR扩增。扩增试剂:PCR-grade water(13.0 μL),PCR master mix(10.0 μL),Forward primer(0.5 μL),Reverse primer(0.5 μL),Template DNA(1.0 μL)。扩增程序:94 ℃热变性3 min;94 ℃变性45 s,50 ℃退火60 s;72 ℃延伸90 s,持续35个循环;接着72 ℃延伸10 min,最后4 ℃终止。所有获得的PCR产物经过QIAquick PCR purification kit 纯化后,进行Illumina MiSeq平台测序。
1.2.4 生物信息学分析 首先使用Trimmomatic软件对高通量测序获得的16S rRNA序列进行质量控制,再使用Flash软件将序列根据overleap关系进行拼接,从而获取高质量序列。利用Vsearch软件依照97%相似性对序列进行OTU聚类,聚类时剔除嵌合体。利用Vsearch软件中的SINTAX算法对OTU序列进行分类学分析,并与Silva数据库(Silva128)比对,比对阈值为70%,最后获得每个OTU的注释信息。读取结果时,当菌群相对丰度≤0.1%时,归入Others。通过Mothur软件获得Alpha多样性指数。Qiime软件计算标本间unweighted unifrac和weighted unifrac距离矩阵,便于绘制PCoA图形。
1.2.5 统计学分析 采用Origin93_64和SPSS19.0软件进行数据分析和制图。计量资料符合正态分布采用均数±标准差表示,否则用中位数和四分位数间距表示。Alpha多样性指数比较采用单因素重复测量方差分析,组间两两比较采用LSD方法。肠道菌群门水平和属水平相对丰度比较采用Friedman检验。P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 标本序列及OTUs
本研究30个标本,经测序并对结果进行优化后,获得889 080条高质量16S rRNA序列,平均每个标本29 653条。根据97%的序列相似性聚类,划分出1 378个OTU。其中,室温组1 115个OTU,4 ℃组1 125个OTU,无水乙醇组996个OTU,763个OTU 为3组所共有。
2.2 Alpha多样性分析
由稀释性曲线(图1)可知,随着测序量增大,新增OTU数量逐渐趋于平缓,说明所得测序量合理,可以反映样本中菌群多样性。Alpha多样性包括:Ace、Chao、Shannon以及Simpson指数。其中,Ace和Chao指数反映标本中菌群丰度,即OTU数量。Shannon和Simpson指数反映菌群的多样性,包括菌群丰度和菌群均匀度。Alpha多样性分析,各指数具体数值如表1所示,3组Ace、Chao、Shannon以及Simpson指数之间无统计学差异(P>0.05)。
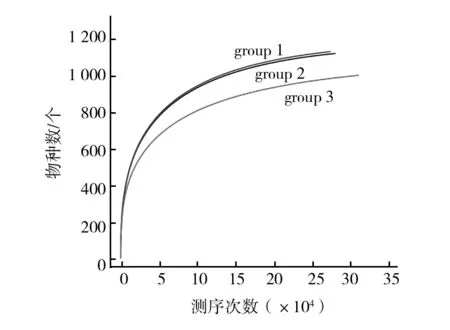
图1 稀释曲线Fig.1 Rarefaction curvesgroup1:室温组;group2:4 ℃组;group3:无水乙醇组。下图同group 1 represents the room temperature group, group 2 represents the 4 ℃ group, and group 3 represents the anhydrous ethanol group.The same below
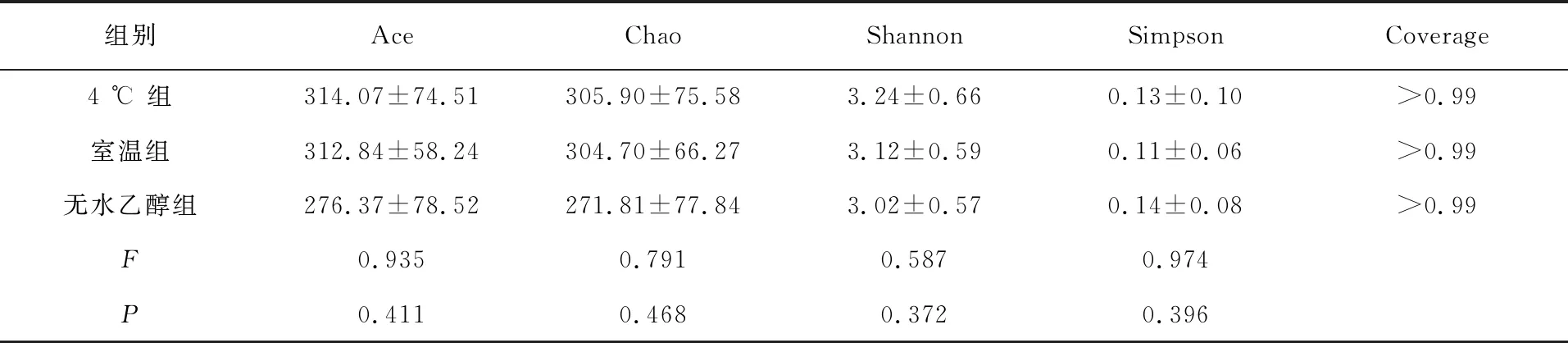
表1 肠道菌群Alpha多样性指数比较
2.3 肠道菌群门水平比较
肠道菌群门水平分布包括10个门(phylum),如图2所示,主要由拟杆菌门(Firmicutes)、厚壁菌门(Bacteroidetes)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)组成。其中,拟杆菌门占比最多,在4 ℃组、室温组和无水乙醇组分别占68.37%、75.54%、69.94%,厚壁菌门次之,分别占20.82%、13.46%、20.14%。尽管3组保存方法在门分类水平上无统计学差异,但室温组与4 ℃组和无水乙醇组相比,拟杆菌门相对丰度增加,厚壁菌门相对丰度减少;无水乙醇组变形菌门较4 ℃组和室温组相对丰度略有增加。
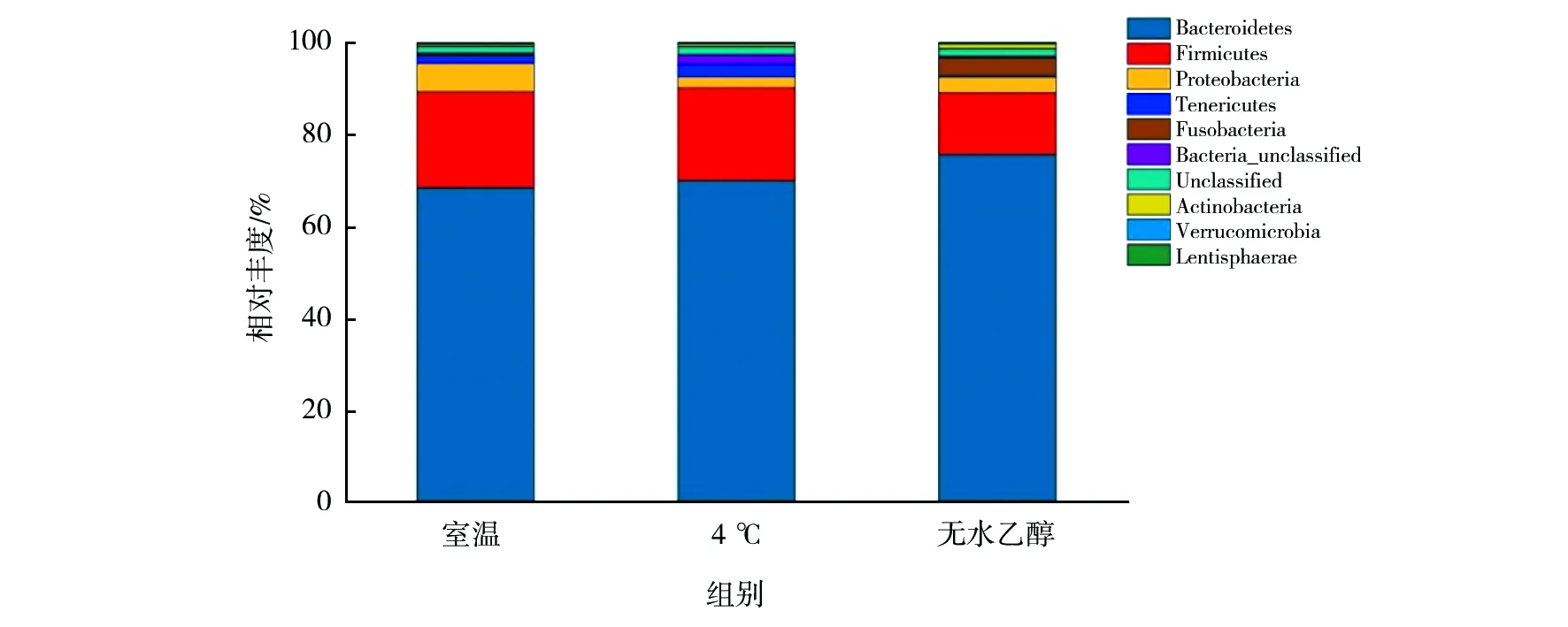
图2 肠道菌群门水平分布图Fig.2 Distribution of Gut microbiota in phylum level
2.4 肠道菌群属水平比较
肠道菌群属水平分布包括116个属(genus),其中36个菌属相对丰度≥0.1%。如图3所示,主要由拟杆菌属(Bacteroides)、普雷沃氏菌属(Prevotella)、瘤胃球菌属(Ruminococcaceae)、类普雷沃氏菌属(Parabacteroides)、另枝菌属(Alistipes)、对位普雷沃氏菌属(Paraprevotella)、毛螺旋菌属(Lachnospira)等优势菌属组成。其中,拟杆菌属占比最多,在4 ℃组、室温组、无水乙醇组分别占43.23%、52.49%、43.84%。如表2所示,菌属相对丰度比较,3组在毛螺旋菌属、萨特菌属(Sutterella)、真杆菌属(Eubacterium)存在差异。具体表现为毛螺旋菌属在无水乙醇组中相对丰度高于4 ℃组和室温组(P<0.05),萨特菌属在无水乙醇组中相对丰度高于4 ℃组(P<0.05),而真杆菌属在无水乙醇组中相对丰度低于室温组(P<0.05)。

图3 肠道菌群属水平分布图Fig.3 Distribution of Gut microbiota in genus level
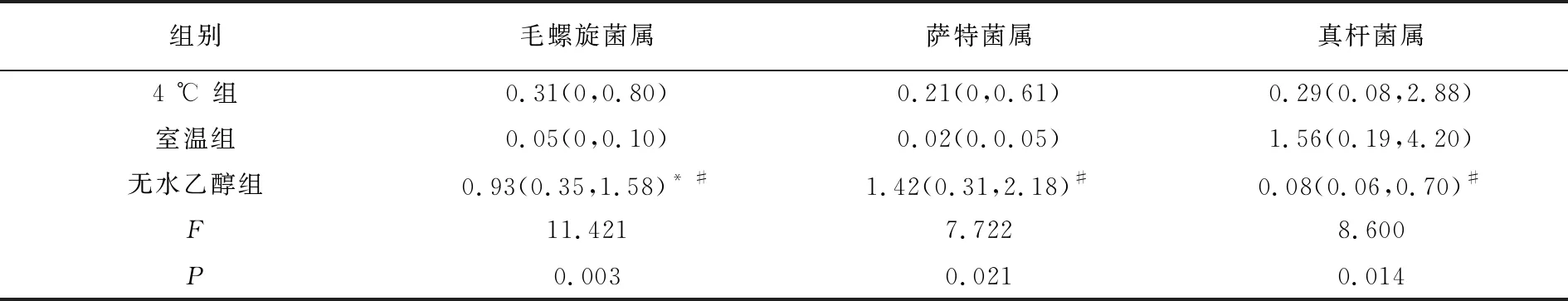
表2 肠道菌群属水平相对丰度比较[%,M(Q25~Q75)]
2.5 基于UniFrac的PCoA分析
基于UniFrac距离绘制PCoA图形,如图4所示。PCoA分析可以展示菌群在不同环境下的相似性和差异性。图4中每个点都代表1个个体菌群,点与点间距离大小代表菌群之间的相似性,距离越小越相似。基于UniFrac距离的unweighted和weighted主坐标分析,PC1和PC2贡献率分别为76.87%和8.93%、57.94%和23.69%。不同受试者的标本在相同保存方法下菌群未出现明显的聚集现象,说明标本间存在个体差异。由图4A观察到,3组保存方法有部分重合,说明菌群具有一定相似性。其中,4 ℃组和无水乙醇组相似性较强。UniFrac距离加权后,在图4B中发现,10名受试者中有8名受试者标本经4 ℃和无水乙醇保存后菌群呈现出聚集趋势,说明这两种方法对同一受试者标本保存效果较为接近。此外,有3名受试者标本经室温保存后,与4 ℃组和无水乙醇保存相比,菌群出现显著的离散现象。

图4 基于UniFrac距离的PCoA分析Fig.4 PCoA analysis based on UniFrac distanceA:未加权距离的PCoA分析;B:加权距离的PCoA分析A:PCoA analysis of unweighted distance;B:PCoA analysis of weighted distance
3 讨 论
研究肠道菌群时,粪便标本需要妥善保存,以保证实验结果的真实性。目前,常见的粪便标本保存方法包括冷冻(-80 ℃或-20 ℃)保存、低温(4 ℃)保存、室温保存等。-80 ℃冷冻是保存粪便标本的最佳方法[8],液氮可以满足-80 ℃的短期保存,但成本较高,只适合小样本收集。家庭或医院冰箱可以满足-20 ℃和4 ℃保存,但标本在转运至-80 ℃冻存过程中,如果脱离低温环境,标本可能出现冻融,引起菌群多样性降低[10]。室温短期保存粪便标本仍存在一定的争议。无水乙醇是一种常见的试剂,通过它保存粪便标本,能够快速凝固标本中的蛋白质,促进DNA水解酶失活[15],有助于获得高质量的细菌DNA[16]。但目前使用无水乙醇保存人类粪便并对肠道菌群展开研究的相关报道较少。因此,本研究对4 ℃、室温以及无水乙醇短期保存的粪便标本进行DNA提取,基于16S rRNA高通量测序,探讨3种粪便标本保存方法对肠道菌群检测结果的影响。
研究结果显示,3种保存方法对肠道菌群Alpha多样性和门水平分布的影响无显著差异。但属水平分布比较,毛螺旋菌属在无水乙醇组中相对丰度高于4 ℃组和室温组,萨特菌属在无水乙醇组中相对丰度高于4 ℃组。其中,无水乙醇组毛螺旋菌属相对丰度增加,可能与毛螺旋菌属能分解乙醇,供其生长发育有关。萨特菌属被报道在自闭症儿童肠道内明显增多[17-18]。说明当对毛螺旋菌属和萨特菌属展开研究时,无水乙醇保存粪便标本可能是最好的选择。此外,PCoA分析发现,UniFrac距离加权后,4 ℃和无水乙醇保存同一受试者粪便标本,菌群结果较为接近,室温保存会导致个别受试者菌群出现离散现象。由此说明相同条件下,无水乙醇和4 ℃保存效果优于室温保存。
低温保存是冷冻保存(-80 ℃或-20 ℃)外,短期保存粪便标本的主要方法,它能为菌群创造低温环境,降低DNA流动性和水解酶活性[19],但在收集和运输过程中较为麻烦。基于无水乙醇保存与4 ℃保存菌群相似性高,通过它替代4 ℃保存粪便标本能够显著减少工作量。同类研究指出,粪便标本室温下(25 ℃)保存24 h菌群结构与原始标本相比,相似度下降到80%以下[20]。而冷冻或乙醇保存标本,菌群结构与新鲜标本最为相似[21-22],并且乙醇室温下保存8周,也不会对菌群结构造成明显改变[21]。总的来说,使用无水乙醇短期保存粪便标本,肠道菌群多样性、组成以及结构保持稳定,能满足不同研究的需要。此外,无水乙醇具有价格低廉、易于携带等优点,适合大样本量收集标本。因此,当新鲜粪便标本不能立即低温冻存时,无水乙醇保存可以作为首要选择。
本研究不足之处主要包括两方面:首先,研究缺少-20 ℃和-80 ℃冷冻保存作为对照,未能验证3种保存方法的可靠性。其次,3种保存方法对应的保存时间较为单一,说服力不强。在后续研究中,将会增设-20 ℃或-80 ℃保存作为对照,同时适当延长各种保存方法的保存时间(如:延长至8、12、24 h等),进行更加详细的观察,寻找最佳保存方法和保存时间的组合。除此之外,还会将这些保存方法应用到不同疾病人群的粪便标本保存当中,以验证其适用性。