广西生榨米粉中益生乳酸菌的筛选及鉴定
李仁芳,蒙晓明,黄福卫,孙 宁*,黄 丽,杨 攀,李 玲
(1.皇氏集团华南乳品有限公司,广西 南宁530000;2.广西水牛乳工程技术研究中心,广西 南宁530000;3.广西壮族自治区水牛乳质量与安全控制技术工程研究中心,广西 南宁530001;4.中国农业科学院 广西水牛研究所,广西 南宁530001)
生榨米粉是广西地区具有地方特色的一种传统发酵食品,其一般以籼米为原料,经过浸泡、磨浆、自然发酵等工序,再将发酵好的米粉团人工压榨成细条状,煮熟后即可食用。和普通米粉相比,经过发酵后的生榨米粉口感爽滑筋道,且具有独特的酸香味,深受广大消费者所喜爱。2015年,生榨米粉被选入南宁市第六批市级非物质文化遗产名录,2016年被广西烹饪餐饮行业协会列为广西十大米粉之一[1]。已有研究发现,乳酸菌是米粉发酵过程中的优势菌群,并且是米粉性状风味发生改变的关键因素[2-3]。
鲜米粉发酵过程中的微生物种类具有多样性,李芸[4]从米粉浸泡发酵过程中筛选得到32株发酵乳杆菌(Lactobacillus fermentum)、6株植物乳杆菌(Lactobacillusplantarum)、1株热带假丝酵母(Candida tropicalis)和1株枯草芽孢杆菌(Bacillus subtilis),确定枯草芽孢杆菌作为优势菌;闵伟红等[5]从发酵米粉中筛选出一株杆状乳酸菌用于改善米粉的品质;李路遥[6]筛选得到大米发酵液中的优势菌株乳酸乳球菌(Lactococcus lactis)、唾液链球菌(Streptococuus salivarius)和植物乳杆菌(Lactobacillus plantarum);KOBAYASHI A等[7]研究发现,泰国发酵米粉中含有芽孢杆菌、酵母、霉菌和乳酸菌等微生物;UCHIMURA T等[8]研究发现,乳酸菌占总米粉分离细菌的40%~60%,典型的球菌有乳链球菌(Streptococcus lactis)、嗜热链球菌(Streptococcus thermophilus)及乳酸片球菌(Pediococcus acidilactici),杆菌主要有嗜酸乳杆菌(Lactobacillus acidophillus)、植物乳杆菌(Lactobacillusplantarum)及罗伊乳杆菌(Lactobacillusreuteri)。由此可见,传统发酵米粉中存在着优良的自然乳酸菌菌株,可以作为功能乳酸菌的筛选资源,而广西生榨米粉作为省内尤其在首府南宁深受消费者喜爱的传统发酵食品,对其功能乳酸菌的分离和益生特性分析鲜有报道,因此挖掘和分析生榨米粉中优势乳酸菌,可为丰富传统发酵食品源有益微生物菌菌种库及其利用提供技术支持。
本研究以广西传统发酵食品生榨米粉为材料,对其中所含有的乳酸菌进行分离、筛选和鉴定,并对不同菌株的益生特性进行检测,以期获得具有潜在工业化应用价值的优良乳酸菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
生榨米粉采集自广西南宁市周边的3个生榨米粉作坊,来源编号为XC、FD、PM。
1.1.2 化学试剂
放线菌酮(分析纯):北京陆桥技术股份有限公司;2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid ammonium salt),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(均为分析纯):美国Sigma Aldrich公司;凝胶琼脂(分析纯):上海玉博科技有限公司;DL 2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:日本Takara公司;Chelex-100纯化DNA提取试剂盒:美国Bio-Rad公司;细菌通用引物27f、1492r:苏州金唯智生物科技有限公司;2×EsTaqMasterMix(含染料):康为世纪生物科技有限公司;氯化钠、碳酸钙、氢氧化钠、浓盐酸、硫酸亚铁、铁氰化钾(均为分析纯):天津市博迪化工有限公司;磷酸氢二钠、磷酸二氢钠、无水乙醇(均为分析纯):天津市大茂化学试剂厂;三氯乙酸、30%过氧化氢、邻二氮菲(均为分析纯):成都市科龙化工试剂厂;牛胆盐(分析纯):广东环凯微生物科技有限公司。
1.1.3 培养基
MRS肉汤培养基、MRS固体培养基:青岛高科园海博生物技术有限公司。
1.2 仪器与设备
Biotek Epoch2微孔板分光光度计:美国伯腾仪器有限公司;SHP-150生化培养箱:上海精宏实验设备有限公司;PB-10 pH计:德国赛多利斯集团;SW-CJ-2F洁净工作台:苏州安泰空气技术有限公司;YM 50立式压力蒸汽灭菌器:上海三申医疗器械有限公司;Biofuge Stratos高速冷冻离心机、LP Vortex Mixer旋涡振荡器:美国赛默飞世尔科技公司;DYY-6D型电泳仪:北京市六一仪器厂;BIO-RAD C1000 Touch cthemal聚合酶链式反应(polymerase chain reaction,PCR)仪:伯乐生命医学产品(上海)有限公司;Ose-470p便携式蓝光凝胶成像系统:天根生化科技(北京)有限公司;ME204E分析天平:梅特勒-托利多仪器(上海)有限公司;C21-SDHCB39电磁炉:浙江苏泊尔股份有限公司。
1.3 方法
1.3.1 乳酸菌的分离
无菌条件下,称取生榨米粉团核心部分样品10 g,加入90 mL无菌生理盐水,涡旋振荡制备均匀悬浊液。采用无菌生理盐水依次进行10倍梯度稀释,获得10-2~10-7浓度的稀释样品。分别取10-3~10-7稀释度的样品各0.1 mL涂布于含有0.01%放线菌酮和2%碳酸钙的MRS固体培养基,37 ℃条件下恒温厌氧培养至长出菌落。采用接种环挑取有溶钙圈的单菌落在MRS固体培养基上划线纯化3次。观察纯化后的菌落形态,并对菌株进行革兰氏染色、过氧化氢酶反应实验和测定发酵液pH值。
1.3.2 乳酸菌供试菌液的制备
取待测乳酸菌冻存菌液100 μL接种于MRS肉汤培养基中,装液量6 mL/13 mL,37 ℃静置培养24 h。按2%(V/V)的接种量接种于MRS肉汤培养基中,装液量6 mL/13 mL,37 ℃静置培养24 h,活化至3代,使用磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)调整菌体浓度为1.0×108CFU/mL。
1.3.3 乳酸菌溶血性实验
将供试菌液划线于含有5%脱纤维羊血的血琼脂基础培养基中,37 ℃培养24 h,观察平板上菌落生成情况。
1.3.4 乳酸菌耐受性实验
(1)乳酸菌耐酸性实验
将供试菌液以2%(V/V)的接种量分别接种于pH值为2.0、2.5的MRS肉汤培养基中,装液量6 mL/13 mL,37 ℃静置培养24 h,将发酵菌液涂布于MRS固体培养基上,同时测定其发酵液在波长595 nm处的吸光度值[9],观察平板上是否有菌落生成。以未添加供试菌液为对照组,结果以实验组与对照组的吸光度差值表示。
(2)乳酸菌的胆盐耐受能力测定
将供试菌液以2%(V/V)的接种量接种于含有0.3%牛胆盐的MRS肉汤培养基中,装液量6 mL/13 mL,同时将供试菌液涂布于含有0.3%牛胆盐的MRS固体培养基上,37 ℃静置培养24 h,测定其发酵液在波长630 nm处的吸光度值[9],并观察固体平板上是否有菌落生成。以未添加供试菌液为对照组,结果以实验组与对照组的吸光度差值表示。
1.3.5 乳酸菌的体外抗氧化能力测定
样品处理:供试菌液在4 ℃条件下经8 000 r/min离心30 min,收集发酵上清液,即为菌株胞外分泌物,用0.45 μm的滤膜过滤,放入-80 ℃冰箱保存待测。
DPPH自由基清除能力的测定:胞外分泌物用超纯水稀释10倍,参照文献[10]所述方法进行测定。
ABTS自由基清除能力的测定:胞外分泌物用超纯水稀释10倍,参照文献[11]所述方法进行测定。
羟自由基的清除能力测定:胞外分泌物用超纯水稀释2倍,参照文献[12]所述方法进行测定。
超氧阴离子自由基的清除能力测定:胞外分泌物用超纯水稀释2倍,参考文献[13]所述方法进行测定。
还原能力测定:胞外分泌物用超纯水稀释5倍,参考文献[14]所述方法进行测定。
1.3.6 乳酸菌生长和产酸曲线的测定
将供试菌液以2%(V/V)的接种量接种于MRS肉汤培养基,装液量6 mL/13 mL,37 ℃恒温培养,每隔2 h测定各菌种发酵液的pH值及OD595nm值,并绘制产酸曲线和生长曲线。
1.3.7 乳酸菌的分子生物学鉴定
采用Chelex-100法[15]提取纯菌株的基因组DNA,以其为模板,参照文献[16]的方法对筛选菌株的16S rDNA序列进行PCR扩增,PCR扩增引物为细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环;72 ℃再延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,Ose-470p便携式蓝光凝胶成像系统成像,委托上海美吉生物医药技术有限公司广州分公司进行测序。测序结果经DNA Star软件整理,利用数据库EzBioCloud(http://www.eztaxon.org/)进行在线比对,选取同源性较高的模式菌株的16S rDNA序列,采用Mega5.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.8 统计分析
采用IBM SPSS 20.0进行统计分析和采用Duncan进行单因素方差分析,通过origin 9.1绘制图表,每个实验进行3次重复,结果以“平均值±标准差”表示。
2 结果与分析
2.1 乳酸菌的分离纯化
经过初步筛选,从3份不同来源的生榨米粉样品中共分离获得146株菌株,其中杆菌104株,球菌42株。所有菌株均无芽孢、革兰氏染色均呈阳性、过氧化氢酶试验均呈阴性,发酵液pH值为3.70~4.30,参照《乳酸细菌分类鉴定及实验方法》[17]初步鉴定这146株菌为乳酸菌。
2.2 乳酸菌的溶血性
对146株乳酸菌进行溶血试验,结果显示均为γ-溶血,可用于益生菌的筛选。
2.3 乳酸菌的耐受性
通过耐酸试验和耐胆盐试验,从146株乳酸菌中筛选出综合耐受能力较好的22株菌株,其耐受性结果见表1。
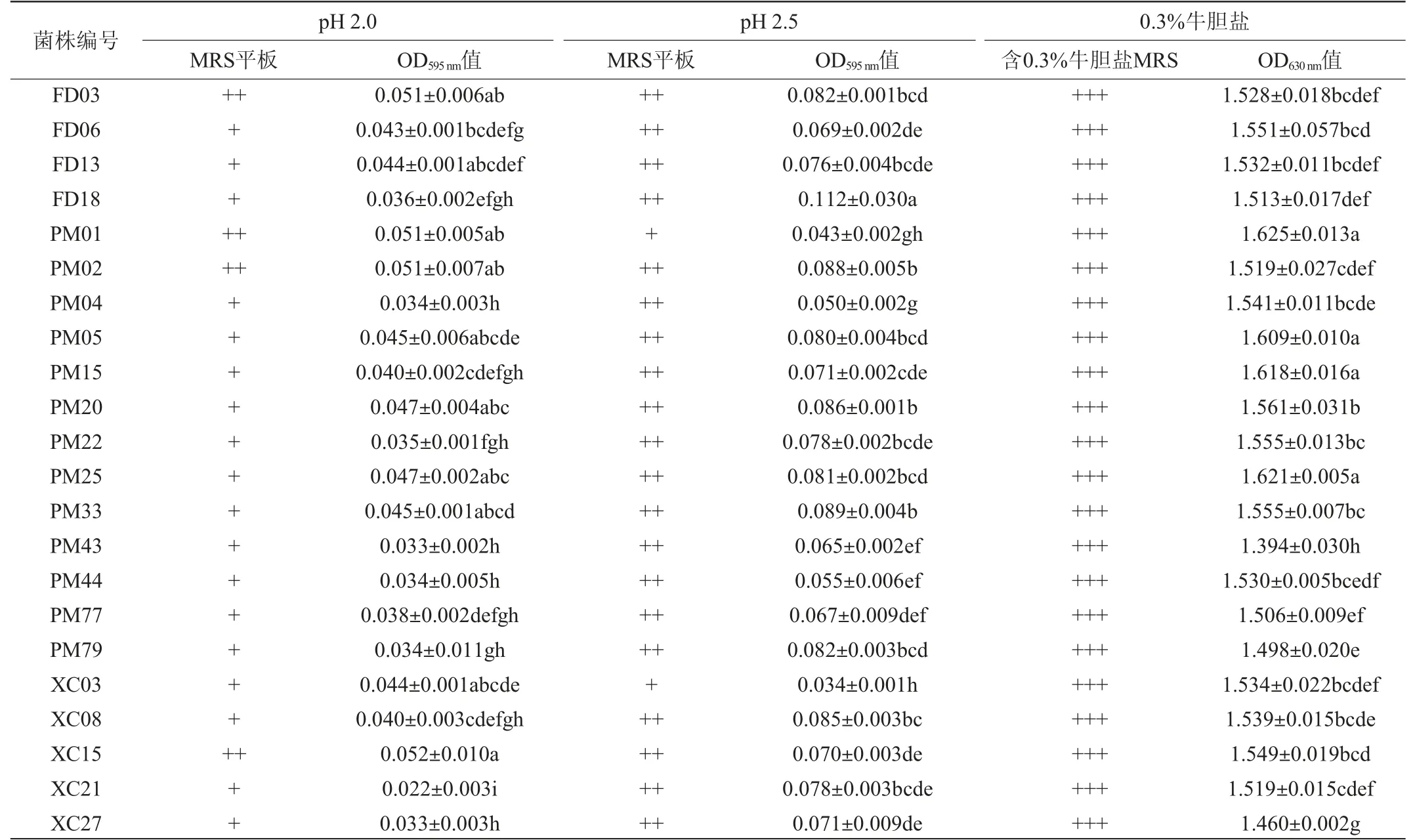
表1 22株菌株的耐受性结果Table 1 Tolerance results of 22 strains
根据饮食结构的不同,人体胃部的pH值维持在3.0左右[18]。此强酸环境下可抑制或杀死乳酸菌,而乳酸菌到达肠道前,必先经过胃酸环境。因此益生菌在人体胃液的条件下是否存活对其是否能够到达肠道起着决定性作用[19]。由表1可知,22株菌株在pH 2.0和pH 2.5条件下均能存活,都呈现了较强的耐酸性。根据MRS平板结果并参照柳青[19]的研究得出,在pH 2.0环境中,4株菌株长势良好,18株菌株长势一般,其中菌株XC21的耐受性显著低于其他菌株(P<0.05)。在pH 2.5环境中,20株菌株长势良好,2株菌株长势一般,其中菌株FD18的耐受性显著高于其他菌株(P<0.05)。除菌株PM01和XC03外,同一菌株在pH 2.5环境中的OD595nm值都低于pH 2.0中,说明菌株在低pH条件下生长受到抑制。分析原因可能是过低pH值下,菌体无法维持自身细胞内pH值的稳定,从而处于低生存状态,导致生长停滞,甚至衰亡[20]。
从表1亦可知,22株菌株在0.3%胆盐条件下培养,OD630nm值均>0.050,说明菌株在0.3%牛胆盐环境中长势良好,在添加0.3%牛胆盐的MSR固体培养基上长势非常好,菌株布满平板,都具有很好的胆盐耐受性。其中菌株PM01、PM25、PM15和PM05的OD630nm值>1.6,显著高于其他菌株(P<0.05)。不同菌株对0.3%牛胆盐的耐受能力存在差异,分析原因可能是菌株种属差异或生存环境长期影响所造成[21]。乳酸菌耐受胆酸盐的能力是其能在肠道中存活的必要条件,因此耐胆酸盐能力是益生菌微生物的一个重要特征[22]。人体小肠中胆盐浓度在0.03%~0.30%之间波动,功能菌进入胃肠道后需要有一定的胆盐耐受性才可有效发挥功效[23]。本试验中22株菌株有望在肠道消化过程中存活。
2.4 菌株的体外抗氧化能力
2.4.1 菌株胞外分泌物对DPPH和ABTS的清除能力
22株菌株的胞外分泌物对DPPH自由基和ABTS自由基的清除率结果见表2。
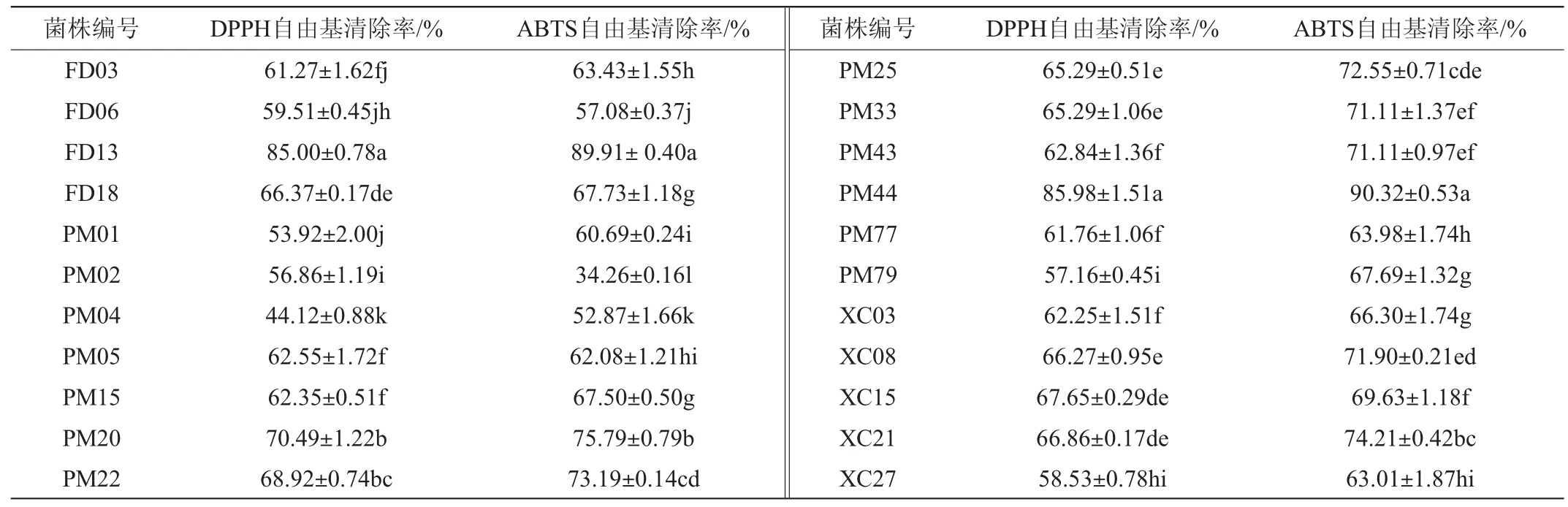
表2 22株菌株胞外分泌物对DPPH自由基和ABTS自由基的清除率Table 2 DPPH and ABTS free radical clearance rate of extracellular secretions of 22 strains
由表2可知,菌株PM44和FD13胞外分泌物稀释10倍后对DPPH自由基和ABTS自由基的清除率均>85%,显著高于其他菌株(P<0.05),表现出强抗氧化能力,这可能与胞外分泌物中含有胞外多糖和生物活性肽有关[24]。此外,DPPH自由基清除率较高的菌株有菌株FD18、PM20、PM22、PM25、PM33、XC08、XC15和XC21,清除率均>65%,ABTS自由基清除率较高的菌株有菌株PM20、PM22、PM25、PM33、PM43、XC08和XC21,清除率均>70%。除菌株PM02、FD06和PM05外,有19株菌株的胞外分泌物清除ABTS自由基能力大于清除DPPH自由基的能力,说明这些菌株对ABTS自由基清除能力更强。
2.4.2 菌株胞外分泌物对羟自由基和超氧阴离子的清除能力
22株菌株的胞外分泌物对羟自由基和超氧阴离子的清除率见表3。
由表3可知,22株菌株的稀释2倍胞外分泌物均具有清除羟自由基和超氧阴离子的能力,但各菌株抗氧化能力差异较大。29株菌株胞外分泌物对羟自由基清除率均>60%。其中羟自由基清除率>70%的菌株共有6株,占所有菌株的27.27%,分别是菌株FD06、PM01、PM20、XC03、XC08和XC27。其中,菌株XC08胞外分泌物清除羟自由基能力最强(76.30%),而菌株XC15最弱(46.09%),显著低于其他菌株(P<0.05)。超氧阴离子清除率介于45%~55%的菌株共有20株,占所有菌株的90.9%。其中,菌株PM01(55.76%)和PM15(54.55%)胞外分泌物清除超氧阴离子能力最强,显著高于其他菌株(P<0.05),而菌株PM04最弱(41.82%),显著低于其他菌株(P<0.05)。乳酸菌发酵液清除羟自由基和超氧阴离子这两者之间并没有必然联系,这与黄丽等[25]的研究结果相似,这也反映出菌株发挥清除自由基能力的物质不同,表明乳酸菌抗氧化作用是多种物质综合作用的结果。
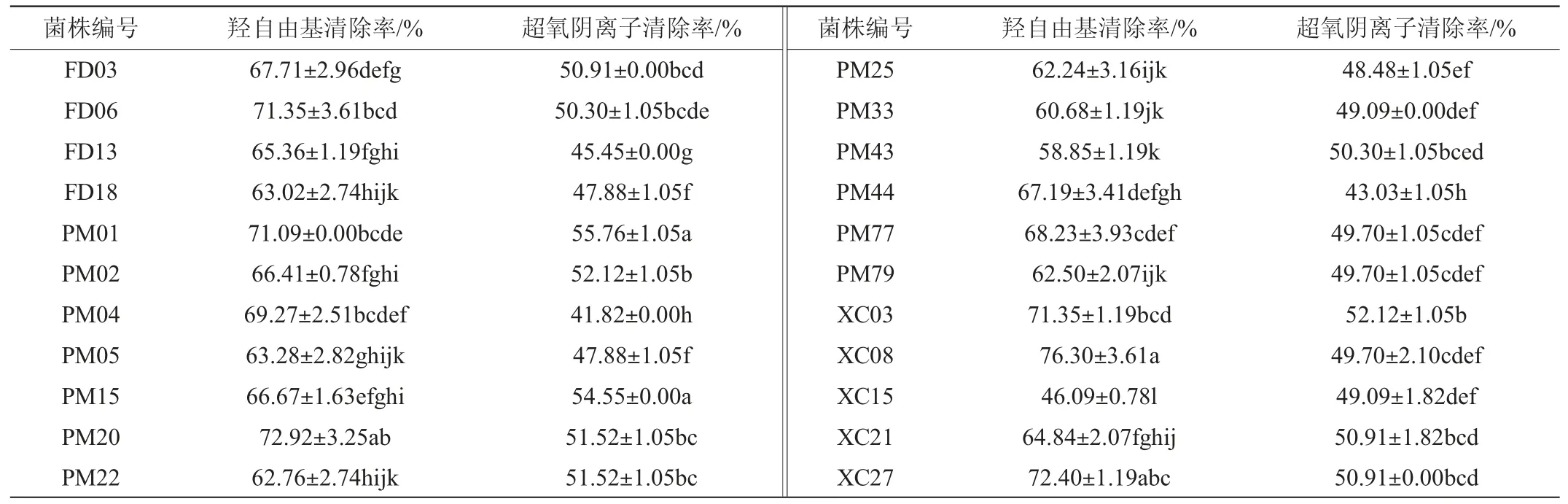
表3 22株菌株胞外分泌物对羟自由基和超氧阴离子自由基的清除率Table 3 Hydroxyl free radical and superoxide anion free radical clearance rate of extracellular secretions of 22 strains
2.4.3 菌株胞外分泌物的还原能力
22株菌株的胞外分泌物的还原能力见表4。
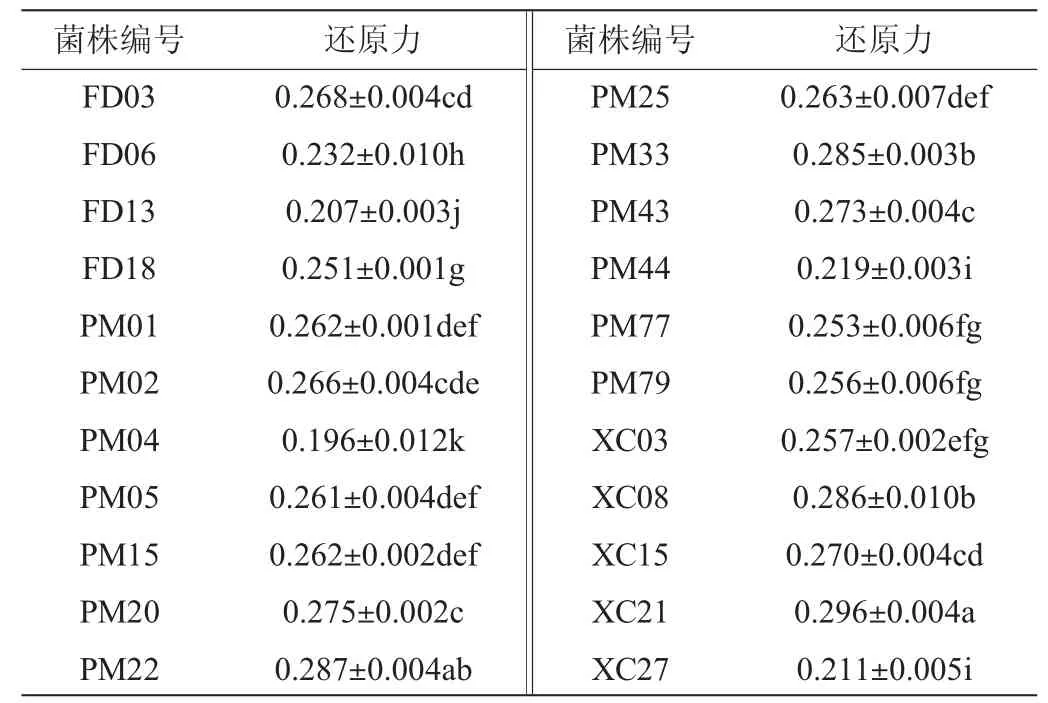
表4 22株菌株胞外分泌物的还原能力Table 4 Reducing capacity of extracellular secretions of 22 strains
由表4可知,菌株XC21、PM22、XC08、PM33表现出较强的还原能力,OD700nm值均>0.285,显著高于其他菌株(P<0.05)。菌株FD06、PM44、XC27、FD13和PM04的还原能力较弱,OD700nm值均<0.230,显著低于其他菌株(P<0.05)。
乳酸菌通过清除自由基、螯合金属离子、抑制脂质过氧化、耐H2O2、提高抗氧化酶活力等多种机制发挥抗氧化作用,一种体外评价方法只能根据某一种抗氧化原理评价其抵抗氧胁迫的能力,因此需要采用多种方法进行综合判断[26]。综上抗氧化结果,选取在5个抗氧化测定指标中2个以上指标排前五的代表菌株进行下一步研究,即菌株DF13、PM20、PM22和PM44。
2.5 代表菌株的生长和产酸特性研究
2.5.1 菌株的生长特性研究
由图1可知,4株菌株的生长趋势一致,迟滞期为0~2 h,对数生长期为2~10 h,10 h后进入稳定期,生长速率减缓,菌种OD595nm值基本保持恒定。其中菌株PM44在整个生长周期相比其他菌种长势较快,同时间段内OD595nm值高于其他菌株。在整个生长周期内,4株菌株的生长速度快慢顺序为菌株PM44>FD13>PM22>PM20。
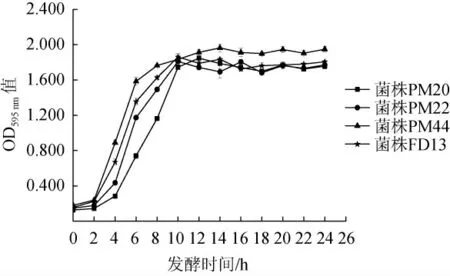
图1 4株菌株的生长曲线Fig. 1 Growth curves of 4 strains
2.5.2 菌株的产酸特性研究
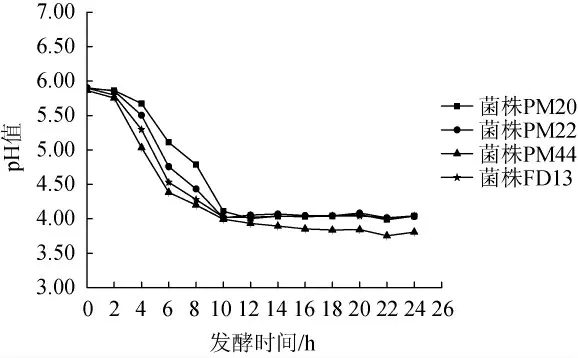
图2 4株菌株的产酸曲线Fig. 2 Acid production curves of 4 strains
由图2可知,4株菌株的生长曲线和产酸曲线存在对应关系,随着菌种生长速率增加,产酸速率同时增加,产酸快慢的规律也和生长曲线一致。同样的,产酸延滞期为0~2 h,各菌株pH值变化不大;发酵2 h后进入对数生长期,菌体生长代谢旺盛,产生大量有机酸,pH值迅速下降;发酵10 h左右达到生长稳定期,pH值变化不大,其中菌株FD13、PM22、PM20发酵菌液的最终pH值为3.8左右,而菌株PM44的最终pH值为4.0左右。综上,菌株PM44产酸速率最大且产酸能力最强。
2.6 代表菌株的分子生物学鉴定结果
菌株PM20、PM22、PM44及FD13的系统发育树见图3。

图3 基于16S rDNA基因序列菌株的系统发育树Fig. 3 Phylogenetic tree of strains based on 16S rDNA gene sequences
由图3可知,菌株PM20、PM22及FD13与发酵乳杆菌(Lactobacillus fermentum)聚于一支,亲缘关系最近,菌株PM44与乳酸片球菌(Pediococcus acidilactici)聚于一支,亲缘关系最近。因此,菌株PM20、PM22和FD13被鉴定为发酵乳杆菌(Lactobacillus fermentum),菌株PM44被鉴定为乳酸片球菌(Pediococcus acidilactici)。
3 结论
本研究通过革兰氏染色、过氧化氢酶试验及溶血性试验从广西生榨米粉中共筛选出146株γ-溶血的乳酸菌;通过耐酸、耐胆盐性能测定筛选出22株对pH 2.0和0.3%胆盐均具有良好耐受性的菌株;通过体外抗氧化能力测定筛选出综合体外抗氧化能力较好的4株优良菌株(PM20、PM22、PM44、FD13)。4株菌株生长及产酸趋势一致,其中菌株FM44的生产速率及产酸速率最快。通过分子生物学技术鉴定菌株PM20、PM22、FD13均为发酵乳杆菌(Lactobacillus fermentum)、菌株PM44为乳酸片球菌(Pediococcus acidilactici)。

