长链非编码RNA FAM201A靶向miR-488-3p对胃癌细胞生物学行为及放射敏感性的影响
刘晨 陶乐婷
胃癌是全球最常见的恶性肿瘤之一,其发病率和死亡率在所有恶性肿瘤中均居第2位。近年来,胃癌发病率逐渐上升,且呈年轻化趋势。若早期胃癌患者进行根治手术,其术后5年生存率可达90%,然而由于早期胃癌缺乏特异性征象,检出率较低,大多数患者发现时已为晚期[1-2]。尽管新辅助化疗、放疗在一定程度上改善了治疗效果,仍不可避免的出现化疗耐药和放疗抗性,并存在复发转移风险[3-4]。因此,寻找新的有效的治疗方法是胃癌临床亟待解决的重大问题。近年研究表明,长链非编码RNA(lncRNA)的异常表达参与胃癌的分子调控。研究发现,lncRNA 序列相似性家族201-成员A(family with sequence similarity 201-member A,FAM201A)在耐辐射食管鳞癌、肺癌组织中表达上调,FAM201A表达增加与食管鳞癌、肺癌的抗辐射性和低存活率密切相关,且敲除FAM201A 后食管鳞癌、肺癌的放射敏感性增强[5-6]。但目前鲜见FAM201A 与胃癌细胞生物学行为以及放射敏感性的相关研究。miR-488-3p是一个肿瘤抑制因子,过表达miR-488-3p可提高黑色素瘤细胞的顺铂敏感性[7]。在胃癌中miR-488表达下调,并发挥抑癌基因作用[8]。FAM201A和miR-488-3p之间存在潜在靶向关系,但FAM201A能否调控miR-488表达进而影响胃癌细胞生物学行为和放射敏感性尚不明确。本研究旨在探讨lncRNA FAM201A靶向miR-488-3p对胃癌细胞生物学行为及放射敏感性的影响和机制,以期为胃癌的临床治疗提供新的分子靶点。
1 材料与方法
1.1 实验材料
选取2014年1月至2017年1月间于莱阳中心医院确诊并进行胃癌根治性切除手术(术前均未经过放疗和化疗治疗)的胃癌患者的肿瘤组织标本和配对的非癌性黏膜标本63例,其中男性36例,女性27例。所有患者均知情同意。
人胃癌细胞MGC803 购自中科院上海细胞库。LipofectamineTM2000 购自美国Invitrogen公司。si-FAM201A、pcDNA3.1、pcDNA3.1-FAM201A、miR-NC、miR-488-3p、si-con、anti-miR-488-3p、anti-miR-NC以及WT-FAM201A和MUT-FAM201A购自上海吉玛公司。DMEM培养基和胎牛血清购自美国Gibco公司。四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒、膜联蛋白V异硫氰酸荧光素(annexin V fluorescein isothiocyanate,Annexin V-FITC)凋亡试剂盒购自北京索莱宝生物技术有限公司。Transwell小室和基质胶购自美国Corning公司。Western blot相关试剂购自上海碧云天公司。兔源CyclinD1 抗体、兔源P21 抗体、兔源MMP-2抗体、兔源Bcl-2抗体、兔源Bax多抗体均购自美国Abcam公司。鼠源E-cadherin抗体购自美国Santa Cruz公司。辣根过氧化物酶标记的山羊抗兔和山羊抗鼠Ⅱ抗购自北京百奥莱博科技有限公司。
1.2 方法
1.2.1 细胞培养、转染和分组 采用含有10%胎牛血清的DMEM培养基在37℃、含5%CO2的细胞培养箱培养MGC803细胞,当细胞密度达80%~90%,即可进行传代培养。细胞转染:取对数期的MGC803细胞,按照每孔2×105个细胞密度接种于6孔板,采用脂质体转染法利用LipofectamineTM2000将si-con、si-FAM201A转染至细胞密度为60%的MGC803细胞,依次记为si-con组和si-FAM201A组,转染24~72 h后,检测转染效果,随后进行后续研究。为进一步证实FAM201A是通过调控miR-488-3p表达进而影响胃癌细胞的生物学行为及放射敏感性,将si-FAM201A 与anti-miR-NC 或者antimiR-488-3p 同时转染至MGC803 细胞,依次记为si-FAM201A+anti-miR-NC组、si-FAM201A+anti-miR-488-3p组,检测抑制胃癌细胞的生物学行为和放射敏感性变化。
1.2.2 qRT-PCR检测 取0.5 cm3的切除组织磨碎,利用TRIzol试剂提取总RNA。采用逆转录试剂盒将其逆转为cDNA后,进行qRT-PCR扩增。FAM201A和miR-488-3p的相对表达量采用2-ΔΔCt法进行计算(分别以GAPDH和U6为内参)。FAM201A定量PCR引物序列如下(5'-3'):FAM201A-F:TCTCTGATGGGAGCCTCTT TA;FAM201A-R:CAAGCCACAGACGGAGAAA;GAPD H-F:GGTGAAGGTCGGAGTCAACG;GAPDH-R:CCAT GTAGTTGAGGTCAATGAAG。
1.2.3 双荧光素酶报告基因检测 利用Starbase 2.0在线预测FAM201A的靶基因。发现miR-488-3p 与FAM201A-3'UTR 存在部分连续互补碱基对,推测miR-488-3p是FAM201A的靶基因,并利用双荧光素酶报告基因检测进行验证。构建野生型WTFAM201A和突变型MUT-FAM201A的FAM201A-3'UTR 荧光素酶报告基因载体,利用LipofectamineTM2000 将miR-488-3p mimics和miR-NC 分别与WTRAP2B和MUT-RAP2B 共转染MGC803 细胞,培养48 h后,利用双荧光素酶报告基因检测试剂盒对各组MGC803细胞的荧光素酶活性进行测定。
1.2.4 MTT 法检测细胞活力 将MGC803 细胞按照每孔2×103个细胞密度接种于96 孔板,按照“1.2.1 分组”进行转染后,分别于转染后24 h、48 h、72 h 时间点向各孔内加入20 μL的MTT试剂,培养箱孵育4 h,弃去上清后,再向各孔内加入150 μL的DMSO,继续孵育2 h,待结晶充分溶解,用酶标仪测定490 nm 波长处各孔的吸光度值。
1.2.5 Transwell法检测细胞迁移和侵袭能力 侵袭实验:转染48 h,用胰酶消化细胞后离心收集细胞,用适量的DMEM培养基(不含血清)重悬细胞。向Transwell下室加入500 μL含10%胎牛血清的DMEM培养基,向已包被Matrigel基质胶的Transwell上室内加入300 μL的细胞悬液,培养24 h后,擦去上室膜未穿膜的细胞,甲醇固定下室膜30 min,经0.1%的结晶紫溶液染色20 min后,用PBS洗去多余染液,倒置于显微镜下观察细胞穿膜情况,拍照,记录5个视野细胞数目,取均值为侵袭细胞数目。迁移实验采用未包被Matrigel基质胶的小室,其他步骤同侵袭实验。
1.2.6 流式细胞术检测细胞凋亡 常规消化各组MGC803 细胞,制备细胞悬液(浓度为1×106个/mL),利用Annexin V-FITC 凋亡试剂盒进行染色,室温避光孵育30 min,上机检测细胞凋亡情况。
1.2.7 Western blot 检测 收集转染48 h 细胞,常规提取蛋白,BCA蛋白定量试剂盒检测各组蛋白样品浓度。取适量蛋白样品进行聚丙烯酰胺凝胶电泳,将分离的细胞蛋白转移至硝酸纤维(nitrocellulose,NC)膜,5%脱脂牛奶室温侧摆摇床封闭30 min,洗膜后,依次加入Ⅰ抗、Ⅱ抗孵育,参考ECL 试剂盒使用说明进行发光显色,采用GraphPad Prism 7 分析蛋白条带灰度值。
1.2.8 克隆形成实验检测细胞放射生物学参数 按不同照射剂量,接种细胞于6 孔板中。待细胞贴壁后,分别采用0、2、4、6、8 Gy的X线照射(照射时培养皿覆盖2 cm厚有机玻璃板,源皮距为100 cm,剂量率为3.2 Gy/min),继续培养至出现肉眼可见集落,甲醇固定30 min,PBS 洗涤,0.1%的结晶紫染液染色20 min。显微镜下计数细胞个数大于50的集落。计算各组细胞存活分数,Graph Pad Prime 7软件拟合多靶单击模型计算相关放射生物学参数。
1.3 统计学分析
采用SPSS18.0软件进行统计学分析,所有计量资料均采用±s表示,两组间比较采用t检验,多组间比较进行单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 FAM201A、miR-488-3p在胃癌组织和癌旁组织中的表达
与癌旁组织比较,胃癌组织中FAM201A的表达水平(1.04±0.10vs.0.29±0.03)显著升高,miR-488-3p的表达(0.21±0.02vs.0.96±0.09)水平显著降低(P<0.05)。
2.2 抑制FAM201A 对细胞MGC803 增殖、凋亡、迁移、侵袭的影响
与si-NC组比较,si-FAM201A 组MGC803 细胞FAM201A的表达水平显著降低,表明已成功构建抑制FAM201A表达的MGC803 细胞株。与si-NC组比较,si-FAM201A 组MGC803 细胞Cyclin D1、MMP-2和Bcl-2蛋白的表达水平显著降低,P21、E-cadherin和Bax蛋白表达水平显著升高,细胞增殖活力显著降低,迁移侵袭细胞数显著减少,细胞凋亡率显著升高(P<0.05),见图1,表1、2。
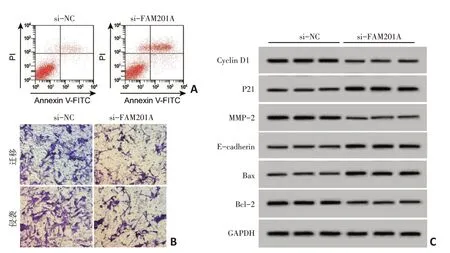
图1 抑制FAM201A对细胞MGC803增殖、凋亡、迁移、侵袭的影响
表1 抑制FAM201A对细胞MGC803增殖的影响 (±s,n=9)
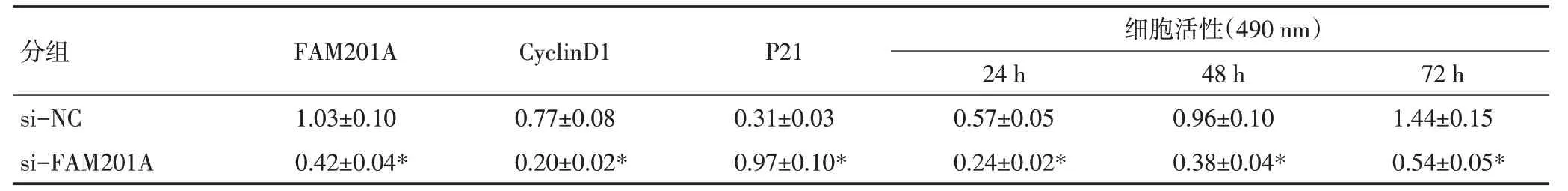
表1 抑制FAM201A对细胞MGC803增殖的影响 (±s,n=9)
与si-NC组比较,*P<0.05
分组si-NC si-FAM201A FAM201A 1.03±0.10 0.42±0.04*CyclinD1 0.77±0.08 0.20±0.02*P21 0.31±0.03 0.97±0.10*细胞活性(490 nm)24 h 0.57±0.05 0.24±0.02*48 h 0.96±0.10 0.38±0.04*72 h 1.44±0.15 0.54±0.05*
表2 抑制FAM201A对细胞MGC803凋亡、迁移、侵袭的影响 (±s,n=9)

表2 抑制FAM201A对细胞MGC803凋亡、迁移、侵袭的影响 (±s,n=9)
与si-NC组比较,*P<0.05
分组si-NC si-FAM201A MMP-2 0.73±0.07 0.14±0.01*E-cadherin 0.26±0.02 0.79±0.08*Bax 0.18±0.02 0.85±0.08*Bcl-2 0.88±0.09 0.27±0.03*迁移细胞数(个)134±13.78 66±6.82*侵袭细胞数(个)124±13.21 59±6.12*凋亡率(%)7.28±0.79 23.57±2.44*
2.3 抑制FAM201A对细胞MGC803放射敏感性的影响
采用不同剂量(0、2、4、6、8 Gy)射线分别照射si-NC组和si-FAM201A组MGC803细胞后,细胞存活率显著降低,并呈剂量依赖性,且si-FAM201A 组细胞存活率显著低于si-NC组(P<0.05,图2)。单击多靶模型参数见表3,提示抑制FAM201A表达可增加MGC803细胞放射敏感性。
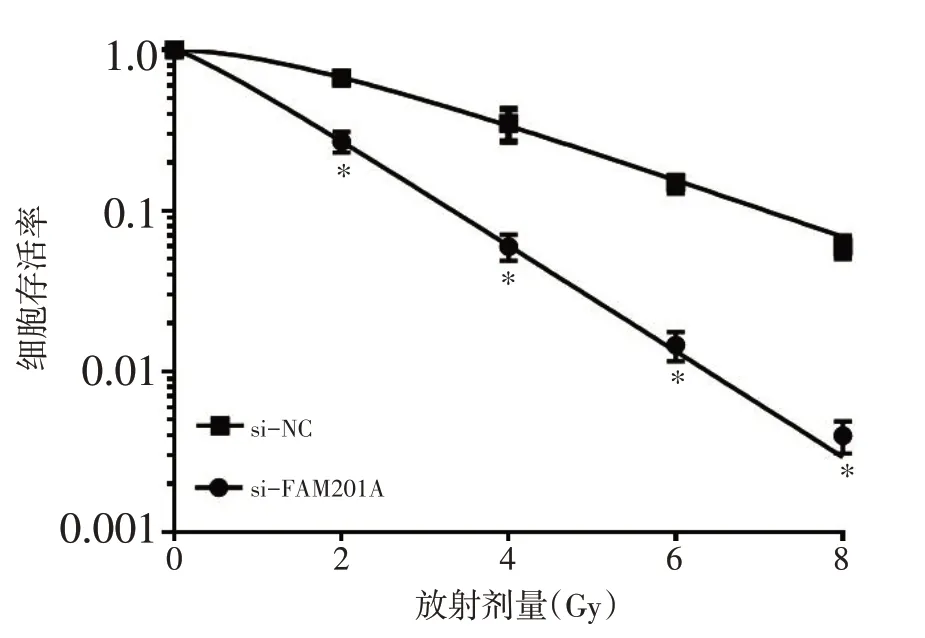
图2 抑制FAM201A对细胞MGC803放射敏感性的影响
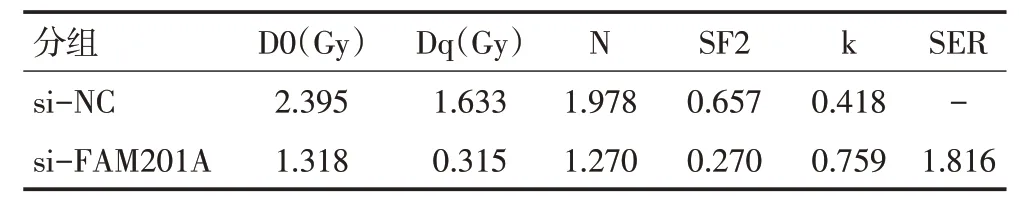
表3 抑制FAM201A表达后单击多靶模型参数
2.4 FAM201A靶向、调控miR-488-3p的表达
利用StarBase v2.0 预测FAM201A靶基因,提示FAM201A 与miR-488-3p 具有部分连续结合的核苷酸(图3)。双荧光素酶报告基因实验显示,与miRNC和WT-FAM201A 共转染组比较,miR-488-3p和WT-FAM201A 共转染组MGC803 细胞的荧光素酶活性显著降低(P<0.05);与miR-NC和MUT-FAM201A共转染组比较,miR-488-3p和MUT-FAM201A 共转染组MGC803 细胞的荧光素酶活性变化差异无统计学意义(P>0.05)。RT-qPCR 检测显示,与pcDNA3.1组比较,pcDNA3.1-FAM201A 组MGC803 细胞miR-488-3p的表达水平显著降低;与si-NC组比较,si-FAM201A 组MGC803 细胞miR-488-3p的表达水平显著升高(P<0.05)。
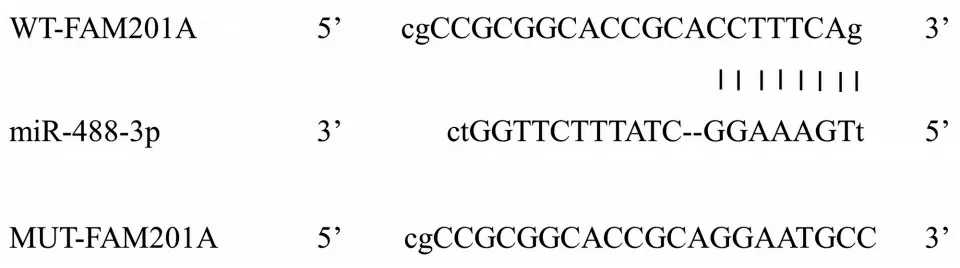
图3 FAM201A靶向miR-488-3p
2.5 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803增殖、凋亡、迁移、侵袭作用
与si-FAM201A+anti-miR-NC组比较,si-FAM201A+anti-miR-488-3p组MGC803 细胞Cyclin D1、MMP-2和Bcl-2蛋白的表达水平显著升高,miR-488-3p、P21、E-cadherin和Bax蛋白表达水平显著降低,细胞增殖活力显著升高,迁移侵袭细胞数显著增多,细胞凋亡率显著降低(P<0.05),见图4,表4、5。
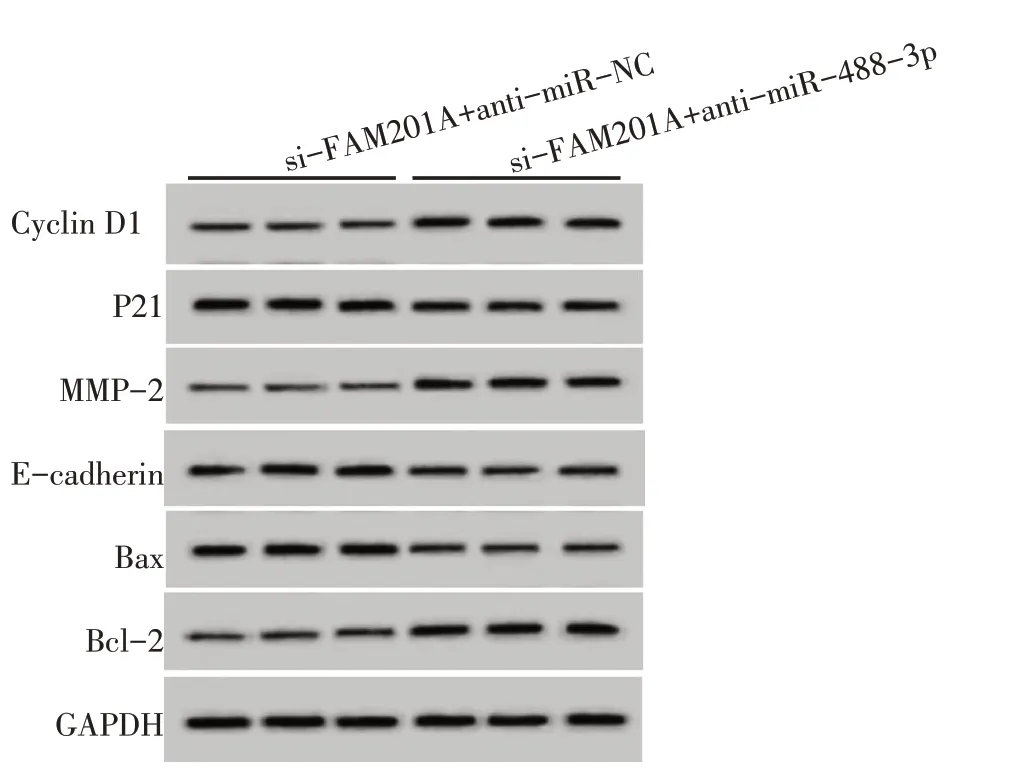
图4 抑制miR-488-3p 能逆转抑制FAM201A 对细胞MGC803 增殖、迁移、侵袭、凋亡蛋白表达的影响
表4 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803增殖的影响 (±s,n=9)
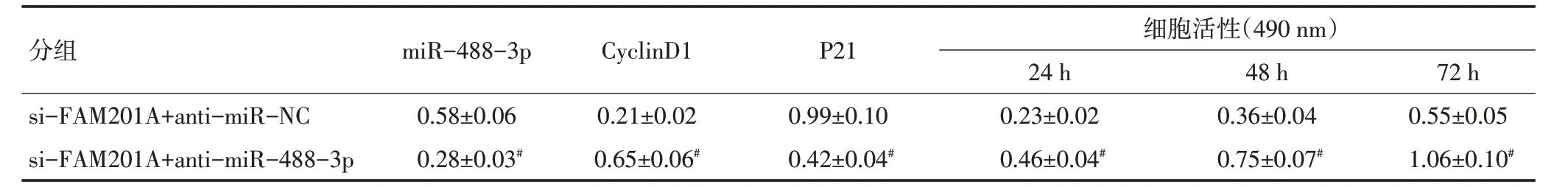
表4 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803增殖的影响 (±s,n=9)
与si-FAM201A+anti-miR-NC组比较,#P<0.05
分组si-FAM201A+anti-miR-NC si-FAM201A+anti-miR-488-3p miR-488-3p 0.58±0.06 0.28±0.03#CyclinD1 0.21±0.02 0.65±0.06#P21 0.99±0.10 0.42±0.04#细胞活性(490 nm)24 h 0.23±0.02 0.46±0.04#48 h 0.36±0.04 0.75±0.07#72 h 0.55±0.05 1.06±0.10#
表5 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803凋亡、迁移、侵袭的影响 (±s,n=9)

表5 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803凋亡、迁移、侵袭的影响 (±s,n=9)
与si-FAM201A+anti-miR-NC组比较,#P<0.05
分组si-FAM201A+anti-miR-NC si-FAM201A+anti-miR-488-3p MMP-2 0.13±0.01 0.66±0.06#E-cadherin 0.81±0.08 0.35±0.03#Bax 0.86±0.08 0.24±0.02#Bcl-2 0.25±0.02 0.71±0.07#迁移细胞数(个)64±6.57 103±10.4#侵袭细胞数(个)60±6.23 95±9.61#凋亡率(%)23.81±2.67 9.92±1.04#
2.6 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803放射敏感性的作用
采用不同剂量(0、2、4、6、8 Gy)射线照射各组MGC803细胞后,各组细胞存活率呈剂量依赖性显著降低(图5)。与si-FAM201A+anti-miR-NC组比较,si-FAM201A+anti-miR-488-3p组细胞存活率显著升高(P<0.05)。单击多靶模型参数见表6,提示抑制miR-488-3p表达可逆转抑制FAM201A 对细胞MGC803放射敏感性的影响。
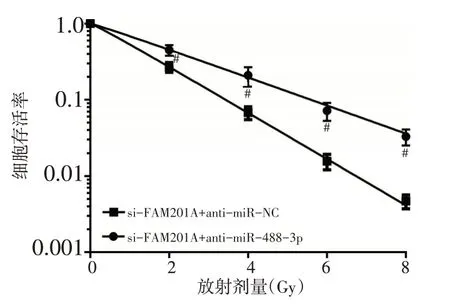
图5 抑制miR-488-3p能逆转抑制FAM201A对细胞MGC803放射敏感性的影响
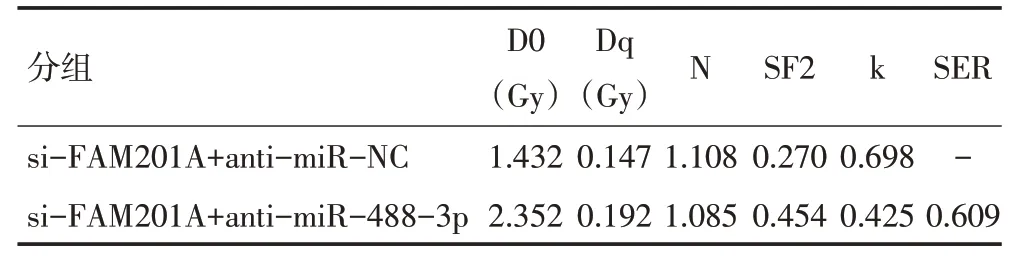
表6 抑制miR-488-3p表达后单击多靶模型参数
3 讨论
长期以来,胃癌一直是全球癌症相关死亡的主要原因。放疗和化疗作为胃癌术后辅助治疗手段在一定程度上改善了治疗效果,但晚期胃癌患者的死亡率依然较高。为改善胃癌治疗现状,需要进一步研究新的治疗策略和靶点。
近期多项研究发现lncRNA在胃癌的发生发展过程中具有重要的调控作用。lncRNA MEG3在胃癌组织中表达显著降低,MEG3的表达与肿瘤大小呈负相关,与患者的生存时间呈正相关,过表达MEG3 在体外可降低胃癌细胞的增殖和转移能力[9];lncRNA SNHG7通过调控p15和p16的表达,在一定程度上促进胃癌的发生发展[10];LncRNA DANCR 通过抑制胃癌细胞中的肿瘤低表达长链非编码RNA(lncRNALET)而促进胃癌细胞迁移和侵袭[11]。FAM201A 位于人染色体9p13.1,全长2.9 Kbp。2015年,Yu 等[12]首次在人类强迫症和妥瑞氏综合征中对FAM201A进行报道。近期Huang等[13]发现FAM201A与股骨头坏死的发生有关。然而,关于FAM201A 与恶性肿瘤的报道较少。Matsumura 等[14]在分析结肠癌组织基因表达谱时发现FAM201A表达上调;Chen 等[5]研究发现,FAM201A 在耐辐射食管癌组织中表达上调,FAM201A通过发挥miR-101分子海绵作用上调突变蛋白(ataxia telangiectasia mutated,ATM)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)表达进而调控食管癌细胞的放射敏感性;此外,FAM201A 在耐放疗的非小细胞肺癌组织中也呈高表达,敲减FAM201A 通过靶向miR-370 抑制表皮生长因子(epidermal growth factor receptor,EGFR)和缺氧诱导因子(hypoxia-inducible factor 1 alpha,HIF-1α)表达增加非小细胞肺癌的放射敏感性[6]。本研究发现,FAM201A 在胃癌组织中呈高表达。随后进行体外实验验证FAM201A 功能,结果表明抑制FAM201A表达降低胃癌细胞的增殖、迁移和侵袭能力,促进胃癌细胞凋亡。此外,抑制FAM201A表达后胃癌细胞的耐辐射差异表明,抑制FAM201A表达可增加胃癌细胞的放射敏感性。这与FAM201A在食管癌和非小细胞肺癌中的作用一致。
近年来,随着竞争性内源RNA 假说的提出,lncRNA 发挥miRNA 分子海绵作用调控肿瘤发生发展的重要作用被广泛报道。为探索FAM201A调控胃癌细胞生物学行为和放射敏感性的分子机制,利用Starbase v2.0在线预测发现miR-488-3p和FAM201A存在互补碱基对。miR-488-3p 已被报道在食管鳞癌[15]、胶质瘤[16]、肝癌[17]等恶性肿瘤中发挥抑癌基因作用,此外,miR-488 还可通过激活真核翻译起始因子3a(eukaryotic translation initiation factor 3a,eif3a)介导的核苷酸剪切修复(nucleotide excision repair,NER)信号通路,抑制非小细胞肺癌细胞的增殖,降低其顺铂敏感性[18]。本研究发现,miR-488在胃癌组织中表达显著下调,这与Zhao等[8]的研究结论一致。荧光素酶报告基因检测和qPCR显示,FAM201A可靶向负性调控miR-488的表达。为进一步证实FAM201A是通过调控miR-488-3p表达进而影响胃癌细胞的生物学行为和放射敏感性,将si-FAM201A和antimiR-488-3p 同时转染至胃癌细胞,发现抑制miR-488-3p表达可逆转抑制FAM201A 对胃癌细胞生物学行为和放射敏感性的影响。
综上所述,FAM201A 在胃癌组织中呈高表达,miR-488-3p 呈低表达,抑制lncRNA FAM201A 通过靶向miR-488-3p降低了胃癌细胞增殖、迁移和侵袭能力,促进胃癌细胞凋亡,并增加其放射敏感性。FAM201A有望成为胃癌临床治疗的新型分析靶点。

