肉瘤样肝癌24例临床分析*
原发性肝癌(hepatocellular carcinoma,HCC)是全球第五大常见恶性肿瘤,在肿瘤相关死因中居第2位[1-2]。肉瘤样肝癌(sarcomatoid hepatocellular carcinoma,SHC)是HCC的一种罕见病理亚型,占1.8%~3.9%[3]。Jernigan等[2]报道相比于欧洲白种人,亚洲人种出现肉瘤样亚型HCC比例较低,且SHC在临床侵袭性高,预后差。本研究回顾性分析郑州大学第一附属医院24例SHC患者的临床资料,以提高临床医生对该病的了解。
1 材料与方法
1.1 一般资料
回顾性收集2015年1月至2019年12月在郑州大学第一附属医院病理确诊为SHC患者24例,占此期间确诊肝癌患者总数的0.83%(24/2891)。男性16例、女性8例,男女比例2:1。发病年龄为44~79岁,中位年龄55岁。14例感染乙肝,2例感染丙肝,8例未感染肝炎病毒。病灶位于肝左叶6例,肝右叶14例,肝内多发3例及肝尾状叶1例。按照国际抗癌联盟(UICC)/(AJCC)发布的肝癌TNM分期(第八版),Ⅰ期2例、Ⅱ期1例、Ⅲ期6例、Ⅳ期15例。平均肿瘤长径6.27(1.94~14.9)cm,见表1。
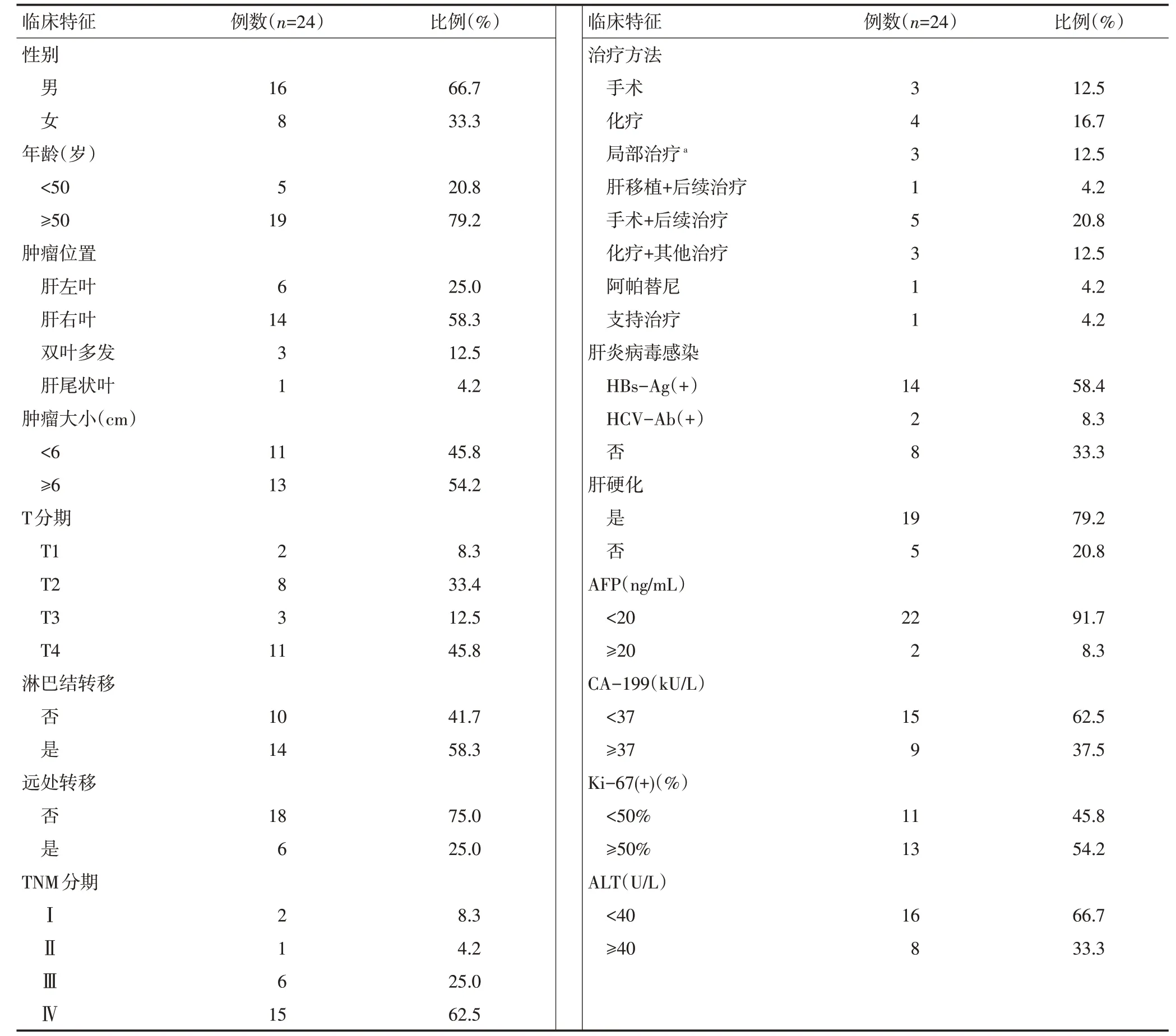
表1 24例SHC患者临床特征
临床表现:24例患者临床表现多样,腹痛占多数。14例以腹痛或腹胀为主诉,其中3例伴发热,3例伴皮肤及巩膜黄染。4例以发热为主诉,其中1例伴小便黄染,1例伴乏力、纳差。余6例症状散发,2例咳嗽伴胸闷,1例头晕伴下肢水肿,1例皮肤红疹,1例纳差,仅1例为体检发现。
超声表现:7例行彩超检查,5例提示肝内实性低回声包块,形态欠规整,可成分叶状。1例提示高回声。1例不均质回声,未见血流信号。
CT表现:21例行CT检查,平扫肝内病灶为低密度影,边缘欠清(图1A),CT增强示边缘强化,或轻度不均质强化,静脉期强化降低(图1B、C)。其中3例出现门脉栓子,1例可见下腔静脉癌栓,图像表现为下腔静脉增宽,增强扫描见充盈缺损(图1D)。疑为肝脓肿2例,疑为胰腺占位并肝转移1例,疑为囊腺瘤、错构瘤各1例。
MRI表现:5例行MRI检查,平扫肝内可见块状异常信号,T1WI上呈较低或等信号,T2WI上呈稍高信号(图2A),压脂像呈高信号,DWI 示扩散受限(图2B)。注入对比剂增强后,病灶边缘明显强化,静脉期较动脉期强化降低。疑为胆管错构瘤1例。
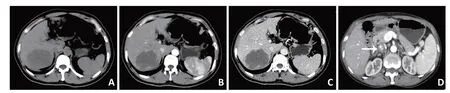
图1 SHC患者CT特征
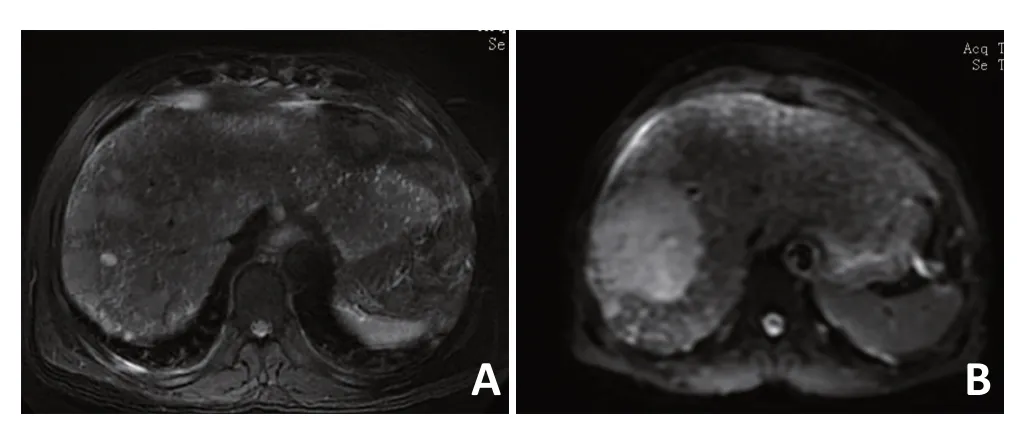
图2 SHC患者MRI特征
1.2 治疗方法
除去3例失访者,Ⅰ、Ⅱ期患者均行外科手术;Ⅲ期患者50%行外科切除术,33.4%行局部治疗。Ⅳ期患者25%行外科切除术,58.3%行化疗、靶向或联合免疫治疗。
具体治疗措施:1例行肝移植并接受后续治疗,3例行单纯手术切除,5例行肝切除术后接受后续治疗。4例行单纯化疗,3例化疗联合其他治疗。3例行单纯局部治疗。单纯口服阿帕替尼和对症支持治疗各1例,见表2。
临床病理特征:9例术后肿物切面可呈灰红、灰黄、灰白,质软、软到中或中到硬,可见坏死。肉眼见3例界清,余界线欠清或模糊,均无包膜形成。24例均包含癌和肉瘤样成分,且肉瘤样成分占比>50%。光镜下可见深染核异型细胞,典型肉瘤样成分镜下细胞多呈梭形(图3A)。所有患者免疫组织化学结果:13例AE1/AE3+,13例CK8/18+,12例CK+(图3B),3例EMA+(图3C),14例Vim+(图3D),1例SMA+(表2)。1例术后标本接受NGS基因检测,显示9个基因突变:PTEN、TP53、LRP1B、FAT3、ARAF、HGF、DIS3、CREBBP、DNMT1,前5个基因突变丰度均在20%以上。
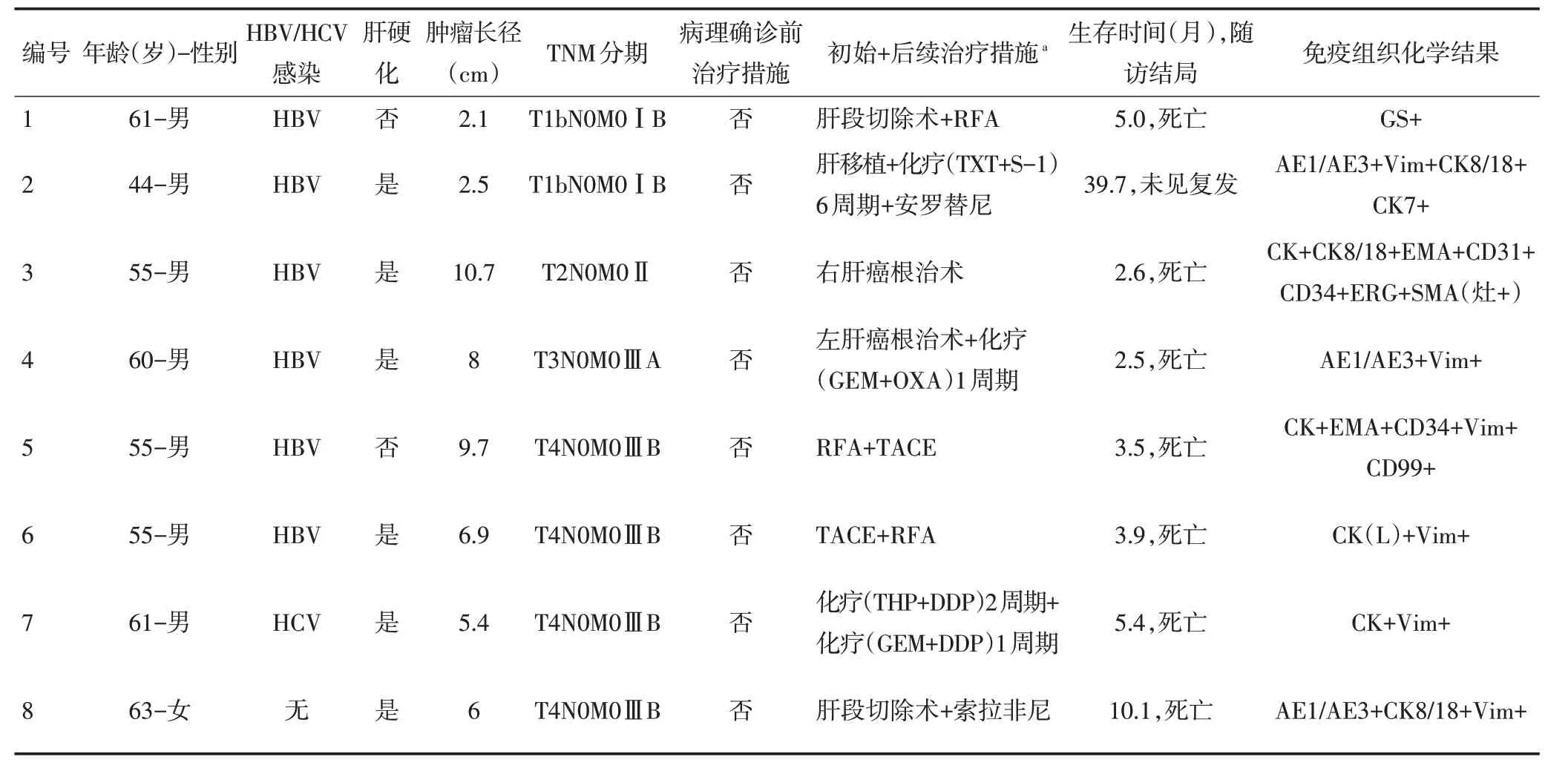
表2 24例SHC患者的具体资料
表2 24例SHC患者的具体资料(续表2)
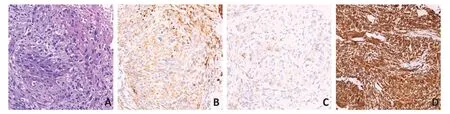
图3 SHC患者病理学特征
1.3 统计学分析
采用SPSS 21.0软件进行数据分析。无病生存期(disease-free survival,DFS)即自手术切除之日至影像学确认肿瘤复发或末次随访日或死亡时间。总生存期(overall survival,OS)即自病理确诊之日至末次随访日或死亡时间。以Kaplan-Meier曲线分析DFS和OS。P<0.05为差异具有统计学意义。
2 结果
采用电话对患者随访,随访截至2020年5月。随访1~39.7个月,中位随访时间4.8个月,3例患者失访。随访过程中19例患者死亡,1例患者腹膜转移后失访,1例肝移植患者在随访截止仍存活,长达39.7个月。9例术后患者中位OS为4.7个月,中位DFS为2.3个月(4例出现肝内转移,1例出现膈下转移,1例出现胸膜及贲门口淋巴结转移,余3例未见明显复发转移迹象)。Ⅲ~Ⅳ期患者中位OS为4.8(1~10.1)个月,其中手术(6例)与非手术(12例)组中位OS无显著性差异(3.4个月vs.5.1个月,P=0.844)。
3 讨论
SHC是一种罕见的原发于肝脏的上皮性恶性肿瘤,由于多数文献仅为个案报道,临床医生对于SHC的起因、治疗及预后尚在探索阶段。其发生可能与病毒感染、肝硬化、放疗、化疗及介入治疗等有关[1,4],本研究24例患者肝炎病毒感染者占66.7%,肝硬化者占79.2%,2例患者病理确诊前行TACE术。典型的SHC组织内包含明确的恶性上皮性成分和梭形细胞等肉瘤样成分,多数学者认为后者由前者转化而来,并非真正的间叶组织[5-6]。其电镜下的特征:癌细胞可见中间丝蛋白,肉瘤样成分有桥粒连接、张力微丝、前黑色素颗粒等超微结构,并可显示两种成分的移行过渡[6]。因此国外文献中的梭形细胞癌(spindle cell carcinoma)、多形性癌(pleomorphic carcinoma)及化生性癌(metaplastic carcinoma),均可描述肉瘤样癌[3]。
SHC 多发生于中老年,本研究24例患者中位年龄55岁,男性多见。患者临床表现多样,包括腹痛、腹胀不适、黄疸以及肿瘤性发热等[4,7]。若患者合并肝硬化,可伴肝硬化失代偿的临床表现。本研究14例患者均出现腹痛或腹胀,7例出现发热。AFP作为普通型肝癌的特异性肿瘤标志物,既往文献提示在SHC中诊断意义不大[4],本研究中仅2例(8.3%)出现AFP的升高。
SHC 病灶生长快,侵袭性强,本研究平均肿瘤长径6.27 cm,有报道可达8.5 cm[3]。分化差的肉瘤样癌细胞生长迅速,新生血管不能及时供养恶性细胞以至瘤体中心坏死,影像学可有相应表现。彩超多显示病灶低回声或混合回声,瘤体周边可见环状血流信号。但彩超特异性低,不易准确定位,本研究1例彩超示肝右前叶8 mm×10 mm高回声结节,余未见异常,后复查CT却发现肝右叶97 mm低密度影,与彩超结果不符。SHC的CT 平扫病灶密度低于正常肝组织,中心可见更低密度影,部分可因纤维间隔的形成表现为分隔状。增强CT动脉期可见周边环形强化或不规则斑片状强化,中央区域强化不明显,延迟期周边呈轻度强化[4-8]。MRI表现上,T1WI呈较低或等信号,T2WI呈稍高信号,用GD-DTPA对比增强,强化特点与增强CT类似,但坏死区域无强化[8-10]。临床中可在影像学上根据普通型肝癌“快进快出”的特点与其鉴别。
SHC是一类具有肉瘤样成分的癌种,其明确的病理学特点有2方面:1)癌与肉瘤样成分均存在,肉瘤样成分占比>50%;2)免疫组织化学特征:上皮性肿瘤标志物CK、EMA与间叶性肿瘤标志物Vimentin、SMA同时呈阳性,角蛋白CAM 5.2、CK8、CK18、CK19亦可呈阳性[5-6,9]。肿瘤组织内癌和肉瘤样成分可独立或交错分布,周围可见坏死区域。坏死的形成与肉瘤样细胞增殖迅速,或与患者既往行介入治疗等有关。肝细胞癌区域可呈小梁状、巢状或假腺样结构,肉瘤样区域常由交织束状排列的梭形细胞组成。有时异型性明显,细胞形态呈多形性,或伴破骨样巨细胞成分[5]。肉瘤样变的起源机制目前未完全明确,优势学说为肉瘤样成分起源于普通肝癌的转化。目前SHC的基因突变报道较少,但现有文献均发现在肝癌的肉瘤样变亚型常见TP53 突变[11-13],TP53 突变可促进细胞增殖,上皮-间质转化及血管生成[13]。本研究1例患者的基因检测结果也显示TP53突变。
文献报道SHC术后中位OS约8个月,术后1年OS率仅22%左右[1,6,14]。本研究术后中位OS仅4.7个月,可能与手术患者Ⅲ~Ⅳ期占比高有关(66.7%)。Wu 等[3]收集美国国家癌症数据库(National Cancer Database,NCDB)近11年内104例SHC 临床资料,发现Ⅰ期与Ⅱ~Ⅳ期的OS 均差异有统计学意义,而Ⅱ~Ⅳ期之间的OS 均差异无统计学意义,其中Ⅲ期和Ⅳ期的中位OS分别为4.1个月和3.6个月。本研究中Ⅲ~Ⅳ期患者占87.5%,中位OS为4.8个月,比文献报道高,可能的原因:1)本文样本量较小。2)Wu等[3]研究中对症支持治疗占姑息治疗患者总数53.1%,而本研究中仅1例行对症支持治疗,余患者均行化疗、口服靶向药或联合免疫治疗。
目前针对SHC尚无明确治疗指导策略。对于早期(Ⅰ~Ⅱ期)患者可行外科切除、肝移植或局部消融。然而外科手术的治疗效果仍不确切,SHC术后短者2个月复发[4],长者可生存35个月[6]。本研究认为可能与患者手术耐受程度、肿瘤大小、营养状况、是否行R0 切除、残余肝体积以及是否行扩大淋巴结清扫有关。Kan等[7]报道术后接受后续治疗对比单纯手术,DFS分别为6.6个月与5.0个月,OS分别为8.6个月与5.0个月(P<0.05),提示术后接受后续治疗较单纯手术更能使患者受益。本研究8例行外科切除治疗,5例术后接受进一步治疗,平均生存期5.5(2.5~10.1)个月,而3例仅行手术切除,平均生存期2.3(1~3.4)个月。本研究患者术后最快1个月死亡,该患者瘤体较大(12 cm),术后病理提示肝门部淋巴结转移,生存期短可能与术后残余肝体积不足、淋巴结转移等有关。对于瘤体较大患者,可术前行TACESPVE使栓塞侧肝体积缩小,非栓塞侧肝叶增生,顺利完成二期根治性肝切除术[15]。既往文献报道2例SHC患者行肝移植后6个月出现肝内复发,肿瘤直径>3 cm,分化差和血管侵犯是肝移植后肝内复发的高危因素[16]。本研究肝移植患者肿瘤最大直径2.5 cm,肝门脉管未见癌累及,肝移植术后规律化疗并口服安罗替尼,生存期可长达39.7个月,对于临床医生有一定参考意义。
对于Ⅲ~Ⅳ期患者,可行全身化疗、TACE 或局部消融来降低肿瘤负荷,但仍缺乏大样本研究证实其可靠疗效。本研究Ⅲ~Ⅳ期患者中,接受手术组与非手术组中位OS 无显著性差异,提示手术对于晚期SHC并不优于姑息治疗。肉瘤样癌常用化疗药物包括多西他赛、紫杉醇、吉西他滨、铂类以及氟尿嘧啶类,GP(吉西他滨联合顺铂)和TP(紫杉醇联合顺铂)方案对于晚期肉瘤样癌的无进展生存期和OS 无显著性差异[17]。本研究化疗方案多样,值得注意的是采用“紫杉醇脂质体+阿帕替尼+特瑞普利单抗(toripalimab)”方案治疗的Ⅳ期女性,生存期达9.3个月,高于本研究所有化疗或联合靶向治疗患者。特瑞普利单抗作为国产PD-1单抗,目前尚缺乏治疗SHC的报道,仅1例纳武单抗治疗肺肉瘤样癌术后复发达完全缓解的个案报道[18]。关于晚期或不可切除肝癌的免疫治疗,Finn 等[19]报道与索拉非尼相比,阿替利珠单抗+贝伐珠单抗显著延长患者PFS(4.3个月vs.6.8个月,P<0.001),且1年OS 率也显著升高(54.6%vs.67.2%,P<0.001)。国内一项针对卡瑞丽珠单抗(camrelizumab)二线治疗肝癌的Ⅱ期临床研究,2 周方案疾病控制率为47.7%,2 周方案与3 周方案的中位OS分别为14.2个月和13.2个月[20]。本研究采用免疫治疗的样本少,仍需大样本、前瞻性的临床试验证实免疫治疗在SHC中的确切疗效。
综上所述,SHC 临床罕见,肿瘤大小普遍大于普通型肝癌,且分化差,恶性程度高。对于Ⅰ期患者,可行外科切除或肝移植。行外科手术前应根据患者耐受情况、瘤体大小、治疗成本和收益慎重选择。若瘤体巨大,可术前行介入栓塞术以增加R0 切除率。术后辅助治疗可使患者预后获益。对于Ⅲ~Ⅳ期患者,手术并不能使患者获益,可行全身化疗、口服靶向药、局部治疗等减轻肿瘤负荷。随着免疫治疗的兴起,SHC患者是否可以从免疫治疗中获益是下一步需要探索的问题。

