MEX3A在非小细胞肺癌中的表达与功能研究*
朱贝 郭小朋 董天祺 肖春杰
在过去30年间,中国肺癌相关死亡上升了4倍以上[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌相关死亡约80%[2]。NSCLC的发生和发展通常与肿瘤相关基因的表达有关。因此,寻找NSCLC 新的分子生物学标志物并将其作为NSCLC诊断及治疗靶点至关重要。
MEX3A蛋白是一种RNA结合蛋白,其N端具有高度保守的KH结构域[3-4],MEX3A通过KH结构域与mRNA,介导mRNA的翻译、监控和降解过程[5],进而调节细胞的一系列功能。已有研究表明,MEX3A在膀胱癌、胃癌[6]、肾母细胞瘤[7]、膀胱尿路上皮癌[8]以及肝癌[9]中异常表达,但MEX3A 在NSCLC中的作用及功能却鲜有研究。据此,本文探究了MEX3A 在NSCLC 中的表达效果以及沉默MEX3A基因后对NSCLC发生和发展的影响。
1 材料与方法
1.1 材料
1.1.1 转录组芯片分析及TCGA数据库数据分析 利用转录组芯片分析技术,对云南省肿瘤医院收集的15例宣威地区的肺癌样本(癌和癌旁组织)进行mRNA转录组芯片分析,通过芯片制备、杂交反应、信号检测、数据分析,筛选出差异基因。对来自癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库中共226例肺腺癌样本与20例正常组织样本进行RNA序列分析。
1.1.2 细胞系与细胞培养 人NSCLC 细胞系A549、NCI-H292 及人正常的肺上皮细胞系BEAS-2B 均购自昆明动物研究所细胞中心,XWLC和GLC均受赠于云南省肿瘤医院。A549、NCI-H292和BEAS-2B细胞均在RPMI-1640 培养基(Hyclone,美国)中培养,XWLC和GLC 在DMEM 高糖培养基(Hyclone,美国)中培养,每种培养基中均添加10%胎牛血清(Hyclone,美国)、100 g/mL青霉素和100 g/mL链霉素(Hyclone,美国)。所有细胞均培养在37℃、5%CO2的恒温培养箱中培养。
1.2 方法
1.2.1 细胞转染 选取MEX3A 高表达的A549和NCI-H292细胞系进行转染。细胞以5×104/孔接种于培养皿中,培养24 h 后,更换为不含抗生素的培养基,用脂质体RNAiMAX(Invitrogen,美国)将MEX3A的靶向抑制剂小干扰RNA(siMEX3A:5'-GCAAGAUCCUCGAGUACAATT-3',上海吉玛公司)和阴性对照siRNA(siNC:5'-UUCUCUCUC CGAACGUGUCUCUCUGACGUTU TT-3',上海吉玛公司)转染至细胞,转染后继续培养48 h以待分析。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR) 根据试剂盒说明,提取细胞总RNA并将其反转录为cDNA(PrimeScriptTMRT 反转录试剂盒,Takara,中国)。人GAPDH 用作内参基因,qRT-PCR 监测MEX3A 在BEAS-2B、NCI-H292、A549、XWLC和GLC 细胞中的表达水平。引物序列见表1。
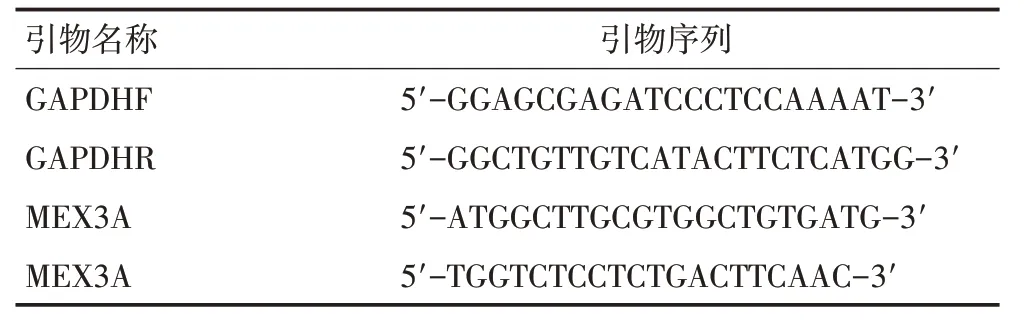
表1 引物序列
1.2.3 细胞增殖试验 将3 000/孔细胞悬液接种在96孔板(Corning Costar,美国)中,设置3个复孔,分别在转染24、48和72 h后中加入10 μL CCK8试剂(Dojindo Laboratories,Kumamoto,日本),加入CCK8试剂2.5 h后,3 h内每隔30 min用多功能酶标仪测量细胞OD 450 nm处的吸光度。
1.2.4 Transwell 试验 在Transwell小室(Corning Costar,美国)中铺好10 μL的基质胶(25 mg/50 mL,BD Biosciences,美国),在无血清培养基培养细胞12 h,然后以30 000/孔将细胞接种到Transwell小室的上室中,下室用含20%胎牛血清的培养基作为诱导物,37℃培养48 h,去除培养基并用4%多聚甲醛(生工生物工程有限公司,上海)固定细胞,0.1%吉姆萨染液(北京索莱宝科技有限公司,北京)染色细胞。细胞迁移测定在相同条件下进行,上室不覆盖基质胶。最后所有细胞均于10×10倍显微镜下观察拍照。
1.2.5 细胞周期与凋亡试验 细胞周期试验:收集并纯化细胞,70%预冷的乙醇(生工生物工程有限公司,上海)固定细胞12 h,PBS 洗去乙醇,与核糖核酸酶A(10 mg/mL,BD Biosciences,美国)37℃反应30 min,碘化丙啶(10 μg/mL,BD Biosciences,美国)避光染色30 min。流式细胞仪(BD Biosciences,美国)分析细胞周期,采用FlowJo 7.61软件评估G0-G1、S和G2-M期细胞的百分比。
细胞凋亡试验:用不含EDTA的胰酶消化细胞,无双抗的培养基终止消化,收集并重悬细胞,分别加5 μL碘化丙啶和5 μL Annexin V-FITC染液(细胞凋亡试剂盒,BD Biosciences,美国)避光染色20 min。流式细胞仪分析细胞凋亡。
1.3 统计学分析
采用SPSS 16.0和GraphPad Prism 5.0软件进行统计学分析。t检验用于比较组间差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 MEX3A在NSCLC中高表达
本研究对在云南省肿瘤医院收集的15例宣威地区肺癌样本(癌和癌旁组织)进行mRNA 转录组芯片分析(表2),共筛选出2 724个差异表达的基因,606个基因的mRNA表达水平显著上调,2 118个基因的mRNA表达水平显著下调。表达上调的基因中,MEX3A、ARHGAP40、GPR110、FLJ13744、PSAT1、B3GNT6、FUT2、MND1、CXCL13、MUC21 上调倍数均高于6倍(P<0.05,表3)。通过筛查基因背景后,选择表达效果明显的MEX3A基因(P<0.01,表3)作为研究对象。对TCGA数据库数据进行统计分析显示,与正常组织(n=20)相比,MEX3A mRNA 在肺腺癌组织(n=226)中显著高表达(P<0.001,图1A)。
qRT-PCR结果显示,与癌旁细胞系BEAS-2B 相比,A549、NCI-H292 细胞系中MEX3A mRNA表达水平显著高于BEAS-2B(P<0.001,图1B)。此外,qRTPCR结果显示沉默MEX3A(siMEX3A)后,A549和NCI-H292的MEX3A的mRNA表达水平显著降低(P<0.001,图1C)。
表2 新鲜组织样本临床病理资料
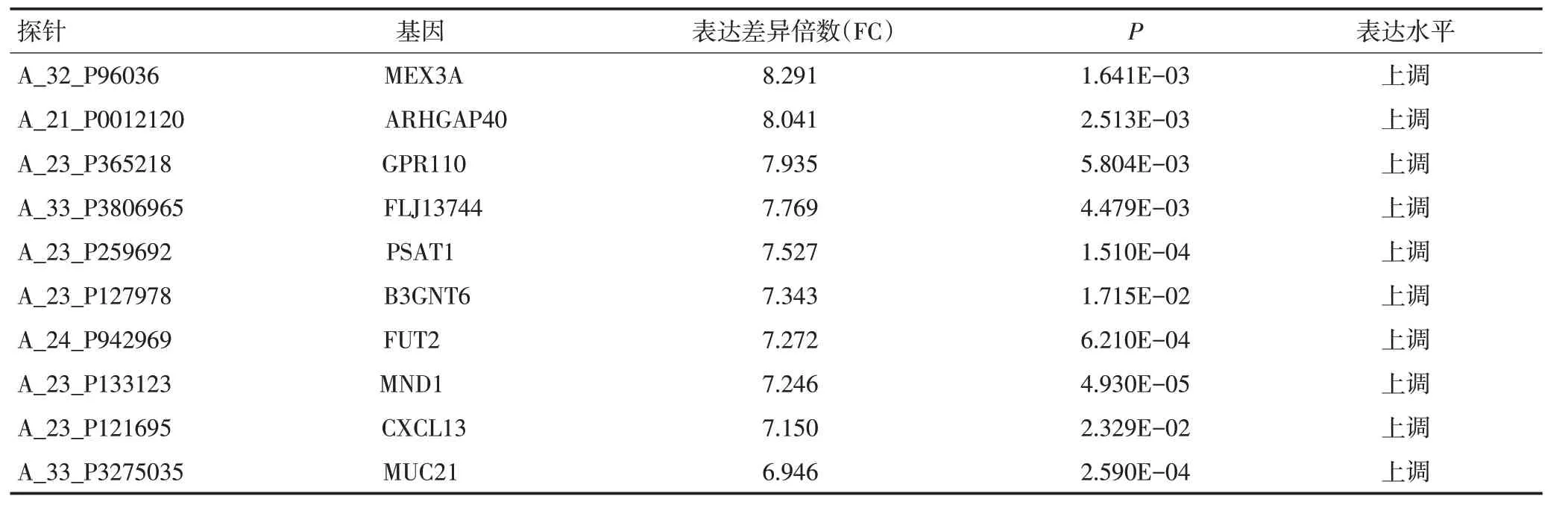
表3 mRNA转录组芯片筛选出在NSCLC中上调的mRNAs
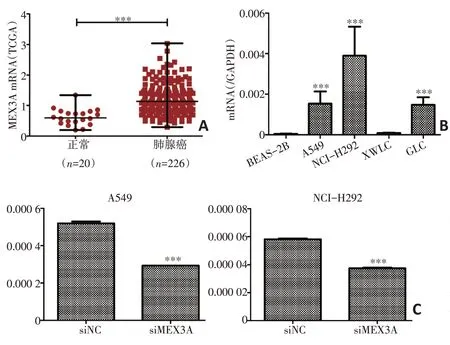
图1 MEX3A在NSCLC中高表达
2.2 沉默MEX3A对NSCLC增殖的影响
CCK8试验结果显示,与阴性对照组(siNC)相比,沉默MEX3A后,A549和NCI-H292的增殖能力均被显著抑制(P<0.05,图2)。
2.3 沉默MEX3A对NSCLC侵袭及迁移的影响
Transwell试验结果显示,与阴性对照组相比,沉默MEX3A后A549和NCI-H292细胞的侵袭(P<0.001)及迁移(P<0.001)能力均明显减弱(图3)。
2.4 沉默MEX3A对NSCLC凋亡的影响
流式细胞试验结果显示,MEX3A被沉默后促进A549(P<0.05)和NCI-H292(P<0.001)的凋亡(图4)。
2.5 沉默MEX3A对NSCLC周期的影响
流式细胞试验结果显示,沉默MEX3A后A549及NCI-H292中G2/M期细胞明显增多,细胞周期均被阻滞于G2/M期(P<0.001,图5)。
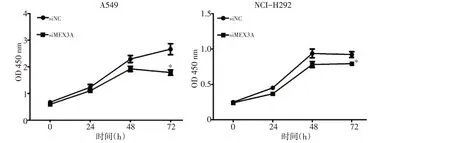
图2 沉默MEX3A基因后抑制NSCLC的增殖
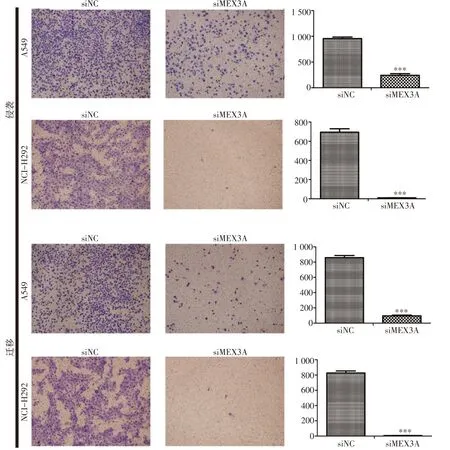
图3 沉默MEX3A基因后抑制NSCLC的侵袭及迁移
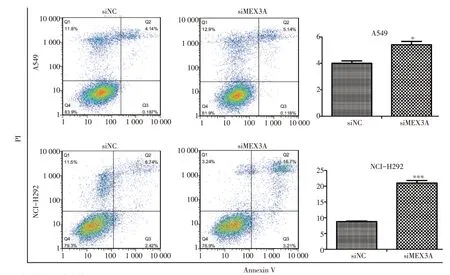
图4 沉默MEX3A基因后诱导NSCLC细胞凋亡
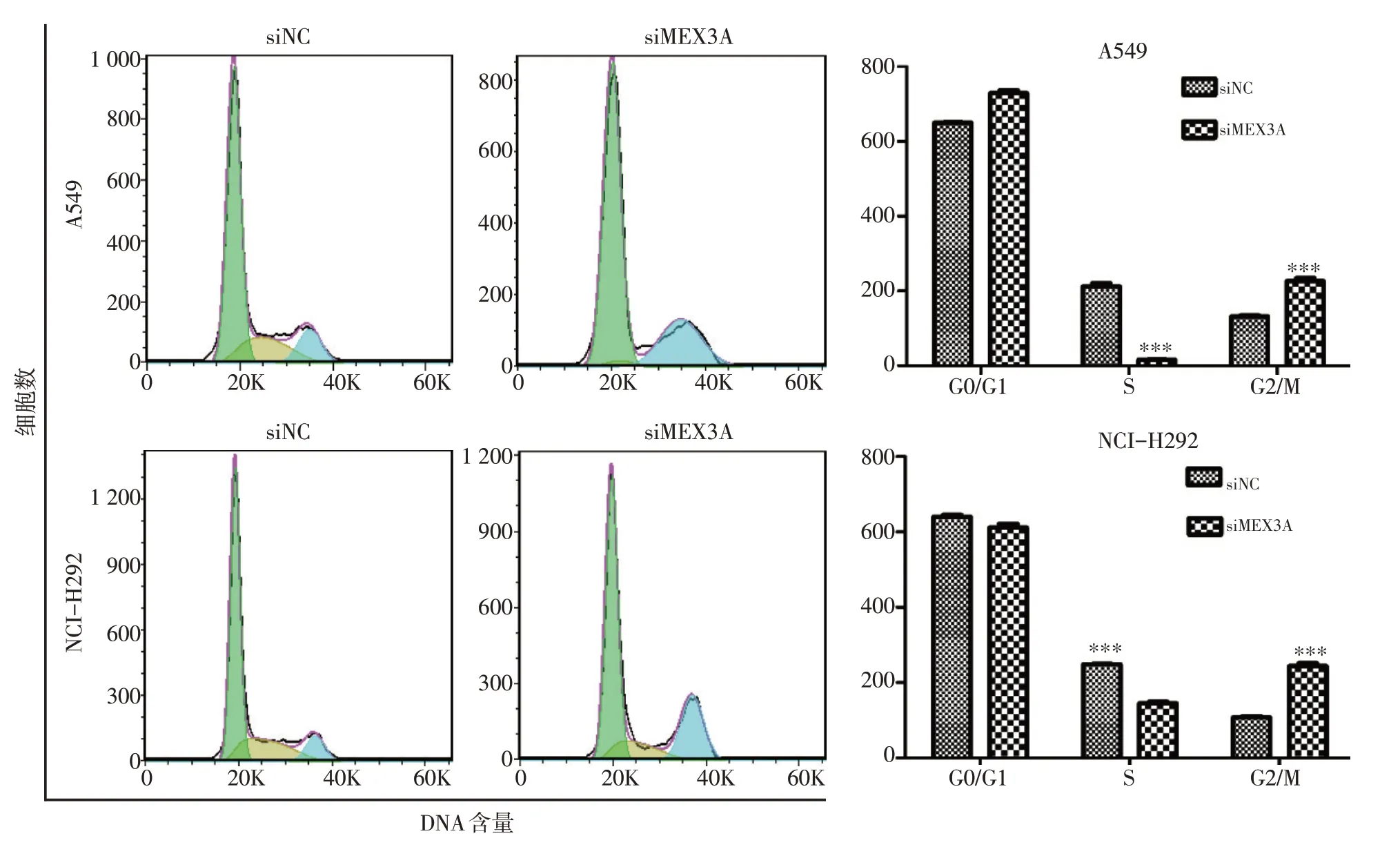
图5 沉默MEX3A基因后阻滞NSCLC细胞周期
3 讨论
NSCLC的靶向治疗已取得突破性进展[10],但由于诊断和治疗方法有限,导致NSCLC患者的生存和预后仍不理想。遗传因素是引起NSCLC的主要原因,研究表明,超过40%NSCLC是由未知基因异常表达引起的[11]。因此,找到NSCLC的相关生物标志物,并了解其致癌机制,对NSCLC的早期诊断和寻找治疗靶点极为重要。
MEX3是在秀丽隐杆线虫中发现的一类翻译调节蛋白,该蛋白能抑制蛋白翻译过程[12]。MEX3 包含MEX3A、MEX3B、MEX3C、MEX3D基因[3],已有研究表明,MEX3蛋白的相关基因异常表达会引起胚胎死亡[12]。其中MEX3A与MEX3B是P小体的组成部分,P小体可浓缩细胞质中的酶,进而参与mRNA的调控过程[13-14]。现已有证据表明MEX3A可通过介导mRNA的代谢过程,参与细胞的生命进程。MEX3A基因的异常表达会引起癌症等多种疾病,有研究发现,MEX3A是肾母细胞瘤潜在的致癌基因[7],但MEX3A在NSCLC中的表达效果及其相关功能却鲜见研究。因此,本文对MEX3A在NSCLC中的表达与功能进行探索。首先,通过转录组芯片分析筛选出在NSCLC中表达上调最显著的MEX3A基因。为探索MEX3A基因在NSCLC中的表达水平,对TCGA数据库中226例肺腺癌样本和20例正常样本进行分析,发现MEX3A mRNA在肺腺癌组织(n=226)中显著高表达(P<0.001),与此同时qRT-PCR的结果也显示MEX3A mRNA在NSCLC细胞系A549和NCI-H292中表达显著升高(P<0.001)。以上结果均表明MEX3A在NSCLC中显著高表达。
已有研究发现,RNA干扰技术沉默MEX3A基因后膀胱癌细胞的增殖能力受到明显抑制,且凋亡效率明显增加[15-16],Shi等[8]也发现MEX3A能促进乳头状膀胱尿路上皮癌细胞的增殖和迁移,但却鲜有MEX3A 对NSCLC影响的相关研究。因此,为进一步探索MEX3A在NSCLC中的功能,本研究通过RNA干扰技术沉默A549和NCI-H292的MEX3A基因,结果提示沉默MEX3A后NSCLC的增殖(P<0.05)、侵袭(P<0.001)及迁移(P<0.001)能力均明显减弱,提示MEX3A可能作为NSCLC的异常基因导致NSCLC 异常增殖并失去接触抑制,而沉默MEX3A基因能降低上述异常功能。
细胞的增殖和凋亡与细胞周期调控有关,细胞周期调控异常会导致细胞增殖及凋亡异常,进而引发肿瘤。G2/M期是DNA损伤修复的重要时期,G2/M期被阻滞使DNA 损伤无法被修复而走向凋亡。研究发现,MEX3A基因在胃癌细胞中高表达,主要在胃癌细胞的G2/M期发挥作用从而促进胃癌细胞的增殖与侵袭,而沉默MEX3A能有效抑制该过程[6],亦有研究表明MEX3A可以影响肠细胞的分化和细胞周期进程[17]。但目前尚缺乏关于MEX3A对NSCLC细胞凋亡和周期的影响的相关报道,本研究发现沉默MEX3A基因后A549和NCIH292细胞被明显阻滞于G2/M期(P<0.001),A549和NCIH292 细胞凋亡显著上升(P<0.05)。结果提示沉默MEX3A基因可导致NSCLC被阻滞于G2/M期,并最终诱导NSCLC凋亡。
综上所述,MEX3A可能作为促癌基因参与了NSCLC细胞的生长和增殖过程,而沉默MEX3A能降低该过程。该研究为继续探究MEX3A的相关作用机制奠定了基础,提示MEX3A或许可作为NSCLC诊断和治疗的标志物,为攻克NSCLC提供新的靶点。

