海南黎族发酵海产品中微生物多样性分析
马臣臣 姜帅铭 彭倩楠 霍冬雪 张家超
(海南大学食品科学与工程学院 海口570228)
传统发酵食品在我国有着数千年的历史,因其独特的制作工艺、风味及营养价值而得以延存,至今深受大家的喜爱[1]。 海南,独特的地理位置与气候特点,以及海南黎族清淡的饮食习惯,使得黎族人民将发酵海产品的制作发挥到极致,以鱼酱、虾酱、蟹酱最为常见。 鱼酱,又名鱼茶、鱼酸,是将干饭或稀饭伴入淡海鱼, 加少许盐入缸腌制的发酵食品[2]。 虾酱和蟹酱是将虾或蟹捣碎,加盐发酵后制成的营养丰富的调味品[3-5]。 传统发酵海产品已成为海南人民日常餐桌必不可少的美食, 成为招待客人的佳肴。
微生物多样性的分析和乳酸菌的分离与鉴定是研究传统发酵制品的常用方法。刘芳等[6]对内蒙古酸马奶的研究显示:优势菌是屎肠球菌(Enterococcus faecium)、乳酸乳球菌(Lactococcus lactis)等。 越南的短期及长期发酵制品的微生物多样性十分丰富,不同及同种制品、不同地区的优势菌种存在显著差异[7]。对韩国8 种传统发酵制品的研究揭示了其微生物群落特点[8]。对菲律宾传统发酵制品的微生物多样性的分析, 鉴定出面包乳杆菌(Lactobacillus panis)、 食窦魏斯氏菌(Weissella cibaria),完善了对当地发酵制品微生物多样性的认识[9]。 对我国豆瓣酱发酵过程中菌群的动态监控,揭示了优势菌群与其风味质量的关系[10]。 这些研究为挖掘传统发酵食品中有益微生物资源打下基础。
海南岛,长夏无冬,属于热带季风型气候,有着国内少有的传统发酵海产品研究模型(虾酱、蟹酱、鱼酱),目前对于海南发酵海产品微生物多样性的研究相对较少。 本研究结合传统微生物纯培养技术、16S rRNA 测序技术和高通量测序技术探究海南传统发酵海产品微生物多样性, 旨在挖掘热带有益微生物资源, 力求指导工厂化生产以改善传统加工工艺,提高产品质量。
1 材料与方法
1.1 材料与试剂
虾酱、蟹酱、鱼酱采自海南省陵水、保亭、乐东、白沙黎族自治县和万宁市,共计24 份样品,其中虾酱10 份,蟹酱5 份,鱼酱9 份。 东南部地区15 份样品(6 份鱼酱、4 份虾酱、5 份蟹酱),西南部地区9 份样品(3 份鱼酱、6 份虾酱)。 样品采集后全程4 ℃保藏箱保存, 以防止样品微生物结构发生变化。
MRS 肉汤, 广州环凯微生物科技有限公司;6×DNA 凝胶加样缓冲液,上海桑尼生物科技有限公司;2×Es Taq Master Mix PCR 扩增预混液、DM2000 DNA 标准品、蛋白酶K,北京康为世纪生物科技有限公司;SYBR Green 荧光染料2×Buffer,宝生物工程(大连)有限公司;Gold ViewTM核酸染料,美国Amerco 公司; Agarose LE,天根生化科技(北京)有限公司。
1.2 仪器与设备
PCR 扩增仪,杭州朗基科学有限公司;凝胶成像分析系统,美国Cell Biosciences;高速冷冻离心机,Thermo Scientific;电泳仪(DYY-12),北京市六一仪器厂;高速离心机(TGL-16G),上海安亭科学仪器厂;双目生物显微镜(DP72),日本Olympus公司。
1.3 方法
1.3.1 样品的采集与预处理 24 份发酵海产品(5 份蟹酱、10 份虾酱、9 份鱼酱)放入无菌容器中,4 ℃条件置于保温箱中,运至实验室立即处理。准确称取5 g 各发酵样品至45 mL 0.85%无菌生理盐水中混合均匀, 按10 倍梯度稀释法制成10-1~10-4的样品稀释液。
1.3.2 微生物的分离与纯化 吸取各浓度的样品稀释液100 μL, 涂布于MRS 琼脂培养基表面,每个稀释度涂布1 个平板,37 ℃条件下置厌氧罐中厌氧培养48 h。观察菌落形态,从最佳稀释梯度培养基中挑选疑似乳酸菌菌落,接种到培养MRS 培养基中,37 ℃恒温条件下培养24 h。 培养完成后,采用革兰氏染色法在光学显微镜下观察菌体形态,选取纯菌种继续传代培养24 h,而后离心收集菌体,采用脱脂乳法于-40 ℃保存菌种。
1.3.3 16S rRNA 测序 采用CTAB 冻融法[11-13]提取菌株的DNA。 利用1.0%的琼脂糖凝胶电泳,在100 V 电压下0.5×TBE 电泳液中电泳15 min,检测提取DNA 的质量, 并将提取的DNA 置于-20℃条件下保存。
16S rRNA扩增引物为 27F:5’ -AGAGTTTGATCATGGCTCAG -3’,1492R:5’ -TAGGGTTACCTTGTTACGACTT-3’[14-15]。PCR 扩增体系(50 μL):2×Es Taq Master Mix 扩增预混液25 μL、引物(10 pmol/μL)各1.5 μL、基因组DNA模板(100 ng/μL)1.5 μL、dd H2O 20.5 μL。 反应参数:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min, 循环30 次;72 ℃末端延伸10 min,4 ℃条件下保温。
PCR 扩增结束后,取2 μL PCR 产物与2 μL 6×DNA 凝胶加样缓冲液混合于1.0%琼脂糖凝胶中点样电泳(100 V 15 min),如在约1 500 bp 处观察到清晰的条带,且无明显的非特异性扩增,表明PCR 成功。 测序工作由上海派诺森生物科技股份有限公司完成。序列信息通过SeqMan 进行手动校准, 并将校准后的序列信息输入NCBI 数据库中进行BLAST 比对分析,选择覆盖率与准确率均在98%及以上的分析结果。 同时选取样品中的代表菌株及其相似菌种, 利用MEGA7.0 中Neighbor-Joining 法构建系统发育树。
获得分离菌株的鉴定结果后, 比较各样品中的微生物多样性, 选取微生物多样性最好的发酵海产样品, 采用CTAB 冻融法提取样品宏基因组DNA,通过454 焦磷酸测序技术对16S rRNAV3-V4 进行高通量测序,通过比对16S rRNA V3-V4序列获得V3-V4 独特序列组。 在选择代表序列后, 按照97%的相似性阈值将序列划分为不同的OTU,通过OTU 分析,研究样品中微生物多样性和不同微生物的丰度。 利用Kruskal-Wallis 进行多重检验, 细化差异性菌属, 通过Weighted Unifrac Distance 比较不同发酵海产品Beta 多样性。 数据分析主要采用R 程序。
2 结果分析
2.1 微生物分离与纯化
经过微生物的分离与纯化,从24 份样品中共分离出180 株菌,其中蟹酱37 株、虾酱72 株、鱼酱71 株,分别占20.1%,40%,39.9%。 海南东南部各黎族自治县118 株,占64.1%;西南部各黎族自治县62 株,占35.9%。
2.2 16S rRNA 序列同源分析鉴定结果
将16S rRNA 基因序列分析结果通过NCBI数据库进行BLAST 分析。 鉴定出乳杆菌属(Lactobacillus)161 株、 片球菌属 (Pediococcus)7 株、葡萄球菌(Staphylococcus)6 株、肠球菌属(Enterococcus)3 株、魏斯氏菌属 (Weissella)3 株,共180株菌。 其中乳杆菌属(Lactobacillus)含量最高,结合图1 可知乳杆菌属为优势菌属,占89.4%。 在种的水平上,植物乳杆菌(Lactobacillus plantarum)72 株,占44.7%,发酵乳杆菌(Lactobacillus fermentum)54 株,占33.5%是优势菌种,其次还包括罗伊氏乳杆菌(Lactobacillus reuteri)8 株、那慕尔乳杆菌(Lactobacillus namurensis)6 株、戊糖乳杆菌(Lactobacillus pentosus)5 株、桥乳杆菌(Lactobacillus pontis)4 株、香肠乳杆菌(Lactobacillus farciminis)3 株、副干酪乳杆菌(Lactobacillus paracasei)3 株、福菜乳杆菌(Lactobacillus futsaii)2 株、酸鱼乳杆菌(Lactobacillus acidipiscis)1 株、短乳杆菌(Lactobacillus brevis)1 株、布赫内氏乳杆菌(Lactobacillus buchneri)1 株、面包乳杆菌(Lactobacillus panis)1 株。片球菌属共鉴定出7 株,包括乳酸片球菌 (Pediococcus acidilactici)1 株和戊糖片球菌(Pediococcus pentosaceus)6 株。 葡萄球菌属分离出香料葡萄球菌 (Staphylococcus condimenti)2 株和表皮葡萄球菌 (Staphylococcus epidermidis)4 株。 占菌属总数1.7%的肠球菌属被鉴定为粪肠球菌(Enterococcus faecalis)3 株,魏斯氏菌属被鉴定为食窦魏斯氏菌1 株和融合魏斯氏菌(Weissella confusa)2 株。

表1 16S rRNA 序列同源分析鉴定Table 1 Identification of isolates based on 16S rRNA sequencing

图1 分离鉴定结果Fig.1 The result of isolation and identification
2.3 不同发酵海产品的微生物多样性分析
结合表1 和图2 可以看出,鱼酱的微生物多样性高于虾酱和蟹酱。 植物乳杆菌、发酵乳杆菌均为3 种发酵海产品的优势菌种,不同的是在虾酱中发酵乳杆菌的数量是植物乳杆菌的2 倍左右,而蟹酱和鱼酱中前者仅是后者的1/2~1/3。 除此之外,桥乳杆菌、罗伊氏乳杆菌、香料葡萄球菌、表皮葡萄球菌均只存在于虾酱中, 共计18 株,占虾酱中分离菌株的25%。 蟹酱中独有的菌种为短乳杆菌、香肠乳杆菌,共计4 株,占蟹酱中分离菌株的10.8%。 鱼酱中特有的菌种最多,包括粪肠球菌、酸鱼乳杆菌、布赫内氏乳杆菌、那慕尔乳杆菌、面包乳杆菌、副干酪乳杆菌、乳酸片球菌、食窦魏斯氏菌、融合魏斯氏菌,共计19 株,占鱼酱总分离菌株的26.8%。
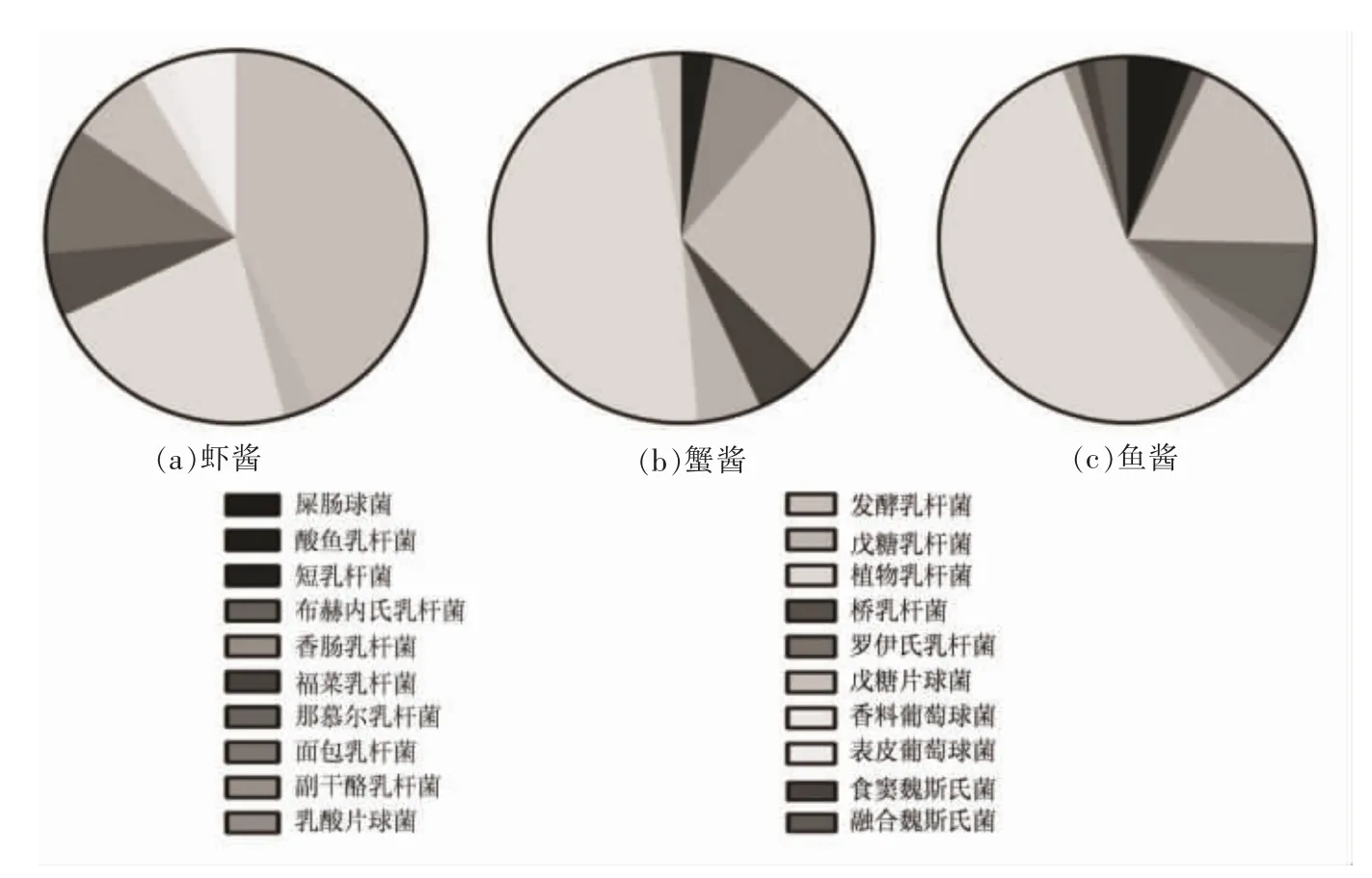
图2 不同种类发酵海产品微生物多样性对比Fig.2 Comparison of microbial diversity from different fermented seafood
2.4 不同地区发酵海产品微生物多样性分析
从海南东南部地区采集的发酵海产品中共鉴定出肠球菌属3 株、乳杆菌属104 株、片球菌属6株、葡萄球菌属2 株、魏斯氏属3 株,共计118 株,占菌种总数的65.6%。 从西南部地区的发酵海产品中鉴定出乳杆菌属57 株、片球菌属1 株、葡萄球菌属4 株,共计62 株,占34.4%。 无论是东南部地区还是西南部地区其优势菌株均为植物乳杆菌、发酵乳杆菌。 植物乳杆菌分别占东南地区、西南地区分离菌株的39.8%,40.3%, 发酵乳杆菌占28.0%,33.9%。除两种优势菌种外,那慕尔乳杆菌、戊糖乳杆菌、 戊糖片球菌均从两地样品中被分离出,共计17 株,占菌种总数9.4%,相似性较低。 酸鱼乳杆菌、副干酪乳杆菌、表皮葡萄球菌仅在西南地区被分离出,共计8 株,占西南地区样品菌株的12.9%。 罗伊氏乳杆菌、桥乳杆菌、香肠乳杆菌、粪肠球菌、融合魏斯氏菌、香料葡萄球菌、福菜乳杆菌、食窦魏斯氏菌、乳酸片球菌、面包乳杆菌、布赫内氏乳杆菌仅存在于东南部地区样品中,共计31株,占东南地区样品菌株的26.3%。 结合表1 及图3 可知海南东南地区发酵海产品的微生物多样性高于西南地区。
2.5 系统发育树分析
选取发酵海产品中代表菌株及相似菌株,用MEGA7.0 中邻近法构建系统发育树, 并用Bootstrap 检验1 000 次随机验证重复, 结果显示可信度较高, 表示所选菌株所处分类学地位以及系统发育关系。如图4 所示,所选代表菌株在系统发育树中分为13 个分支:A6 与戊糖乳杆菌a2 在一个分支; A36 与福菜乳杆菌 CS5 在一个分支;A43与罗伊氏乳杆菌VB4 在一个分支;A89 与桥乳杆菌 NM100-2 在一个分支;A51 与融合魏斯氏BSR5 在一个分支;A26 与戊糖片球菌JCM 20459在一个分支;A42 与发酵乳杆菌 MGC16-1 在一个分支;A94 与粪肠球菌TS4E2 在一个分支;B5与面包乳杆菌JCM 11053 在一个分支;C36 与发酵乳杆菌 KFC 在一个分支;C28 与植物乳杆菌IMAU80058 在一个分支;B8 与布赫内氏乳杆菌DG3 在一个分支;B90 与那慕尔乳杆菌 NBRC 107158 在一个分支。

图3 不同地区发酵海产品微生物多样性对比Fig.3 Comparison of microbial diversity in fermented seafood from different regions
2.6 发酵海产品微生物群落分析
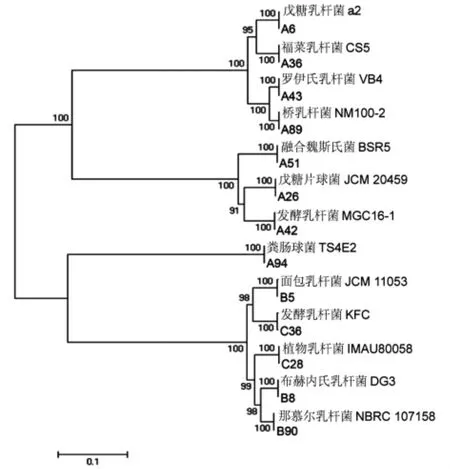
图4 发酵海产品微生物16S rRNA 基因序系统发育树Fig.4 Phylogenetic tree based on 16S rRNA of fermennted seafood microorganisms
经16S rRNA V3~V4 可变区高通量测序,结果显示,9 份样品都主要由厚壁菌门(Firmicute)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)组成。 在上述门水平上, 蟹酱中的组成依次为93.97%,4.58%,0.14%,0.085%,0.019%。 鱼酱中的组成依次是64.05%,21.80%、2.1%,1.73%,0.39%,且酸杆菌门(Acidobacteria)含量也较高,占1.5%。虾酱中的组成依次是34.13%,26.45%,8.44%,2.14%,11.03%,且酸杆菌门含量也较高,占3.76%,芽单胞菌门(Gemmatimonadetes)占2.6%。 可见虾酱中厚壁菌门的含量明显低于蟹酱和鱼酱, 酸杆菌门明显高于蟹酱和鱼酱。 蟹酱中变形菌门的含量明显低于鱼酱和虾酱。如图5 所示,在属的水平上,乳杆菌属、片球菌属、魏斯氏属、半乳糖产己酸菌属、芽孢杆菌属、梭状芽孢杆菌属、链球菌属、葡糖杆菌属在9 个发酵海产品中占18.5%,9.91%,9.53%,8.37%,4.17%,2.58%,2.52%,2.02%。 可见海南发酵海产品微生物多样性丰富, 不同发酵海产品微生物群落特点鲜明。

图5 发酵海产品微生物群落分析Fig.5 Analysis of microbial community in fermented seafood
2.7 差异性分析
比较分析9 份海南发酵海产品中的差异性菌属, 选择平均含量大于0.1%,P<0.05 的菌属列于表2。 厚壁菌门的碱芽孢杆菌属(Alkalibacillus)仅存于虾酱中,具有显著优势。唯独鱼酱中没有F 厚壁菌门的慢生芽孢杆菌属(Lentibacillus)。 鱼酱中的放线菌门的棒状杆菌属明显高于蟹酱与虾酱。
不同发酵海产品的群落差异性见图6。 蟹酱与鱼酱样品的加权距离主要集中在0.4~0.6,蟹酱与虾酱样品的加权距离主要集中在1.1~1.3,鱼酱与虾酱样品的加权距离主要集中在1.0~1.2,表明蟹酱与鱼酱的微生物群落差异最大, 鱼酱与虾酱的差异性略大于蟹酱与虾酱的差异性。

表2 发酵海产品的差异性菌属Table 2 The different microbiota in fermented seafood samples
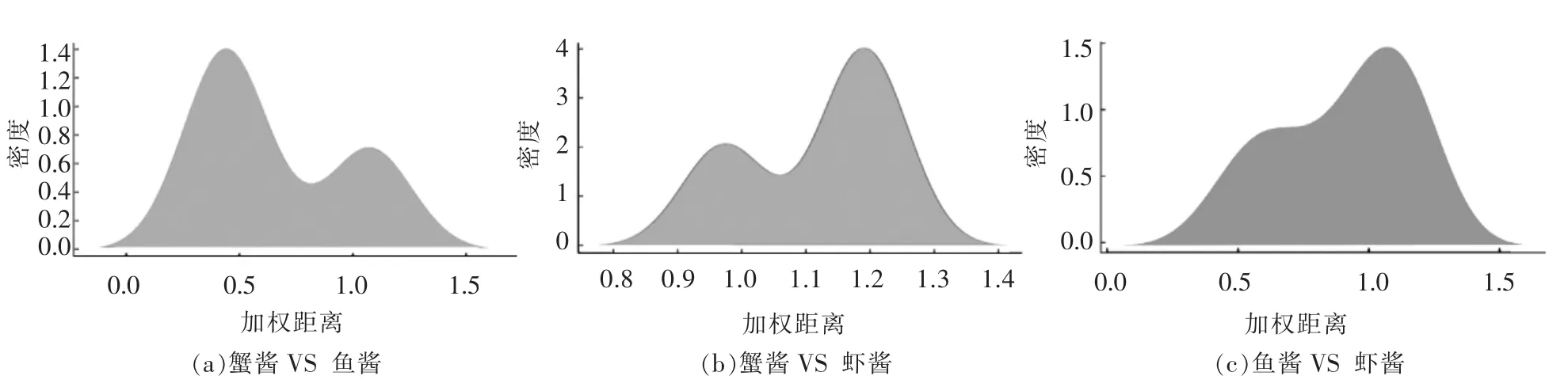
图6 基于加权距离的发酵海产品差异性分析Fig.6 Different analysis in fermented seafood samples based on weighted unifrac distance
3 讨论
本研究采用传统微生物纯培养技术与16S rRNA 基因序列同源性分析,对海南不同种类及不同地区的发酵海产品进行微生物多样性分析,结果表明,乳杆菌属为海南发酵海产品优势菌属,植物乳杆菌、发酵乳杆菌为优势菌种。这一结果与陈川平等[16]和王晓茹等[17]的研究相比,发酵乳杆菌是鱼酱的优势菌,而戊糖乳杆菌含量并不显著,这可能是由于发酵时间不同以及发酵原料和黎族家庭制作工艺不同所致。 本研究首次从鱼酱中分离出酸鱼乳杆菌、面包乳杆菌、副干酪乳杆菌、戊糖乳杆菌, 且分离出属于片球菌属的乳酸片球菌和属于魏斯氏菌属的食窦魏斯氏、融合魏斯氏。有研究表明,片球菌属、魏斯氏属同样存在于缅甸发酵鱼制品中[18],这些菌株对发酵制品品质的影响值得深入研究。 干燥的沙特阿拉伯地区的发酵鱼制品优势菌属是芽孢杆菌属、葡萄球菌属[19]。 可见,气候是影响优势菌群的因素之一。 研究发现我国江浙地区传统发酵制品蟹糊中的优势菌是葡萄球菌[20-21],而韩国发酵蟹酱中优势菌属为魏斯氏菌属[22],虾酱中优势菌属为芽孢杆菌属[23],这与海南蟹酱、虾酱中的优势菌群存在显著差异,可能是由于不同国家、地区制作工艺不同,原料本身所携带的优势菌种以及初始发酵时腌制环境不同所致。同样,吕彦等[24]认为蟹酱中嗜盐微生物的优势菌种可能是葡萄球菌, 柬埔寨虾酱中葡萄球菌丰度也较高[25],且影响蟹酱与虾酱品质。 本研究未从蟹酱中分离出葡萄球菌, 而从虾酱中分离出6 株葡萄球菌, 葡萄球菌对海南虾酱品质风味的影响值得探究。 仅在海南发酵海产品——虾酱中发现的桥乳杆菌,在菲律宾发酵虾酱种也有所发现[8]。 通过对9 个发酵海产品的微生物群落及差异性菌属的分析,发现蟹酱、虾酱、鱼酱的微生物群落存在明显差异, 其中蟹酱与鱼酱的微生物群落差异性最大,体现海南发酵海产品微生物群落特征。

