绿豆寡肽对脂多糖诱导巨噬细胞RAW264.7的抗炎作用
于 笛 周 伟 郭增旺 刁静静,2 迟治平 张丽萍,2*
(1 黑龙江八一农垦大学 黑龙江大庆 163319 2 国家杂粮工程技术研究中心 黑龙江大庆163319)
炎症是机体针对各种致炎因子如感染和组织损伤而产生的一系列以防御为主的生理性或病理性应答反应,是机体天然免疫的重要组成部分。过度的炎症会对机体造成损害或疾病, 严重时还会危及生命[1-2]。 巨噬细胞是机体固有免疫的重要组成细胞,不仅参与机体的大多数免疫反应,而且在炎症反应过程中具有重要作用[3]。 炎症状态下,巨噬细胞通过分泌细胞因子及抗原提呈等作用影响并调控炎症反应,其自身的吞噬能力也增强,能够杀灭和消化机体内抗原性异物[4-5]。 脂多糖(lipopolyssacharide,LPS)是全身炎症反应综合征的一种重要致病因子, 可与巨噬细胞表面抗原识别受体相结合而刺激细胞, 继而激活多条炎症通路,产生一系列促炎因子,引起机体严重的炎症反应[6-7]。
有研究显示,大豆、豌豆、羽扇豆等的蛋白水解产物具有调节炎症的潜力。 Vernaza 等[8]发现利用大豆制备的蛋白质水解产物能够显著减弱LPS诱导的巨噬细胞RAW264.7 中炎性标志物如NO、iNOS、PGE2 的产生。 Millan-Linares 等[9]发现羽扇豆的蛋白质水解产物可以减弱THP-1 巨噬细胞中促炎性细胞因子IL-1β,IL-6,TNF-α 和NO 的产生。 Ndiaye 等[10]发现来源于黄豌豆种子的蛋白质水解产物通过抑制活化的巨噬细胞中NO、TNF-α 和IL-6 的产生来发挥其抗炎作用。绿豆蛋白的水解产物绿豆肽 (mung bean peptides,MBPs)含有多种活性物质。 绿豆肽不仅能提高缺氧耐受力和人体的免疫力,还具有抗氧化性、ACE抑制活性、抗肿瘤、降血压、降胆固醇、改善肾功能等作用[11-15]。 然而,国内关于绿豆肽抗炎作用的研究鲜有报道。 本课题组有关绿豆肽的免疫调节作用已得到证实[16]。 本文通过LPS 诱导巨噬细胞RAW264.7 产生炎症反应, 观察绿豆肽对所产生的炎症反应是否有抑制作用, 为研究绿豆肽的抗炎作用及其机制提供基础理论参考。
1 材料与方法
1.1 材料与试剂
绿豆寡肽(水解度30%),实验室自制;巨噬细胞RAW264.7,中国科学院上海细胞库。
绿豆蛋白粉,山东招远市温记食品有限公司;碱性蛋白酶,丹麦诺维信公司;胎牛血清,杭州四季青生物工程材料有限公司;DMEM 培养基,Hyclone;青霉素-链霉素溶液,碧云天生物技术有限公司;PBS,索莱宝生物科技有限公司;胰酶,碧云天生物技术有限公司;LPS,Sigma 公司;LDH 试剂盒、MPO 试剂盒、GSH 试剂盒,南京建成生物工程研究所;BCA 蛋白浓度测定试剂盒,Wanleibo 公司;细胞因子试剂盒,联科生物有限公司;WST-1试剂盒, 碧云天生物技术有限公司; 中性红试剂盒,碧云天生物技术有限公司;其它试剂为分析纯级,国药集团化学试剂有限公司。
1.2 主要仪器、设备
倒置显微镜(AE31),麦克奥迪;酶标仪(ELX-800),美国BIOTEK;CO2恒温培养箱(HF-90),上海力申;SW-CJ-IF 型超净工作台,北京东联哈尔仪器制造有限公司; 低温高速冷冻离心机 (H-2050R),德国SORVALL。
1.3 试验方法
1.3.1 绿豆寡肽的制备方法 根据实验室前期的研究成果,参照王凯凯等[17]的方法制备绿豆蛋白水解液。 将制备的绿豆蛋白水解液用孔径为22 mm 的透析袋脱盐24 h。将脱盐处理的水解液用超滤分离装置进行超滤。超滤条件为压力0.25 MPa,常温,分子质量1 000 u 有机超滤膜。 收集分子质量低于1 000 u 组分,真空冷冻干燥,备用。将收集的样品用氨基酸自动分析仪参照GB/T5009.124-2003 测定氨基酸组成,Waters2695 高效液相色谱仪测定相对分子质量分布。
1.3.2 细胞培养及试验分组 巨噬细胞RAW264.7 培养于含10%胎牛血清的DMEM 培养基(含100 IU/mL 青霉素和100 IU/mL 链霉素),在37 ℃、5% CO2的培养箱中培养,待细胞长至对数生长期时, 用0.25%胰酶(含0.01% EDTA)消化,DMEM 培养基洗涤、离心,PBS 重新洗涤、离心后接种到培养皿中, 按试验分组进行培养。 对照组:加入等量的PBS 溶液;LPS 组:加入终质量浓度为2 μg/mL 的LPS;LPS+MBPs 处理组: 加入终质量浓度为2 μg/mL LPS 预孵育4 h,再分别加入终质量浓度为25,50,100 μg/mL 的MBPs。细胞培养12 h 后, 分别收集培养基和细胞做进一步分析。
1.3.3 细胞增殖检测 将对数生长期巨噬细胞RAW264.7 按照1×104/孔密度接种于96 孔板,按照试验分组培养12 h 后, 采用WST-1 法检测细胞增殖。 将各组细胞加入20 μL WST-1 溶液,置于细胞培养箱内继续孵育2 h 后,将96 孔板置于摇床上摇动1 min,以充分混匀待检测体系。 以酶标仪波长630 nm 作为参考波长, 在波长450 nm处测定吸光值。
1.3.4 细胞吞噬能力检测 将对数生长期巨噬细胞RAW264.7 按照1×104/孔密度接种于96 孔板,按照试验分组培养12 h 后,采用中性红检测细胞吞噬活性,PBS 溶液洗涤细胞1 次, 加入200 μL细胞培养液、20 μL 中性红染色液,在细胞培养箱中继续孵育2 h,去除含有中性红染色液的细胞培养液,用PBS 溶液洗涤1 次,加入200 μL 中性红检测裂解液,室温摇床上裂解10 min,在波长690 nm 处测量吸光值。
1.3.5 髓过氧化物酶(MPO)活性检测 将对数生长期巨噬细胞RAW264.7 按照3×105/孔密度接种于6 孔板,按照试验分组培养12 h 后,采用比色法测定细胞内髓过氧化物酶活性。 试验步骤按照试剂盒操作说明书进行。
1.3.6 乳酸脱氢酶(LDH)活性检测 将对数生长期巨噬细胞RAW264.7 按照3×105/孔密度接种于6 孔板,按照试验分组培养12 h 后,采用比色法测定细胞培养上清液中乳酸脱氢酶活性。 试验步骤按照试剂盒操作说明书进行。
1.3.7 还原型谷胱甘肽(GSH)含量检测 将对数生长期巨噬细胞RAW264.7 按照3×105/孔密度接种于6 孔板,按照试验分组培养12 h 后,采用比色法检测细胞内还原型谷胱甘肽含量, 试验步骤按照试剂盒操作说明书进行。
1.3.8 炎症因子含量检测 将对数生长期巨噬细胞RAW264.7 以3×105/孔密度接种于6 孔板,按照试验分组培养12 h 后,采用酶联免疫吸附测定试验(ELISA)测定细胞培养液中细胞因子IL-1α、IL-6、TNF-α 的含量,按照试剂盒说明书中方法和步骤测定。
1.3.9 数据处理方法 采用SPSS 19.0 进行方差分析和Duncan 式进行多重比较, 试验重复5 次,取平均值,结果以±s 表示。
2 试验结果
2.1 MBPs 对LPS 诱导巨噬细胞RAW264.7 细胞增殖的影响
适度的巨噬细胞增殖可提高机体抵御外界和修复机体损伤的能力, 而过度刺激会引起细胞的免疫反应,导致细胞凋亡和机体损伤[18]。 由表1 可知, 与对照组相比,LPS 显著抑制巨噬细胞增殖;与LPS 组相比,MBPs 低、中、高剂量组均显著缓解LPS 对巨噬细胞增殖的抑制作用(P<0.05), 并随MBPs 浓度的升高,缓解作用逐渐增强,呈现量效关系。 结果表明,MBPs 具有缓解LPS 抑制巨噬细胞增殖的能力。
2.2 MBPs 对LPS 诱导巨噬细胞RAW264.7 细胞吞噬能力的影响
吞噬能力指巨噬细胞通过吞噬侵入的病原体及体内衰老、 畸变的细胞而提高机体的抗感染能力,是衡量巨噬细胞活性的一个重要指标[19]。 巨噬细胞通过吞噬清除异物、 病原体以及外来细胞发挥免疫效应。 由图1 可知,与对照组相比,当巨噬细胞受到LPS 刺激时, 其吞噬能力显著增强;与LPS 组相比,MBPs 低剂量组差异无统计学意义,而低、中、高剂量的绿豆寡肽均能下调LPS 所引起的巨噬细胞吞噬能力增高, 并呈现量效关系。MBPs 对LPS 激活的巨噬细胞的吞噬能力具有显著抑制作用。
2.3 MBPs 对LPS 诱导巨噬细胞RAW264.7 髓过氧化物酶(MPO)活性的影响
髓过氧化物酶(MPO)是一种存在于髓系细胞嗜苯胺蓝颗粒中重要的含铁溶酶体酶, 由中性粒细胞、单核细胞和某些组织的巨噬细胞分泌,是免疫细胞的功能标志和激活标志[20]。 由图2 可知,与对照组相比,LPS 显著增强巨噬细胞MPO 活性(P<0.05); 与LPS 组相比,MBPs 显著降低巨噬细胞MPO 活性(P<0.05),并且随MBPs 浓度的升高,效果明显,呈现量效关系。 MBPs 对LPS 诱导的巨噬细胞内MPO 活性的升高具有显著抑制作用。
2.4 MBPs 对LPS 诱导巨噬细胞RAW264.7 乳酸脱氢酶(LDH)活性的影响
乳酸脱氢酶 (LDH)是葡萄糖酵解所必需的酶, 具有将葡萄糖催化脱氢为丙酮酸和丙酮酸还原为乳酸的能力, 参与细胞内能源物质的无氧酵解和有氧氧化。 LDH 活性与巨噬细胞激活程度相关,是巨噬细胞激活的标志之一[21]。 由图3 可知,与对照组相比,LPS 促使巨噬细胞LDH 活性显著升高(P<0.05);与LPS 组相比,MBPs 显著降低巨噬细胞LDH 活性(P<0.05),并且随MBPs 浓度的升高,降低效果逐渐增强,呈现量效关系。MBPs 对LPS 诱导的巨噬细胞内LDH 活性的升高具有显著抑制作用。

表1 MBPs 对LPS 诱导巨噬细胞RAW264.7增殖的影响Table 1 Effect of MBPs on LPS-induced proliferation of macrophage RAW264.7
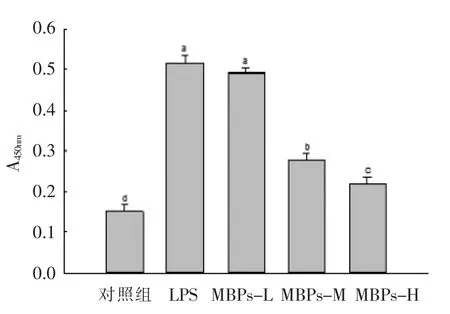
图1 MBPs 对LPS 诱导巨噬细胞RAW264.7吞噬能力的影响Fig.1 Effect of MBPs on LPS-induced phagocytosis of macrophage RAW264.7
2.5 MBPs 对LPS 诱导巨噬细胞RAW264.7 还原型谷胱甘肽(GSH)含量的影响
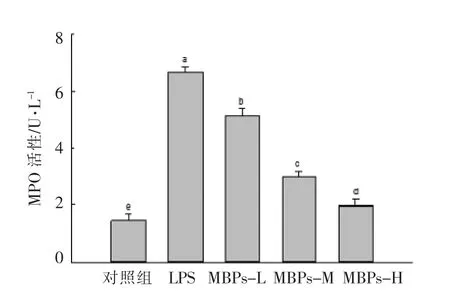
图2 MBPs 对LPS 诱导巨噬细胞RAW264.7 MPO 活性的影响Fig.2 Effect of MBPs on MPO activity produced by LPS-induced macrophage RAW264.7
谷胱甘肽(GSH)是一种含γ-酰胺键和巯基的三肽,由谷氨酸、半胱氨酸及甘氨酸组成,属于一种全身细胞保护性因子,具有抗凋亡、抗炎、促进组织修复、减轻细胞损伤、清除自由基、解毒、促进细胞生长发育及细胞免疫等多种重要生理功能[22]。由图4 可知,与对照组相比,LPS 能显著降低巨噬细胞内GSH 含量;与LPS 组相比,MBPs 可以显著缓解LPS 所导致的巨噬细胞胞内GSH 水平下降(P<0.05),呈现量效关系,且MBPs 中、高剂量组差异无统计学意义(P<0.05)。MBPs 对LPS 诱导的巨噬细胞内GSH 含量的下调具有明显的改善作用。
2.6 MBPs 对LPS 诱导巨噬细胞RAW264.7 分泌细胞因子水平的影响
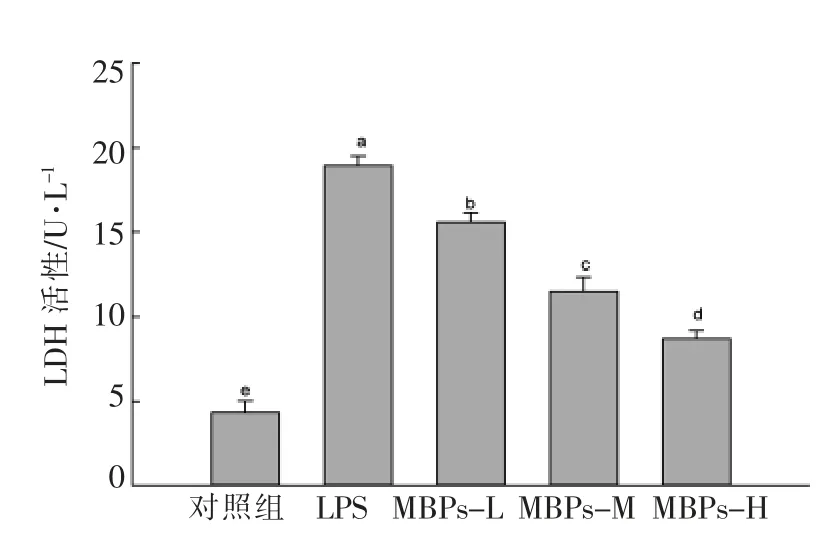
图3 MBPs 对LPS 诱导巨噬细胞RAW264.7 LDH 活性的影响Fig.3 Effect of MBPs on LDH activity produced by LPS-induced macrophage RAW264.7
2.6.1 MBPs 对LPS 诱导巨噬细胞RAW264.7 肿瘤坏死因子(TNF-α)含量的影响 TNF-α 是炎症初期最早出现的炎症因子,主要由巨噬细胞分泌,能促进炎症的发生与发展。由图5 可知,与对照组相比,LPS 显著增加TNF-α 的分泌水平(P<0.05);与LPS 组相比,MBPs 组显著抑制TNF-α 的分泌水平(P<0.05),并随MBPs 浓度的升高,抑制作用逐渐增强, 呈现量效关系。 MBPs 可以显著抑制LPS 诱导巨噬细胞分泌TNF-α。
2.6.2 对LPS 诱导巨噬细胞RAW264.7 分泌IL-1α 水平的影响 IL-1α 又称淋巴细胞活化因子,可作用于机体的各个系统, 具有广泛的生物学作用,在介导炎症反应,参与免疫调节和影响组织代谢方面发挥着积极的作用。由图6 可知,与对照组相比,LPS 显著增加IL-1α 的分泌水平(P<0.05);与LPS 组相比,MBPs 组显著抑制IL-1α 的分泌水平(P<0.05),并随MBPs 浓度的升高,抑制作用逐渐增强,呈现量效关系。 MBPs 可以显著下调LPS所诱导巨噬细胞分泌的IL-1α 水平。
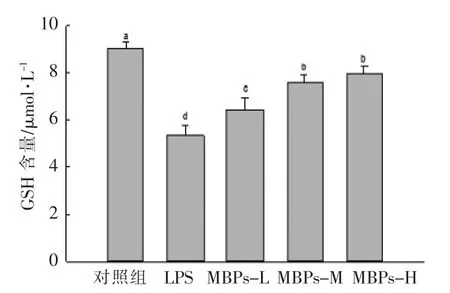
图4 MBPs 对LPS 诱导巨噬细胞RAW264.7 GSH 含量的影响Fig.4 Effect of MBPs on GSH content produced by LPS-induced macrophage RAW264.7
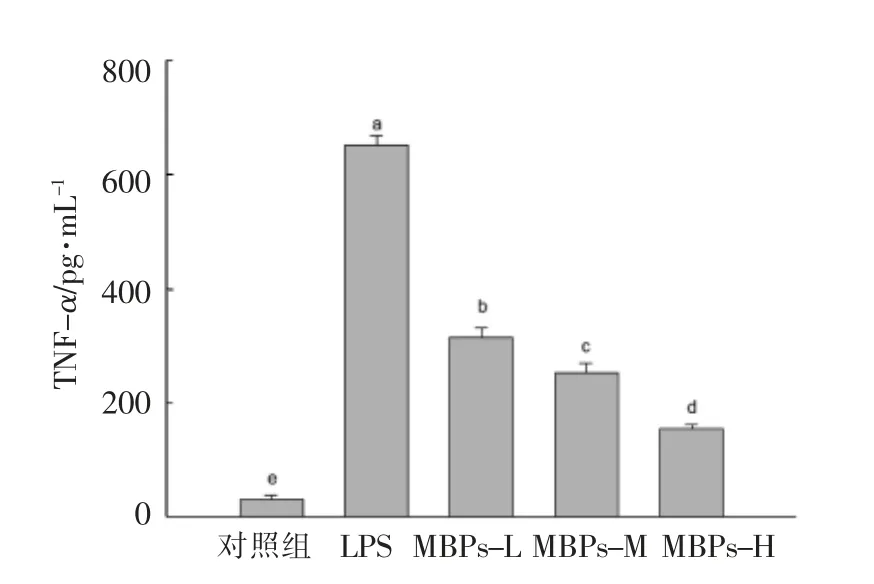
图5 MBPs 对LPS 诱导巨噬细胞RAW264.7分泌TNF-α 水平影响Fig.5 Effect of MBPs on TNF-α level produced by LPS-induced macrophage RAW264.7
2.6.3 对LPS 诱导巨噬细胞RAW264.7 细胞IL-6 含量的影响 IL-6 又被称为B 细胞刺激因子,具有增强免疫、促进造血、诱导B 细胞和T 细胞增殖分化等作用。 由图7 可知, 与对照组相比,LPS能显著增强巨噬细胞分泌IL-6(P<0.05);与LPS组相比,MBPs 可以显著抑制LPS 刺激引起的巨噬细胞IL-6 水平升高,且MBPs 浓度越高,抑制越显著,呈现量效关系。 MBPs 可以缓解LPS 对巨噬细胞分泌IL-6 的抑制作用,减轻炎症程度,具有一定的抗炎效果。
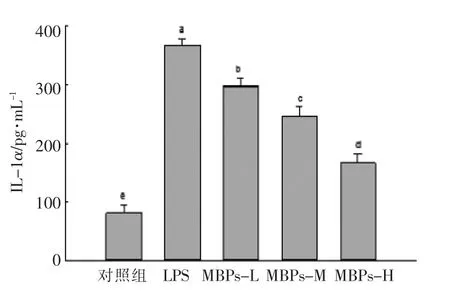
图6 MBPs 对LPS 诱导巨噬细胞RAW264.7分泌IL-1α 水平的影响Fig.6 Effect of MBPs on IL-1α level produced by LPS-induced macrophage RAW264.7
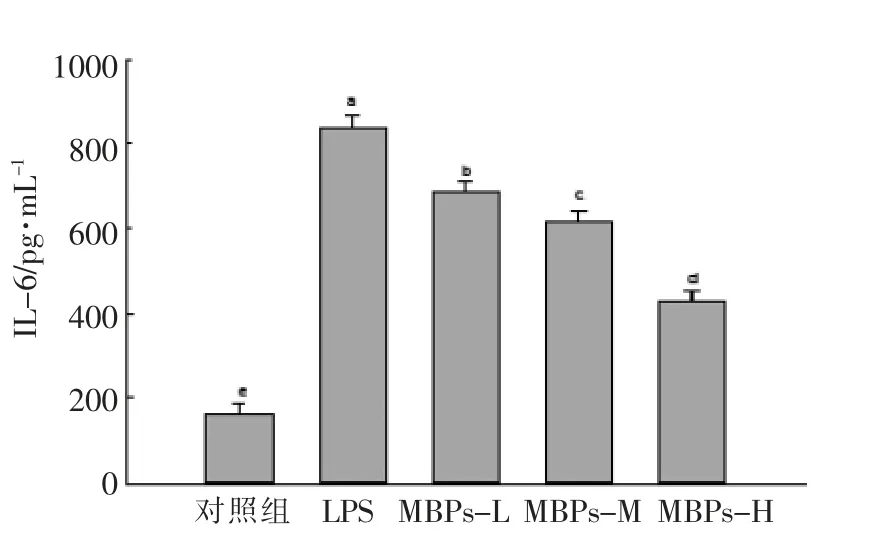
图7 MBPs 对LPS 诱导巨噬细胞RAW264.7分泌IL-6 水平的影响Fig.7 Effect of MBPs on IL-6 level produced by LPS-induced macrophage RAW264.7
3 讨论
巨噬细胞在炎症反应中具有关键作用, 通过促进机体免疫系统释放炎症介质参与炎症反应[23]。 LPS 作为一种细胞毒素,对巨噬细胞具有一定的激活作用, 刺激巨噬细胞产生NO 和释放细胞免疫因子等生物活性物质, 适量的免疫因子具有提高机体抵抗外界刺激和修复机体损伤的作用, 而过量持续的刺激产生的免疫活性物质则会引起细胞的炎症反应,导致细胞的损伤和凋亡[24]。结果表明,2 μg/mL LPS 可显著抑制巨噬细胞增殖,同时能增强其吞噬能力,这与刘想等[25]、徐智敏[26]、李芬芬[27]的研究结果一致;而绿豆寡肽显著增强巨噬细胞增殖, 并降低其吞噬能力, 缓解了LPS 对巨噬细胞的过度刺激,这表明MBPs 通过改善巨噬细胞趋化捕捉及其吞噬能力发挥抗炎作用。
MPO 和LDH 是巨噬细胞发挥生物学作用的两种重要酶。 MPO 在外界刺激下随着炎性细胞聚集而释放,主要功能是在吞噬细胞内杀灭微生物,利用过氧化氢和氯离子产生次氯酸盐, 并形成具有氧化能力的自由基,构成MPO-H2O2-卤素系统,进而在机体天然免疫应答中发挥重要作用[28-29]。当细胞受到外界刺激时, 细胞膜的通透性改变,LDH 从巨噬细胞胞内释放至胞外并激活其它免疫细胞,起到相应的生物学作用[20]。 过量的LPS 可显著提高巨噬细胞内的LDH 和MPO 活性,MBPs 可以显著降低LPS 对巨噬细胞内LDH 和MPO 的活性升高作用, 缓解LPS 对巨噬细胞的胞内消化酶的过度刺激, 这表明MBPs 可以通过改善巨噬细胞酶解消化能力发挥抗炎作用。
还原型谷胱甘肽(GSH)是谷胱甘肽的主要活性成分。 研究表明,GSH 具有促进组织修复、减轻细胞损伤、抗炎、清除自由基、促进细胞生长发育及细胞免疫等多种重要生理功能[30]。 过量的LPS可显著降低巨噬细胞内GSH 水平,MBPs 可以显著缓解LPS 导致的巨噬细胞胞内GSH 水平的下降,这表明绿豆肽通过上调巨噬细胞内GSH 的水平发挥抗炎作用。
细胞因子是由免疫细胞和非免疫细胞在受到刺激后所产生的小分子生物活性物质, 通过刺激或抑制多种细胞的活性、增殖和分化,调节其它细胞因子或抗体的分泌, 诱导靶细胞程序性死亡等途径实现调节免疫应答及参与炎症反应[31-32]。巨噬细胞经LPS 诱导刺激, 分泌TNF-α、IL-1α、IL-6等炎性细胞因子。 TNF-α 是炎症反应过程中最重要的炎症介质。 IL-1α 是IL-1 在机体中存在形式之一, 在参与机体各种急慢性炎症的过程中,IL-1α 刺激细胞的表面呈炎性表型,大量的基因(细胞因子、细胞因子受体、生长因子等)开始表达,大部分基因表达的蛋白质直接参与炎症与免疫反应[33]。IL-6 由淋巴细胞和某些非淋巴细胞(如成纤维细胞、内皮细胞等)产生,是一种参与机体应激反应和免疫调节的重要细胞因子。 IL-6 具有多种生物学活性,除了具有免疫增强和促进造血外,还可参与炎症反应, 主要体现在诱导B 细胞和T 细胞的增殖分化,诱导肝细胞产生急性期蛋白,刺激巨噬细胞增殖分化。 IL-6 水平可以作为反映机体炎症与组织损伤严重程度的重要指标[34-35]。过度的LPS 刺激可使巨噬细胞内的促炎性细胞因子显著升高,这和舒旷怡[36]、张海[37]、喻鹏久[38]的研究结果一致。MBPs 可显著缓解LPS 所诱导巨噬细胞的促炎性细胞因子IL-1α 和IL-6 过度分泌,表明其通过调节巨噬细胞促炎性细胞因子的水平发挥抗炎作用。
综上所述,绿豆寡肽具有抗炎的效果,通过调控巨噬细胞增殖、吞噬、胞内酶解消化及抑制促炎性细胞因子分泌发挥其抗炎作用。 这与利用色谱分析法结合超滤手段从大豆、牛乳、禽蛋中制备小分子抗炎肽(3~10 ku),研究其抗炎活性结果一致[39-41]。 目前研究发现,食源性生物活性肽的抗炎作用、免疫调节能力与其氨基酸的组成、序列、长度、电荷、疏水性及肽分子的结构密切相关[42-43]。大量研究已证实谷氨酰胺、谷氨酸、酪氨酸、色氨酸以及疏水性氨基酸能促进食源性生物活性肽的免疫调节活性。 本课题组前期研究发现绿豆寡肽的氨基酸组成中富含疏水性氨基酸,如甘氨酸(Gly)、缬氨酸(Val)、亮氨酸(Leu)、脯氨酸(Pro)、苯丙氨酸(Phe),且总量高达28.37%,推测绿豆寡肽具有抗炎活性与其特殊的氨基酸组成及低分子质量有关,然而,关于绿豆寡肽如何发挥其抗炎的作用机制及其构效关系尚不清楚,有待于进一步的研究。

