鸡蛋中卵黄高磷蛋白对RAW264.7细胞生长及分化的影响
介怡琳 李晓云 纪胜男 赵前程 马美湖 黄 茜
(华中农业大学食品科技学院 蛋品加工技术国家地方联合工程中心农业农村部蛋品加工重点实验室 武汉430070)
众所周知,鸡蛋营养十分丰富,鸡蛋中的蛋白质更是种类繁多,功能各异,在鸡胚胎发育中以及为人类提供营养方面都扮演着不同的角色。 依据鸡蛋蛋白质特殊的功能可以开发不同的功能食品。 鸡蛋蛋黄中存有一种高磷酸化蛋白质——卵黄高磷蛋白(PV),它是蛋黄中的主要磷蛋白,占蛋黄干物质量的2%, 含磷9.7%, 占蛋黄总磷量的80%[1]。 由于卵生动物的胚胎骨骼在矿化形成过程中所需的磷主要来自卵中含磷物质, 因此不难推断: 组成鸡胚骨骼的重要矿物羟基磷灰石中的磷大部分由PV 提供,PV 在卵生动物的骨矿化中起着重要作用。
生物矿化是指在生物体一些部位的特定环境中,通过细胞和有机基质等的共同参与,环境中无机元素选择性地在特定有机基质上形核、生长、相变,最终转变为微观高度有序,宏观形态功能各异的矿物的过程[2]。骨骼是脊椎动物体内最常见的生物矿化组织。 骨组织的细胞间质由有机质和无机质构成,无机质主要是钙盐,约占骨质量的2/3,主要为羟基磷灰石结晶,呈细针状,沿胶原纤维的长轴排列。 由此可见,磷是骨组织的重要组成元素。近年来, 人们认识到磷酸化蛋白质(phosphoprotein)在仿生矿化过程中起到很重要的作用[3]。一些学者研究了骨桥蛋白、 牙本质磷蛋白等磷蛋白调节生物矿化的过程, 有望为仿生材料的研究带来突破[4-5]。
卵黄高磷蛋白(Phosvitin,PV)与骨矿化密切相关[6-8]。 大量的体外研究表明PV 具有调控矿化的作用。体外研究是基于将PV 吸附或共价结合到某种基质上的模型开展的。 Linde 等[9]将PV 共价交联在琼脂糖珠上,可以诱导矿化物的形成,而去磷酸化后的PV 诱导效果明显减弱。李春艳[10]研究了PV 对鸡胚胎骨骼发育的影响,结合体内、外实验初探其机制。通过跟踪分析孵化期间PV 磷酸根含量、蛋白质二级结构、鸡胚腔骨ALP 活力、体长增长率等指标的变化,发现PV 通过脱磷酸化提供鸡胚骨骼形成需要的磷。随后,采用细胞实验建立模型初探了PV 促进MC3T3-E1 细胞矿化的可能机制,推测在诱导矿化的过程中PV 替代了VC 的作用, 作为强抗氧化剂/还原剂参与合成胶原,进而促进成骨过程。PV 通过上调I 型胶原蛋白Col-I mRNA 和骨钙蛋白mRNA 的表达, 促使其下游产物ALP 表达水平增加, 进而诱导矿化活动增强。
然而,在骨构建过程中,成骨细胞的骨形成及破骨细胞的骨吸收是维持骨重建过程动态平衡的两个阶段,两个过程存在着功能偶联[11]。 这个过程可以通过几种信号通路进行调节, 即RANK/RANKL/OPG,Smads 和 MAPK 途 径。 RANK/RANKL/OPG 通路是成骨细胞与破骨细胞之间的经典信号通路[12]。 这个信号通路中的主要信号分子包括核因子κB 受体活化因子(RANK),RANK配体(RANKL)和骨保护素OPG。 RANKL,OPG 主要由成骨细胞表达,破骨细胞分泌RANK,OPG 可与RANKL 结合,与RANK 有拮抗关系,即OPG/RANKL 的高比值意味着抑制RANK 与RANKL的结合,进而抑制破骨细胞的分化与成熟[13]。 破骨细胞主导骨吸收[14],骨吸收超过骨形成会使骨重建出现负平衡,将导致骨质疏松等骨骼疾病。多种因素可调控骨吸收[15]。 破骨细胞含有抗酒石酸酸性磷酸酶 (Tartrate resistant acid phosphatase,TRAP)等骨吸收过程的作用物质[16]。RAW264.7 可在巨噬细胞集落刺激因子 (macrophage colonystimulating factor,M-CSF)和RANKL 的刺激下中生长[17],表现出高水平的破骨细胞分化,是研究骨吸收的常用细胞[18-19]。
目前关于PV 对破骨细胞的影响研究较少[20-21]。本试验中探讨不同浓度的PV 对RAW264.7 细胞增殖、周期及凋亡的影响。 另外,用RANKL 和MCSF[22-23]共同诱导RAW264.7 细胞分化为破骨细胞[24-25],探究PV 对破骨细胞形成和TRAP 活性的影响。探明PV 对RAW264.7 细胞生长和分化的影响。
1 材料与方法
1.1 材料与试剂
卵黄高磷蛋白,参照Zhang 等[25]的方法从蛋黄中分离纯化卵黄高磷蛋白,采用HPLC 或SDSPAGE 进行纯度鉴定(95%以上);新鲜鸡蛋(海兰褐),武汉九峰山养鸡场。
RAW264.7,上海中科院细胞库;M-CSF(BR),美国PeproTech 公司;RANKL(BR),美 国PeproTech 公司;DMEM(BR),北京赛默飞世尔生化制品有限公司;胎牛血清(BR),澳洲GIBCO 公司;0.25%胰酶-EDTA (BR), 美国HYCLONE 公司;链霉素-青霉素(BR),美国HYCLONE 公司;BCA 蛋白浓度测定试剂盒(BR),碧云天生物技术有限公司;细胞凋亡检测试剂盒(KGA108),南京凯基生物;细胞周期检测试剂盒(KGA512),南京凯基生物;TRAP kit(BR),Sigma-aldrich;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
二氧化碳培养箱 (HERAcell150I), 德国Thermo Scientific 公司; 荧光倒置显微镜(IX71),日本Olympus 公司; 流式细胞仪(FACSCalibur),美国BD 公司。
1.3 溶液的配制
1)PBS 溶液 NaCl 8 g、Na2HPO4·12H2O 3.49 g、KCl 0.2 g、KH2PO40.2 g, 用超纯水定容1 L,将pH 值调至7.2,用0.22 μm 无菌滤膜过滤,高压灭菌后常温保存。
2)无Ca2+、Mg2+Hanks 溶液 NaCl 8 g、KCl 0.4 g、Na2HPO4·H2O 0.06 g、KH2PO40.06 g、NaHCO30.3 5g、HEPES 4.76 g,用超纯水定容1 L,调pH 值至7.4,用0.22 μm 无菌滤膜过滤,高压灭菌后常温保存。
3)细胞冻存液 按照VDMEM∶V胎牛血清∶VDMSO=6∶3∶1 配制,现配现用。
4)完全培养基 89%的DMEM,10%的胎牛血清,1%的双抗 (100 U/mL 青霉素和100 μg/mL链霉素),用0.22 μm 无菌滤膜过滤,于4 ℃储存。
5)分化培养基 含有50 ng/mL 的M-CSF和50 ng/mL 的RANKL 的完全培养基。
6)细胞裂解液 10 mmol/L Tris-HCl,pH 8.0,添加0.1%的Tritonx-100。
1.4 方法
探究PV 对RAW264.7 细胞生长及分化功能的影响。单因素设计试验:不同浓度的PV。参考国内外关于非胶原蛋白调控矿化的试验和细胞实验的文献[3],[26],根据本实验室的前期研究,蛋白质量浓度选用100 μg/mL[10,26]。本试验以此为依据,设置0,50,100,200 μg/mL 和500 μg/mL 5 个质量浓度组, 测定不同浓度PV 对RAW264.7 细胞增殖、细胞周期、细胞凋亡和细胞分化的影响。
1.4.1 RAW264.7 细胞培养操作程序[27]
1.4.1.1 细胞冻存 培养瓶中细胞融合至80%左右时消化细胞,1 000 r/min 离心3 min,弃上清,加入冻存液吹打分散均匀,调节细胞浓度(细胞计数板计数)为5×106~1×107。 将细胞分装至冻存管中,做好标记。于-20 冻藏30 min,-80 ℃冻藏12 h,随后保存于液氮中。
1.4.1.2 细胞复苏 从液氮罐中快速取出细胞冻存管, 立即置于37 ℃水浴锅中连续晃动快速解冻。冻存液移至离心管中,加入适量培养基,1 000 r/min 离心3 min,倒掉上层液体,用培养基重悬细胞,缓慢吹打50 次,均匀接种至培养瓶。 做好标记,置细胞培养箱中培养,2~3 d 换液,弃培养基,用Hanks 清洗细胞3 次,加入新鲜培养液。
1.4.1.3 细胞传代培养 当培养瓶中的细胞融合到70%~80% 时进行传代。 弃培养液,加入Hanks溶液缓慢清洗细胞3 次。 加入适量胰酶消化液消化细胞。 之后, 加入消化液体积2 倍的完全培养基,轻轻吹打细胞,使细胞分散至均匀状态。 将细胞移至离心管中,1 000 r/min 离心3 min,弃上清,加入适量培养液并吹打均匀,接种到培养瓶中,置细胞培养箱中培养。 注意传代比例为1∶4~1∶6。
1.4.2 CCK-8 法测定细胞增殖 取RAW264.7 细胞培养于DMEM 完全培养基[25], 将细胞置于37℃、5% CO2、湿度90%培养箱中,取对数期细胞做试验。
CCK-8 法检测不同浓度的PV 对RAW264.7细胞增殖活性的影响[28]。 取DMEM 完全培养基培养对数生长期的RAW264.7 细胞,以1×104个/mL的密度接种于96 孔板,每孔100 μL 细胞悬浮液。将96 孔板放入培养箱中2 h, 然后分别取不同质量浓度的PV (0,50,100,200 μg/mL 和500 μg/mL)的完全培养基培养,每个浓度设5 个复孔,空白组不含细胞和PV。 将96 孔板置于细胞培养箱中分别培养24,48 h,更换含有10% CCK-8 的培养基, 于37°C 条件下反应2 h, 置于酶标仪450 nm 处测OD 值。 试验重复3 次,计算细胞增殖活力(%)=[(OD试验组-OD空白组)/(OD对照组- OD空白组)]×100%。
1.4.3 流式细胞仪测定细胞周期 取RAW264.7细胞培养于DMEM 完全培养基,将细胞置37°C、5% CO2、湿度90%培养箱中,取对数期细胞做实验。 采用流式法检测不同质量浓度的PV(0,50,100,200 μg/mL 和500 μg/mL)对RAW264.7 细胞周期的影响。
取DMEM 完全培养基培养对数生长期的RAW264.7 细胞, 以5×104个/孔的密度接种于6孔板中,细胞培养液为2.5 mL/孔。 取不同浓度PV的完全培养基培养,每个浓度设3 个复孔。将6 孔板置于细胞培养箱中分别培养24,48 h。
取对数生长期的细胞,将细胞用培养基制成单细胞悬液, 按每孔5×105将细胞均匀接种到6孔板中, 在37 ℃、5%CO2饱和湿度条件下培养过夜。 用PBS 消化细胞,终止消化后收集细胞,1 000 r/min 离心5 min, 弃上清,PBS 重悬润洗2次。 1 000 r/min 离心5 min, 弃上清,100 μL PBS重悬细胞, 缓慢加入700 μL 预冷的80%乙醇,使乙醇终含量为70%。 4 ℃固定4 h 以上,1 000 r/min 离心5 min, 预冷PBS 润洗2 次。 入100 μL RNase(50 μg/mL),37 ℃水浴30 min,加入400 μL PI(50 μg/mL),4 ℃避光染色30 min,用流式细胞仪检测。
1.4.4 RAW264.7 细胞凋亡率的检测 取RAW264.7 细胞培养于DMEM 完全培养基, 将细胞置于37°C、5% CO2、湿度90%培养箱中,取对数期细胞做实验。 采用流式法检测不同质量浓度的PV (0,50,100,200 μg/mL 和500 μg/mL)对RAW264.7 细胞凋亡的影响。
取DMEM 完全培养基培养对数生长期的RAW264.7 细胞, 以5×104个/孔的密度接种于6孔板中,细胞培养液为2.5 mL/孔。 分别取不同浓度PV 的完全培养基培养,每个浓度设3 个复孔。将6 孔板置于细胞培养箱中分别培养24,48 h。
用PBS 消化细胞,终止消化后收集细胞,1 500 r/min 离心5 min,弃上清。 加PBS 重悬,用PBS 润洗细胞2 次,1 500 r/min 离心5 min。 使用AnnexinV-FITC/PI 细胞凋亡检测试剂盒检测。 步骤 是: ①加 入500 μL结合缓冲液(Binding Buffer),重悬细胞;②5 μL AnnexinV-FITC(膜联蛋白-V-荧光素)混匀后加入5 μL PI,混匀;③室温避光反应5~15 min [空白对照孔不做任何处理;阳性对照1:只加5 μL AnnexinV(膜联蛋白-V)单标;阳性对照2:只加5 μL PI 单标];④流式细胞仪上机检测。
1.4.5 PV 对RAW264.7 细胞向破骨细胞分化的影响 RAW264.7 细胞接近融合后 (此时为破骨细胞形成第0 天),换含最终质量浓度为50 ng/mL的M-CSF 和50 ng/mL RANKL 的培养液培养,2~3 d 换液。 将细胞分组: 对照组(不含M-CSF 和RANKL 诱导剂)、模型组(含M-CSF 和RANKL 诱导剂)、不同质量浓度的PV 组(0,50,100,200 μg/mL 和500 μg/mL),共7 组,培养于24 孔板中。 培养第8 天,取出培养板,收集培养液,进行TRAP染色试验[25],步骤如下:①细胞固定后,洗涤3~5次,每次3~5 min;②取两支试管,各加入0.5 mL快速石榴石型碱溶液 和0.5 mL 亚硝酸盐溶液,轻轻上、下翻转混匀30 s,静置2 min;③用预先配制好的染色液于37 ℃避光孵育1 h, 染色液配制方法:DD H2O 45 mL, 氨偶氮卞1 mL 萘酚 0.5 mL,醋酸2 mL,酒石酸盐1 mL,每加入一种物质后充分混匀,现配现用;④用PBS 清洗至变蓝,于倒置显微镜下观察拍照。
1.4.6 对破骨细胞TRAP 活性的影响 对破骨细胞分化布板及PV 干预。 8 d 后,弃培养液,每孔加入200 μL 细胞裂解液(1%的Triton X-100),吹打细胞,收集上清,按TRAP 试剂盒说明书步骤检测TRAP 的活性[29]。
1.5 统计学分析
所有实验重复至少3 次, 数据以平均值±S.D表示。 采用SPSS17.0 软件进行单因素方差分析(ANOVA), 采用邓肯分析法进行差异性分析,P<0.05 为差异显著。
2 结果与分析
2.1 PV 对RAW264.7 细胞活力的影响
采用CCK-8 法从细胞数量水平上探究0,50,100,200μg/mL 和500 μg/mL PV 对RAW264.7 细胞增殖活性的影响[30-31]。图1A、1B 分别为作用24,48h 后细胞的增殖活力数据。
由图1A 可知,不同浓度的PV 组增殖活力显著高于空白组(P <0.05),其中50,100,200 μg/mL PV 分别高出对照组63%,76%,41%,3 组之间无显著差异(P >0.05)。 500 μg/mL PV 组与对照组没有显著差异。由图1B 可知,50,100,200 μg/mL PV 增殖活力分别高出空白对照组57%,64%,40%,3 组之间无显著差异(P >0.05)。 而500 μg/mL PV 组出现抑制效果,细胞活力低于对照组。
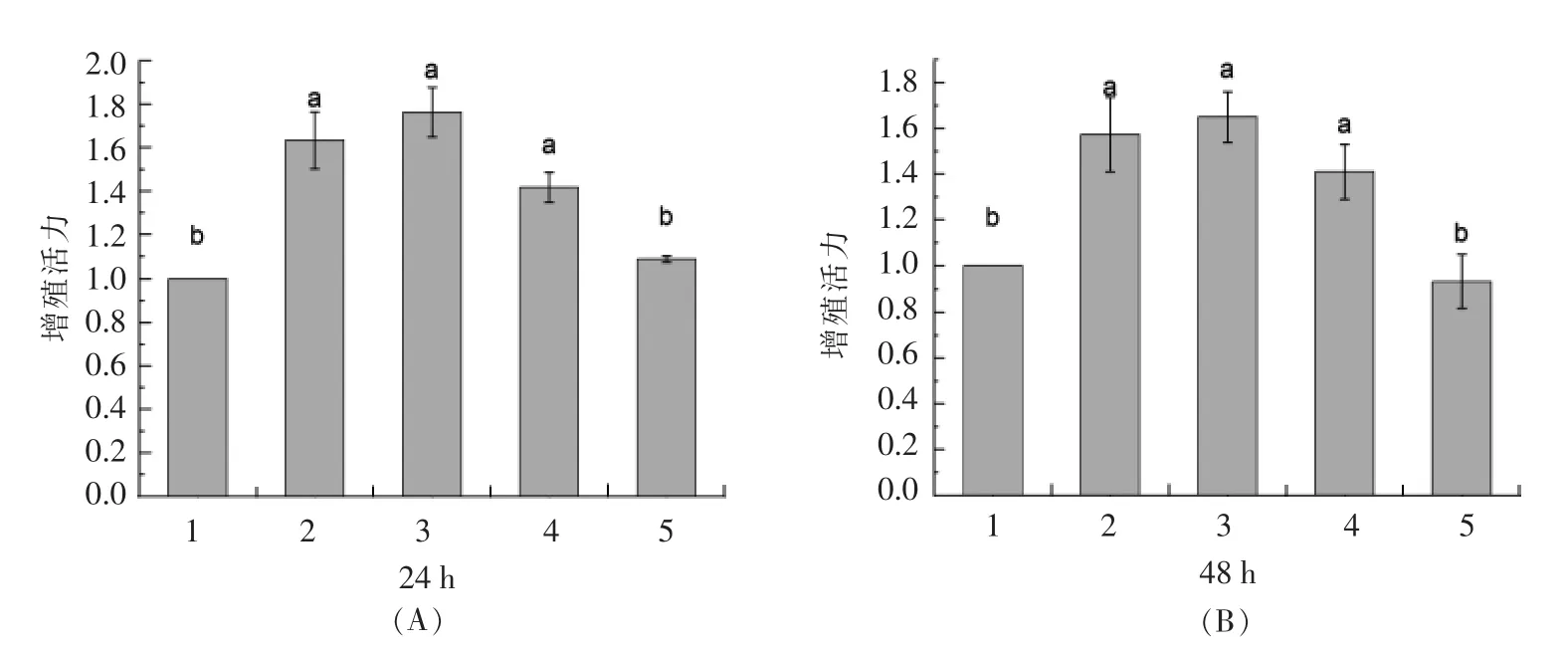
图1 不同浓度PV 处理24h(A),48h(B)对细胞活力的影响Fig.1 Effect of different concentration PV on RAW264.7 viability for 24h(A),48h(B)
2.2 PV 对RAW264.7 细胞周期的影响
用流式细胞仪[32]从细胞周期水平上检测0,50,100,200,500 μg/mL PV 对RAW264.7 细胞的增殖活力影响。
图2,3 分别显示RAW264.7 细胞各时期的分布状态。 表1,2 列出Cotfit 软件分析的各组细胞G1、S 及G2 期细胞数在细胞周期中所占比例。 不同浓度的PV 对细胞增殖均有促进作用,S 期细胞显著高于空白对照组(P<0.05):处理24h 后,100,200 μg/mL PV 效果最好, 分别高出对照组12%,11%;处理48 h 后,50,100,200,500 μg/mL PV 分别高出对照组22%,14%,14%,14%。
图4, 以增殖指数PI 表示RAW264.7 增殖活力。 24 h 组PI 值明显高于48 h 组, 这是由 于RAW264.7 细胞是接触抑制性细胞。处理24 h 后,50,100,200,500 μg/mL PV 分别高出对照组7%,11%,9%,9%; 处理48 h 后,50,100,200,500 μg/mL PV 分别高出对照组22%,13%,13%,13%。
不同浓度的PV 对细胞增殖均有促进作用,与对照组相比低浓度PV 处理细胞后,S 期细胞百分数、增殖指数PI 增加值更多。 细胞周期水平上的增殖结果与CCK-8 结果趋向一致,说明低浓度PV 促进细胞增殖效果更好。
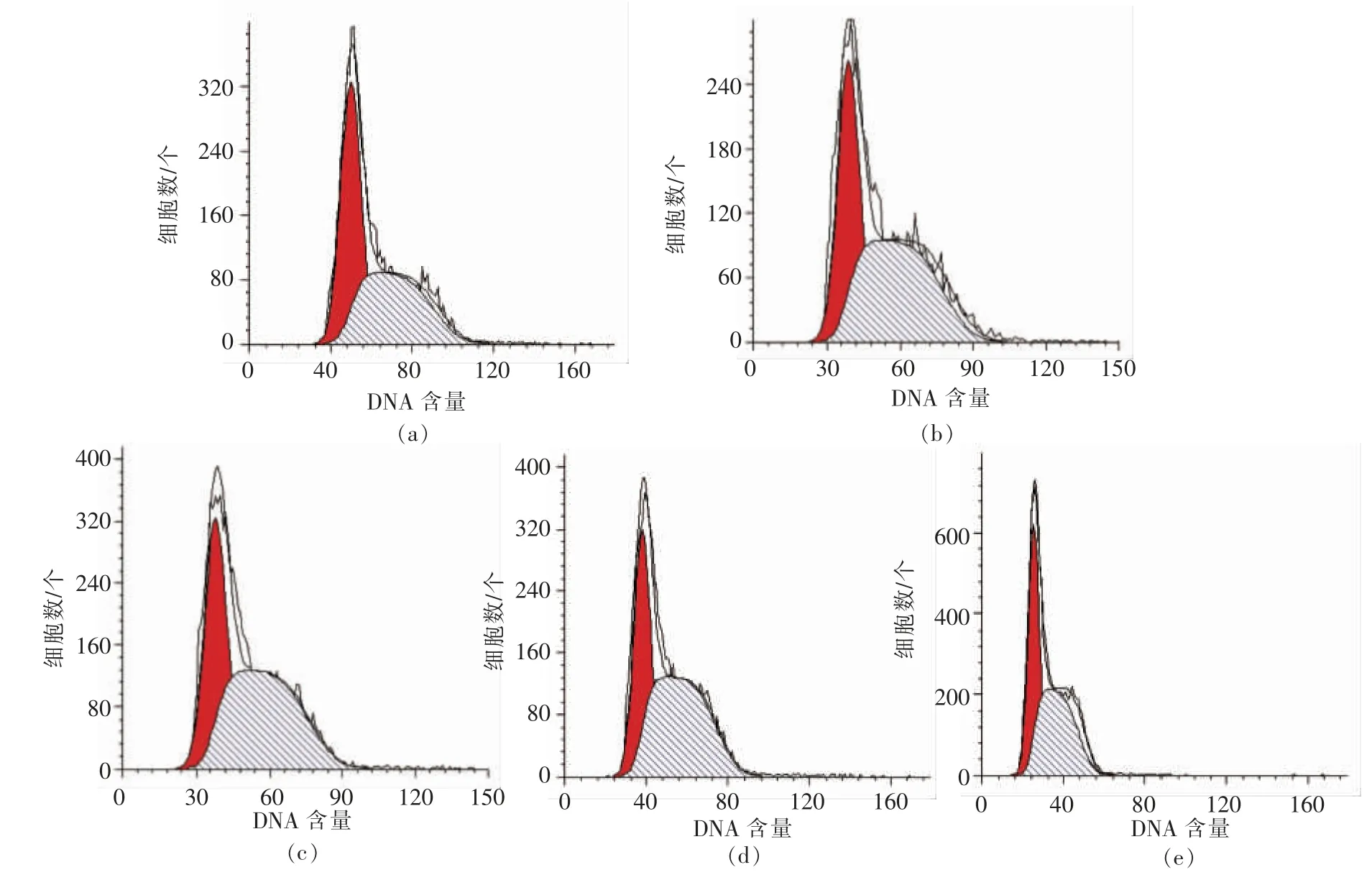
图2 不同浓度PV 处理24 h 流式细胞仪分析结果Fig.2 Result of flow cytometry analysis for 24 h
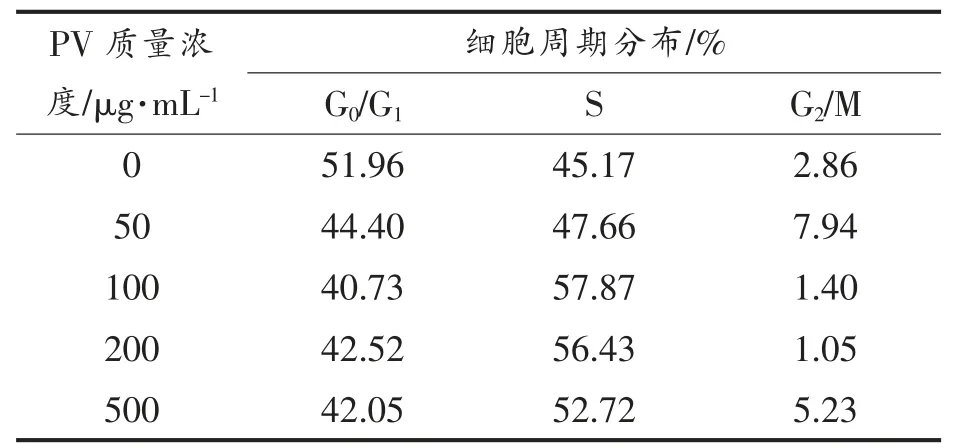
表1 处理24 h 不同时期细胞百分含量Table 1 The percentage of cells in different periods for 24 h
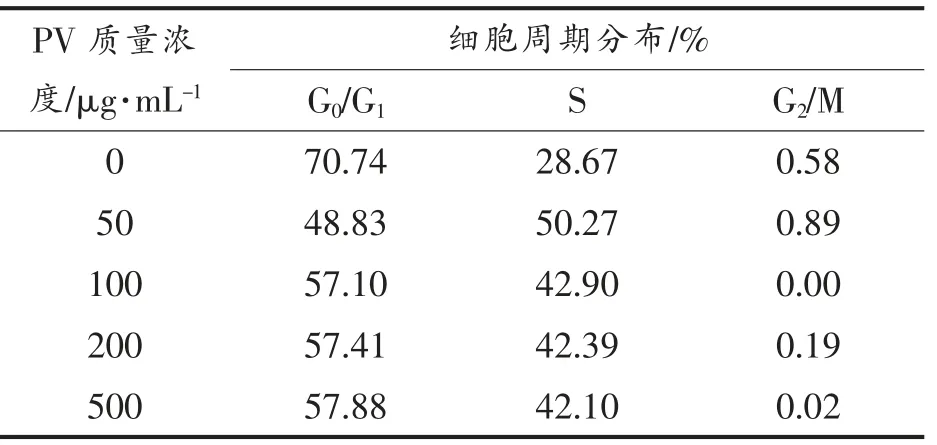
表2 处理48 h 不同时期细胞百分含量Table 2 The percentage of cells in different periods for 48 h
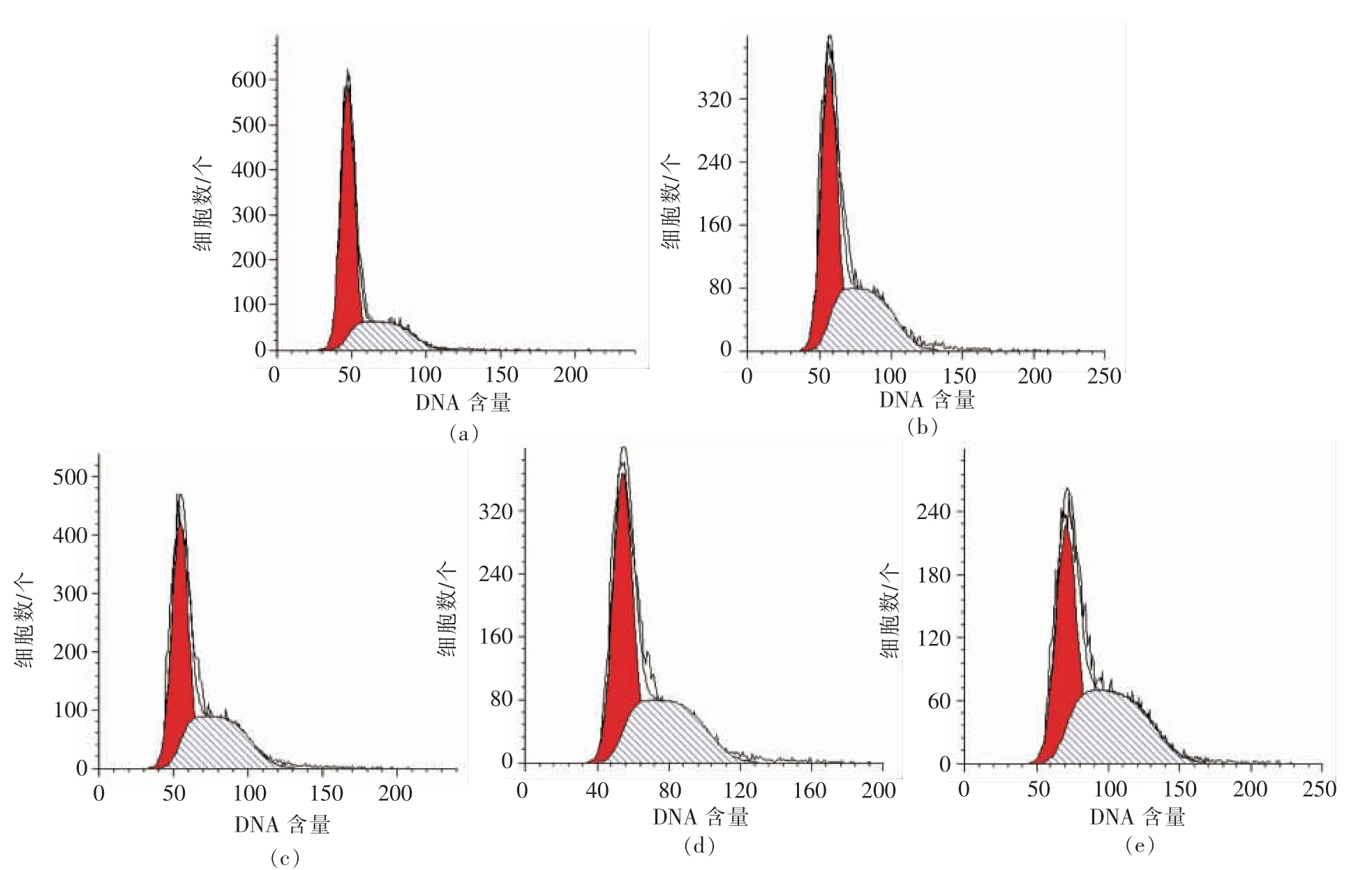
图3 不同浓度PV 处理48 h 流式细胞仪分析结果Fig.3 Result of flow cytometry analysis for 48 h
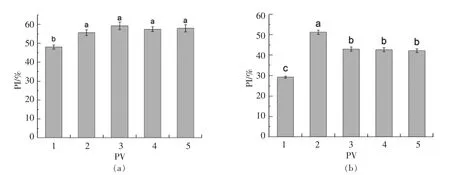
图4 PV 处理24h(a),48h(b)对细胞周期的影响(细胞增殖指数)Fig.4 Effect of PV on RAW264.7 cell cycle for 24h(a),48h(b)RAW264.7 (cell proliferation index)
2.3 PV 对RAW264.7 细胞凋亡的影响
通过流式细胞仪[33]检测0,50,100,200 μg/mL和500 μg/mL PV 对RAW264.7 细胞凋亡的影响。图5、6 分别为作用24 h 和48 h 后的结果。图中左下代表正常细胞,右下代表凋亡早期的细胞,右上代表凋亡晚期的细胞,左上代表坏死的细胞[34]。
表3,4 显示用流式细胞仪FCS Express 分析软件处理后,得到的不同浓度PV 作用RAW264.7细胞的早期细胞凋亡率、 晚期细胞凋亡率及总凋亡率。 处理24 h 后,总、早期、晚期凋亡率分别低于对照组15%,10%,4%;处理48 h 后,总、早期、晚期凋亡率分别低于对照组9%,2%,7%; 而500 μg/mL PV 组凋亡率高于空白对照组。
2.4 PV 对RAW264.7 细胞分化为破骨细胞的影响
通过TRAP 染色[35-36]观测到RAW264.7 细胞分化为破骨细胞的形态(图7)。 如图7b 所示,质量浓度均为50 ng/mL 的RANKL 和M-CSF 成功促进了破骨细胞的形成(TRAP 染色阳性,细胞体积增大,细胞核多于3 个,胞质出现棕褐色颗粒[37])。 与图7b 模型组相比,不同浓度的PV 均显著减少破骨细胞的数量,且与浓度呈正相关。200 μg/mL PV 的抑制效果最好。
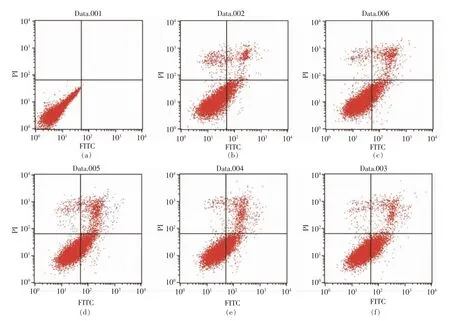
图5 PV 处理24h 对细胞凋亡的影响Fig.5 Effect of PV on RAW264.7 cell apoptosis for 24 h
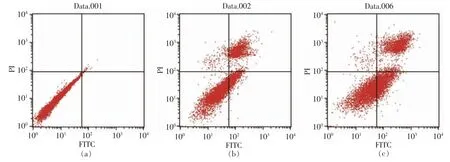
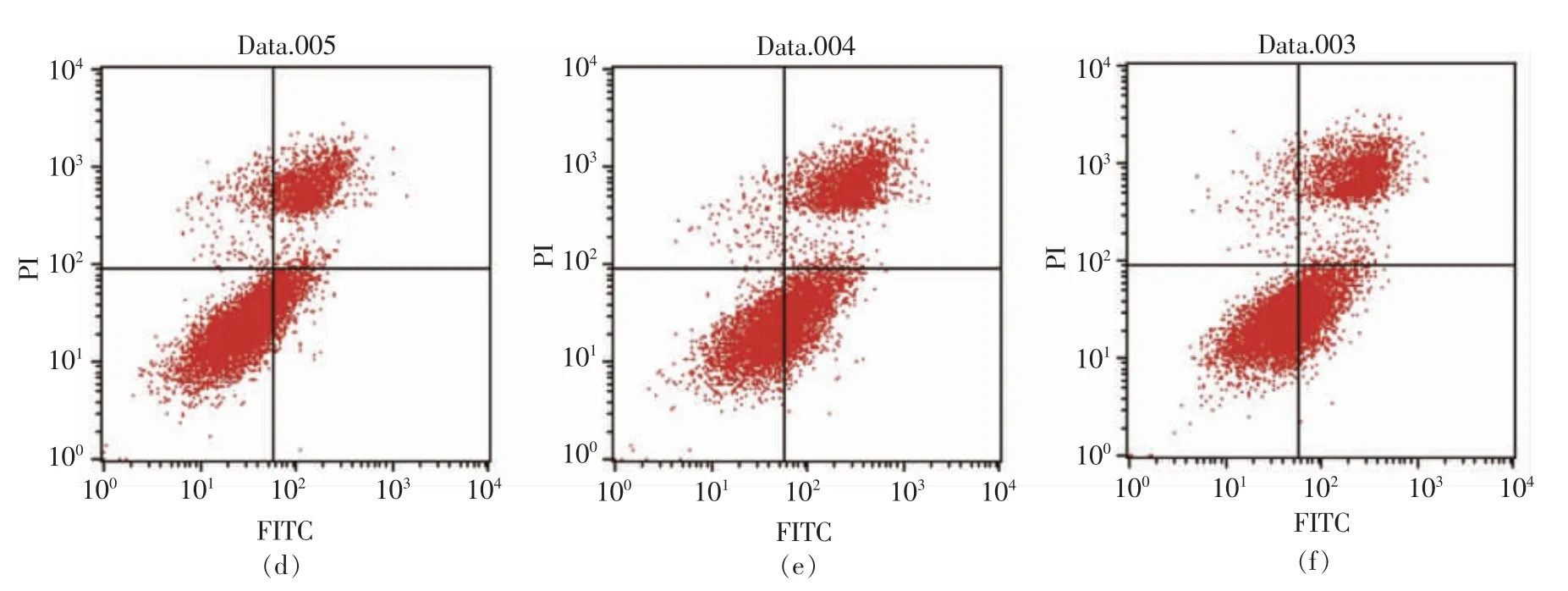
图6 PV 处理48h 对细胞凋亡的影响Fig.6 Effect of PV on RAW264.7 cell apoptosis for 48h
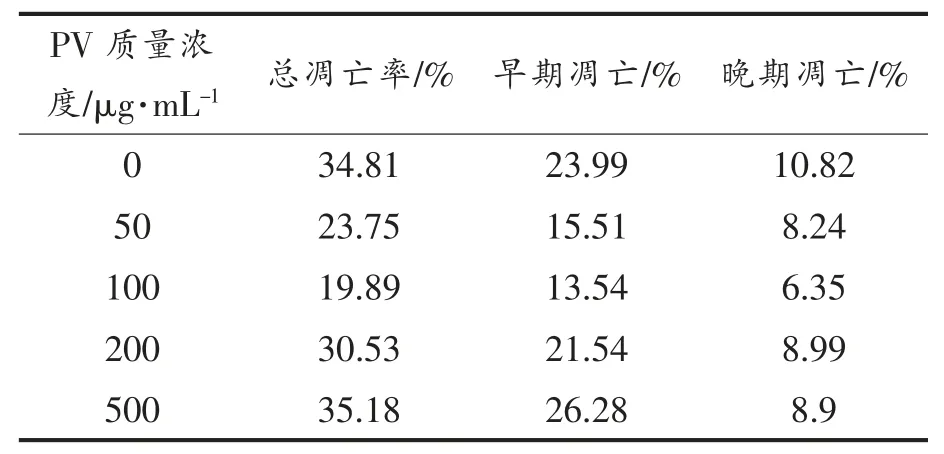
表3 PV 处理24 h 对细胞凋亡的影响Table 3 Effect of PV on RAW264.7 cell apoptosis for 24 h
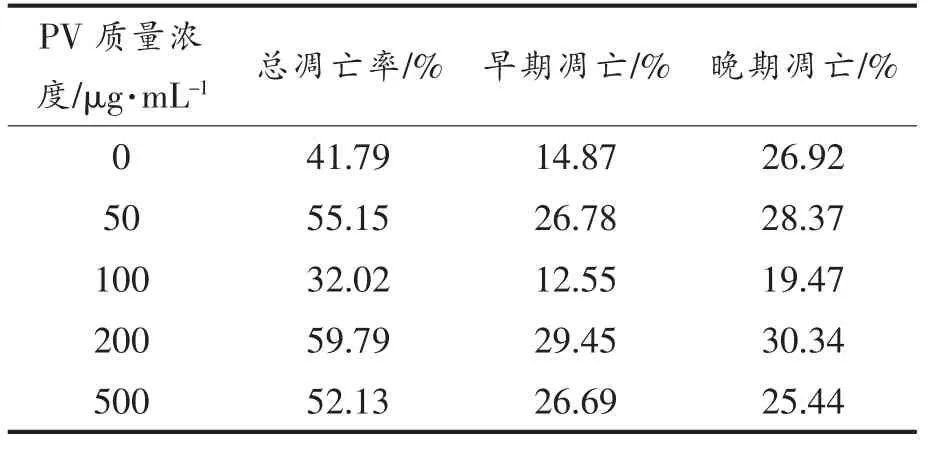
表4 PV 处理48 h 对细胞凋亡的影响Table 4 Effect of PV on RAW264.7 cell apoptosis for 48 h

图7 不同浓度PV 对破骨细胞形成的影响Fig.7 Effect of PV on RAW264.7 -induced osteoclastogenesis
2.5 PV 对TRAP 活性的影响
TRAP 活性测定结果见图8。 分化培养基模型组(2 组)的TRAP 活性显著高于普通培养基对照组 (1 组)(P<0.05)。 不同浓度 (50,100,200 μg/mL )的PV 组与模型组相比,均可显著降低TRAP的活性(P <0.05),且呈浓度依赖性。 50,100,200 μg/mL PV 分别低于模型组24%,41%,65%,其中,200 μg/mL PV 抑制作用最强(P<0.05)。PV 通过显著地降低TRAP 的活性, 抑制RAW264.7 细胞分化为破骨细胞。
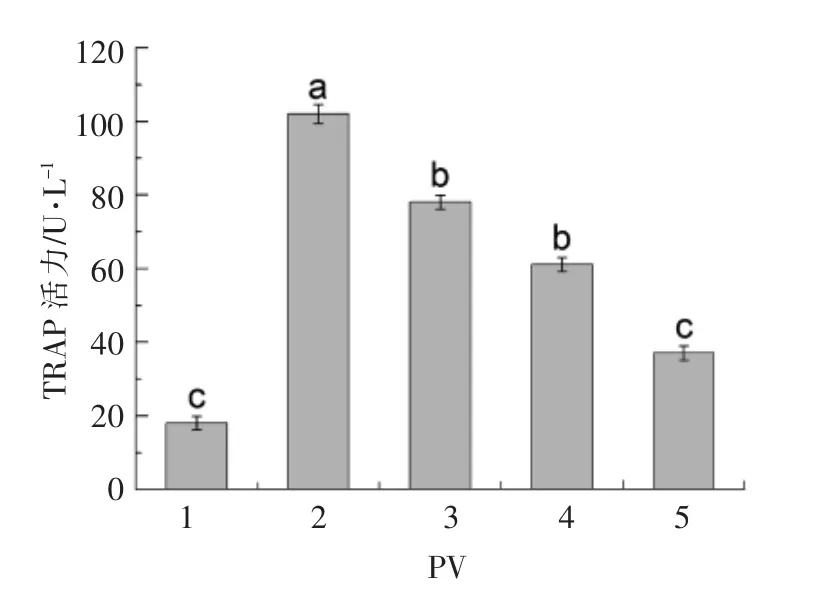
图8 不同浓度PV 对TRAP 活性的影响Fig.8 Effect of PV on the TRAP activity
3 讨论
本试验结果表明:PV 不是通过抑制RAW264.7细胞生长,而是通过显著地降低TRAP 的活性,进而抑制RAW264.7 细胞分化成为破骨细胞。另外,有研究显示, 鸡蛋卵黄蛋白可显著抑制骨造血细胞向破骨细胞分化, 并且能够抑制破骨细胞的形成和生长以及TRAP 活性, 进而抑制其骨吸收活性[38-40],而酪蛋白对照组没有此作用[41]。
与PV 类似的非胶原蛋白质骨桥蛋白(Osteopontin,OPN)和骨唾液蛋白 (Bone Sialoprotein,BSP)也具有抑制破骨细胞分化的功能[42]。 另外,在骨吸收过程中,OPN 可以将破骨细胞锚定到骨上。相关的研究还有很多,可为PV 研究提供借鉴。 例如牛乳铁蛋白(Bovine Lactoferrin, BLF)主要通过OPG/RANL/RANK 信号通路来抑制破骨细胞的生成和骨吸收[43], 且其抑制骨吸收的IC50为200 μg/mL。
RANK/RANKL、NF-κB 和MAPK 信号通路,以及c-fos 和NFATc1 与骨吸收都有密切关系。另外,TRAP、MMP-9、CTR、Cathepsin K,促炎症因子IL-1β、IL-6 和TNF-α 都可以作为骨吸收的评价指标,对于研究PV 的信号通路具有重要意义。 调控机制明确后,可开发利用PV 作为骨骼健康的功效成分。
4 结论
研究了从鸡蛋中提取的卵黄高磷蛋白对RAW264.7 细胞增殖、周期、凋亡的影响,发现不同浓度的PV 对细胞增殖均有促进作用。 与对照组相比,用低质量浓度PV(50、100、200 μg/mL)处理细胞后,S 期细胞百分数、 增殖指数PI 增加值多。凋亡结果表明,50,100,200 μg/mL PV 组凋亡率都显著低于空白对照组,500 μg/mL 组凋亡率高于空白组。 此外, 在TRAP 染色细胞分化形态学及TRAP 活性方面,不同浓度的PV 均可显著减少破骨细胞数量,降低TRAP 的活性(P<0.05),且呈浓度依赖性,其中200 μg/mL 为最佳抑制质量浓度。总之,PV 通过降低TRAP 的活性, 达到抑制RAW264.7 细胞分化成为破骨细胞。 本研究结果对拓展鸡蛋中卵黄高磷蛋白在促进骨骼发育,抑制破骨细胞分化方面提供了试验依据。

