不同干燥方式对当归性状、显微形态、活性成分含量和抗氧化物酶活性的影响
荔淑楠,王引权,2*,马丽丽,李淑琪,傅金魁,樊 秦,彭 桐
1甘肃中医药大学;2甘肃省中药质量与标准研究重点实验室培育基地,兰州 730000;3北京华珍烘烤系统设备工程有限公司工艺部,北京 100029
当归为临床常用的大宗中药材之一,具有补血活血、调经止痛、润肠通便等功效。用于血虚萎黄、眩晕心悸、月经不调、经闭痛经、虚寒腹痛、肠燥便秘、风湿痹痛、跌扑损伤、痈疽疮疡[1]。甘肃为当归道地产区,种植历史悠久、地区集中。甘肃当归栽培面积约占全国70%,年产量占全国90%[2,3]。新鲜当归含有大量有机酸、多糖、苯酞类化合物及其他次生代谢产物,具有热敏性、挥发性、染菌性、高水分、易质变等特征[4]。干燥是中药材生产过程中最普遍、最关键的加工环节。干燥起到杀菌抑菌、改善外观品质、延长储存期、减少运输质量及便于后续切片加工等作用[5]。目前当归产区普遍采用晒干、阴干和熏干等传统方式[6]。传统干燥方式存在着规模小散、技术装备落后、干燥过程难控、干燥周期较长等问题,常造成药材性味劣变、活性成分(特别是药用有效成分)损失,导致用药安全性和有效性下降。且加工费时耗力,易引起环境污染等问题。因此,研究规模化、集约化、智能化的当归产地干燥加工技术势在必行。近年来,平衡脱水干燥技术已在河南焦作的山药、牛膝,安徽亳州的白芍,甘肃陇西的当归、黄芪、甘草等大宗药材的产地干燥加工中实现了产业化应用。课题组前期在龙脑樟叶片干燥中也做过研究,初步证实平衡脱水干燥技术亦适宜于龙脑樟叶片干燥[7]。平衡脱水干燥的核心技术是在建立不同物料理论干燥曲线的基础上,通过智能化控制系统在线精准调控不同干燥阶段温度、湿度和时间三要素,有的放矢地调控脱水速率,使物料内外均衡脱水,进而保障干燥产品的高质化和稳定化。尽管平衡脱水技术已在甘肃当归产地加工中规模化应用,但目前就其对当归药材外观性状、显微形态、活性成分含量及抗氧化酶活性等的影响仍缺乏系统研究。本研究将通过比较平衡脱水、晒干、阴干及熏干等4种干燥方式对当归药材外观和内在品质的综合影响,探究干燥过程中的抗氧化生理机制,以期为当归道地产区产地干燥加工新技术的引进与推广,体现当归药材的“优形、优质”,最终实现药用的“优效”而提供科学依据。
1 实验材料
供试新鲜当归产自道地产区的甘肃岷县,品种为“岷归1号”。待干燥处理的新鲜当归为大小相近、无腐烂、无机械损伤、无病虫害的全根,初始含水量为72.87%。
对照品为:阿魏酸(批号H27J7L16718)、洋川芎内酯I(批号P02F9F54166)、洋川芎内酯H(批号P02F9F54165)、洋川芎内酯A(批号P23A9F68613)、正丁基苯酞(批号S09J9D65229)、藁本内酯(批号Y17S9L70462)、欧当归内酯A(批号P24A9S68617)、阿魏酸松柏酯(批号Z24D9B78131)均来源于上海源叶生物科技有限公司,纯度≥98%;葡萄糖(SG8510,北京索莱宝科技有限公司);Sigma-alorich甲醇(批号WXBB6450V,HPLC≥99.9%);Sigma-alorich乙腈(批号WXBB6406V,HPLC≥99.9%);冰乙酸(批号20180801,分析纯,天津大茂化学试剂公司);苯酚(批号20160729,国药集团化学试剂有限公司);水合氯醛(中国医药集团上海化学工业公司)。总蛋白(TP)测定试剂盒(带标准:考马斯亮蓝法)、总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、过氧化氢酶(CAT)测定试剂盒(可见光法)、还原型谷胱甘肽(GSH)测定试剂盒(分光光度法)、过氧化物酶(POD)测定试剂盒(测植物)(比色法)均来自南京建成生物工程研究所。
试验用设备:智能平衡脱水烘房(SY-4,北京华珍烘烤系统设备工程有限公司);系统显微镜(BX51-31X01,日本奥林巴斯TM);高效液相色谱仪(Agilent1100,美国);电子分析天平(BT125D,赛多利斯科学仪器北京有限公司);超纯水系统(Smart-N15VF,力康生物医疗科技控股有限公司);数控超声波清洗器(KH-500DE,昆山禾创超声仪器有限公司);Benchmark Plus酶标仪(美国BIO-RAD);SCIENTZ-48高通量组织研磨器(Scientz-48,宁波新芝生物科技股份有限公司)。
2 实验方法
2.1 干燥处理
试验设4种干燥方式,即平衡脱水干燥、熏干、晒干和阴干。重复3次。平衡脱水干燥在北京华珍烘烤系统设备工程有限公司工艺部按照预试验优化的工艺流程进行。熏干、晒干和阴干均在甘肃岷县当地按照道地产区按传统干燥工艺干燥。当归不同干燥处理方式的流程与参数见表1。

表1 当归干燥处理方式及参数
2.2 评价方法
2.2.1 性状鉴别
按照中药鉴定学常规鉴定方法,从形状、大小、颜色、表面特征、断面、质地、气味等方面进行评价。
2.2.2 显微鉴别
采用徒手切片法。将大小均匀的当归归身横切成薄片,滴加番红染液封片,置显微镜下观察并拍照。在20倍镜下随机选取15个油室,用显微镜自带标尺测量其直径。采用常规粉末制片法,用 Olympus BX51-31X01 型系统显微镜观察具体特征。
2.2.3 活性物质含量测定
2.2.3.1 浸出物、挥发油提取率及多糖含量测定
浸出物和挥发油含量按2015年版《中国药典》方法测定。多糖含量采用苯酚硫酸法[6,8]。重复3次,取平均值作为结果。
2.2.3.2 薄层色谱分析
参照2015版《中国药典》第一部测定[1]。
2.2.3.3 阿魏酸和7种苯酞类成分测定
采用高效液相色谱法[9,10]:以Merk RP-C18柱(4.6 mm×250 mm,5 μm)对其进行分离,流动相为1%乙酸(A):乙腈(B),梯度洗脱:18 min,19.0% B;60 min,100% B;75 min,100% B;检测波长280 nm;流速1.0 mL/min;柱温30 ℃;进样量20 μL。
2.2.3.4 混合对照品溶液的制备
取对照品阿魏酸1.54 mg,藁本内酯5.56 mg,洋川芎内酯A 3.20 mg,洋川芎内酯I 0.58 mg,洋川芎内酯H 0.20 mg,欧当归内酯A 1.10 mg,正丁基苯酞5.05 mg,阿魏酸松柏酯0.27 mg,精密称定,分别置于5 mL容量瓶中,加甲醇溶解并定容至5 mL,得对照品贮备液分别精密各贮备液0.5 mL至5 mL容量瓶中,用甲醇定容至5 mL,得混合对照品溶液,然后精密吸取上述制得的混合对照品溶液各1.4、1.0、0.6、0.2、0.1 mL,分别用甲醇定容至2 mL容量瓶中,得质量浓度不同的混合对照品溶液,以上对照品均置于4 ℃冰箱保存,备用。
2.2.3.5 供试品溶液的制备
取当归粉末3份(过3号筛),每份约0.5 g,精密称定,置于150 mL磨口具塞锥形瓶中,加入70%甲醇溶液20 mL后称重,用保鲜膜盖严,在220 W,80 Hz条件下超声40 min,再称重,用70%甲醇补足失重,摇匀,用0.22 μm微孔滤膜过率,取续滤液,即得。对照品及供试品溶液的色谱图见图1。
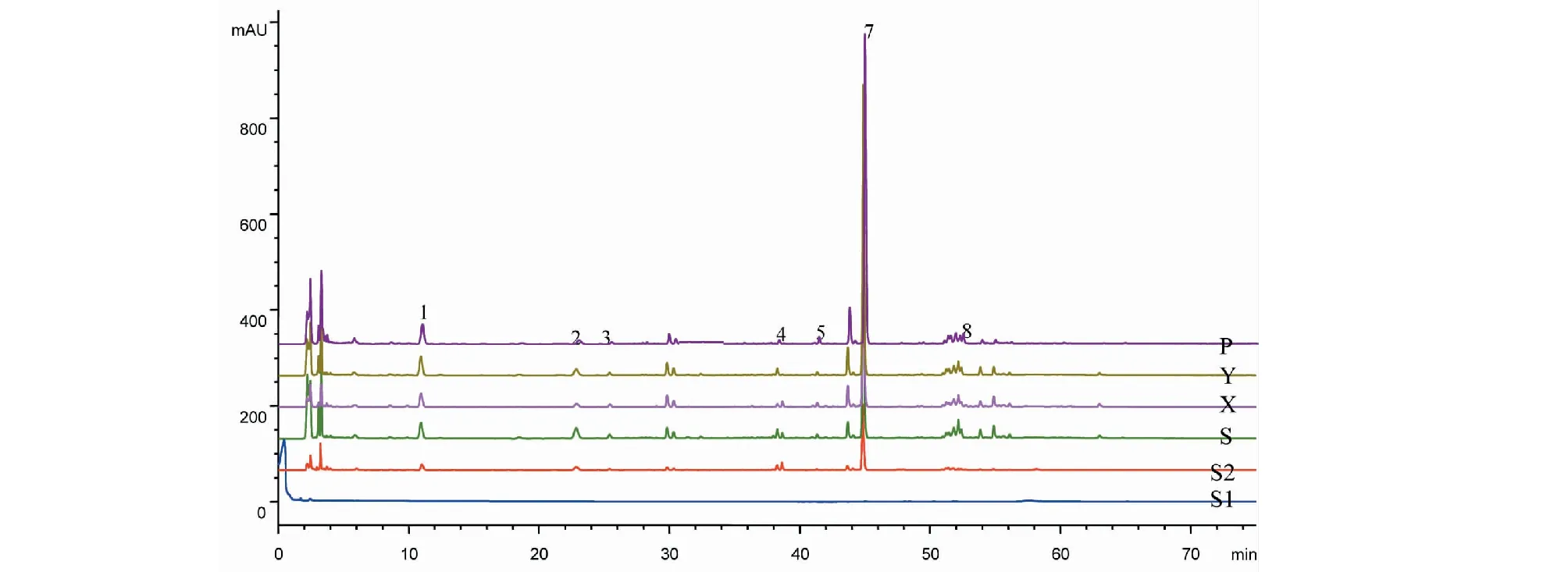
图1 4不同干燥方式当归的HPLC图Fig.1 HPLC chromatogram of CA by different drying methods注:S1.空白试剂;S2.混合对照品;S.晒干;X.熏干;Y.阴干;P.平衡脱水干燥;1.阿魏酸;2.洋川芎内酯I;3.洋川芎内酯H;4.阿魏酸松柏酯;5.洋川芎内酯A;6.正丁基苯酞;7.藁本内酯;8.欧当归内酯A。Note:S1.Blankreagent;S2.Mixed reference substance;S.Sun-dried CA;X.Fumed CA;Y.Shade-drying CA;P.Drying process on Balance dehydration of CA;1.Ferulic acid;2.Senkyunolide I;3.Senkyunolide H;4.Coniferyl ferulate;5.Senkyunolide A;6.n-Butyl phthalide;7.(Z)-Ligustilide;8.Levistolide A.
2.2.3.6 线性关系考察
按“2.2.3.3”项下色谱条件进行测定,每个浓度进样3次,取平均值。以进样量(X)为横坐标,平均色谱峰面积(Y)为纵坐标,分别绘制标准曲线,得回归方程。阿魏酸:Y=14.082X-32.553(r=0.999 9),在0.003 1~0.308 0 mg/mL范围内线性关系良好;洋川芎内酯I:Y=70 075X-53.795(r=0.999 6),在0.001 2~0.011 6 mg/mL范围内线性关系良好;洋川芎内酯H:Y=89 289X-14.828(r=0.999 8),在0.000 4~0.004 0 mg/mL范围内线性关系良好;阿魏酸松柏酯:Y=33 984X+1.656 2(r=0.999 9),在0.000 5~0.054 0 mg/mL范围内线性关系良好;洋川芎内酯A:Y=8 270.8X+6.568 8(r=0.999 7),在0.003 2~0.064 0 mg/mL范围内线性关系良好;正丁基苯酞:Y=8 833X-2.747 4(r=0.999 8),在0.005 05~0.101 0 mg/mL范围内线性关系良好;藁本内酯:Y=23 451X+16.729(r=0.999 6),在0.003 9~1.112 0 mg/mL范围内线性关系良好;欧当归内酯A:Y=56 521X-6.774 5(r=0.999 8),在0.001 1~0.022 0 mg/mL范围内线性关系良好。
2.2.4 抗氧化活性测定
取当归粉末(过3号筛)3份,每份约0.2 g,精密称定,置于研钵中,加3.0 mL 0.05 mol/L pH7.8磷酸钠缓冲液,加入少量石英砂,置SCIENTZ-48高通量组织研磨器中快速研磨,过滤,在4 ℃,3500 rpm条件下离心10 min,取上清液于4 ℃冰箱中保存,供抗氧化酶活性测定。可溶性蛋白采用考马斯亮蓝G-250法测定;当归SOD、POD、CAT等酶活性和GSH含量均按南京建成生物工程研究所提供的酶联免疫法(ELISA)法试剂盒方法测定。所有测定均重复3次。
2.3 数据处理
3 结果与分析
3.1 性状鉴别
由图2和表2可以看出,4种干燥方式处理下的当归性状存在明显差异。相同点在于大小相近、质地多脆。不同点在于:P的当归色泽均匀鲜亮、表面皱纹较疏松,而X、S、Y的当归色泽不均匀、表面皱纹致密。X与P的断面棕色点状分泌腔明显,皮部油样光泽不明显,而S与Y与之相反。X和S的香气较浓郁,Y的次之,P的较淡。P有较强的麻舌感。

图2 不同干燥方式当归性状比较Fig.2 Character comparison in CA by different drying methods

表2 不同干燥方式当归药材性状的差异
3.2 显微特征
3.2.1 油室
油室直径大小能间接反映当归挥发油的含量[11]。从图3看出,不同干燥方式下当归油室的平均直径P(119.1 μm)>X(113.3 μm)>S(104.2 μm)>Y(89.7 μm)。P的油室直径比X高5.11%,比S高14.33%,比Y高32.82%,表明P对当归挥发油保存较好。
3.2.2 薄壁细胞内含淀粉粒
由图4看出,P与X下当归的淀粉粒密度较高,且与S和Y的差异明显。淀粉粒为当归薄壁细胞富含的营养物质[12],因此,从淀粉粒含量可以反映出P与X对当归内在品质的保持具有优势。

图4 不同干燥方式当归薄壁细胞内含淀粉粒Fig.4 Starch granules in parenchyma cells of CA under different drying methods

图3 不同干燥方式当归药材的油室Fig.3 Oil chamber structure of CA under different drying methods
3.3 活性物质含量比较
测定结果表明,4种干燥方式下,P当归的阿魏酸、欧当归内酯A和洋川芎内酯A含量均为最高,且与其他干燥方式均有显著性差异(P<0.05),其中阿魏酸含量分别比X、S和Y高57.4%、36.2%和8.0%;欧当归内酯A含量分别比X、S和Y高77.8%、14.3%和33.3%;洋川芎内酯A含量分别比X、S和Y高64.9%、96.8%和125.9%。藁本内酯含量在P和Y无显著性差异,分别比X、S和Y高32.5%、49.5%和11.4%(见表3)。
表3 不同干燥方式当归活性成分含量比较
3.4 抗氧化酶活性比较
由图5可知,SOD、CAT、POD酶活性和GSH含量均以S样品最高(P<0.5),Y和P最低。其中SOD酶活性分别比P、Y、X高78.60%、77.58%、76.70%,CAT酶活性分别比P、Y、X高86.58%、74.88%、78.63%,POD酶活性分别比P、Y、X高82.60%、80.21%、78.15%,GSH含量分别比P、Y、X高73.77%、52.47%、37.07%,而蛋白含量以P和Y样品的最高,分别为18.31和17.29 mg prot/g,S的含量最低,为3.05 mg prot/g。表明4种干燥方式显著影响了当归的抗氧化物酶活性及含量(P<0.05)。预示着干燥过程中发生了由多种酶催化的复杂生物化学反应,其中酚酸类物质因发生酶促氧化而导致损失。尤其是当归在晒干过程中长期暴露于阳光下,药材体内酶活性增加,加之与空气充分接触,加剧了酚酸类物质的大量损失[12],而平衡脱水干燥方式的介质温度、湿度和干燥时间等条件可控,且处在相对密闭的工况下,能够抑制多种氧化酶活性,最大限制地保持药材的内在品质。

图5 不同干燥方式对当归抗氧化酶活性比较Fig.5 Comparison of antioxidant enzymes in CA under different drying methods
3.5 相关分析
从表4不同干燥方式下当归活性成分及抗氧化活性酶相关性分析结果看,总蛋白与洋川芎内酯H和洋川芎内酯I呈极显著负相关(P<0.01),与洋川芎内酯A、藁本内酯、多糖和挥发油提取率呈显著或极显著正相关(P<0.05或P<0.01);SOD、CAT和POD酶活性均与洋川芎内酯H和洋川芎内酯I呈极显著正相关(P<0.01),与藁本内酯、多糖含量、挥发油提取率和总蛋白呈显著或极显著负相关(P<0.05或P<0.01);GSH含量与阿魏酸、洋川芎内酯A、藁本内酯、多糖、浸出物和总蛋白呈显著或极显著负相关(P<0.05或P<0.01),与洋川芎内酯H和SOD、CAT、POD呈显著或极显著正相关(P<0.05或P<0.01)。结果表明,当归干燥过程是药材内在品质形成的过程,其生物化学本质是以初生代谢产物(如多糖、总蛋白等)为底物,以多种酶类为催化剂的复杂生物化学过程,其最终产物为次生代谢产物(藁本内酯、阿魏酸、苯肽类等)。
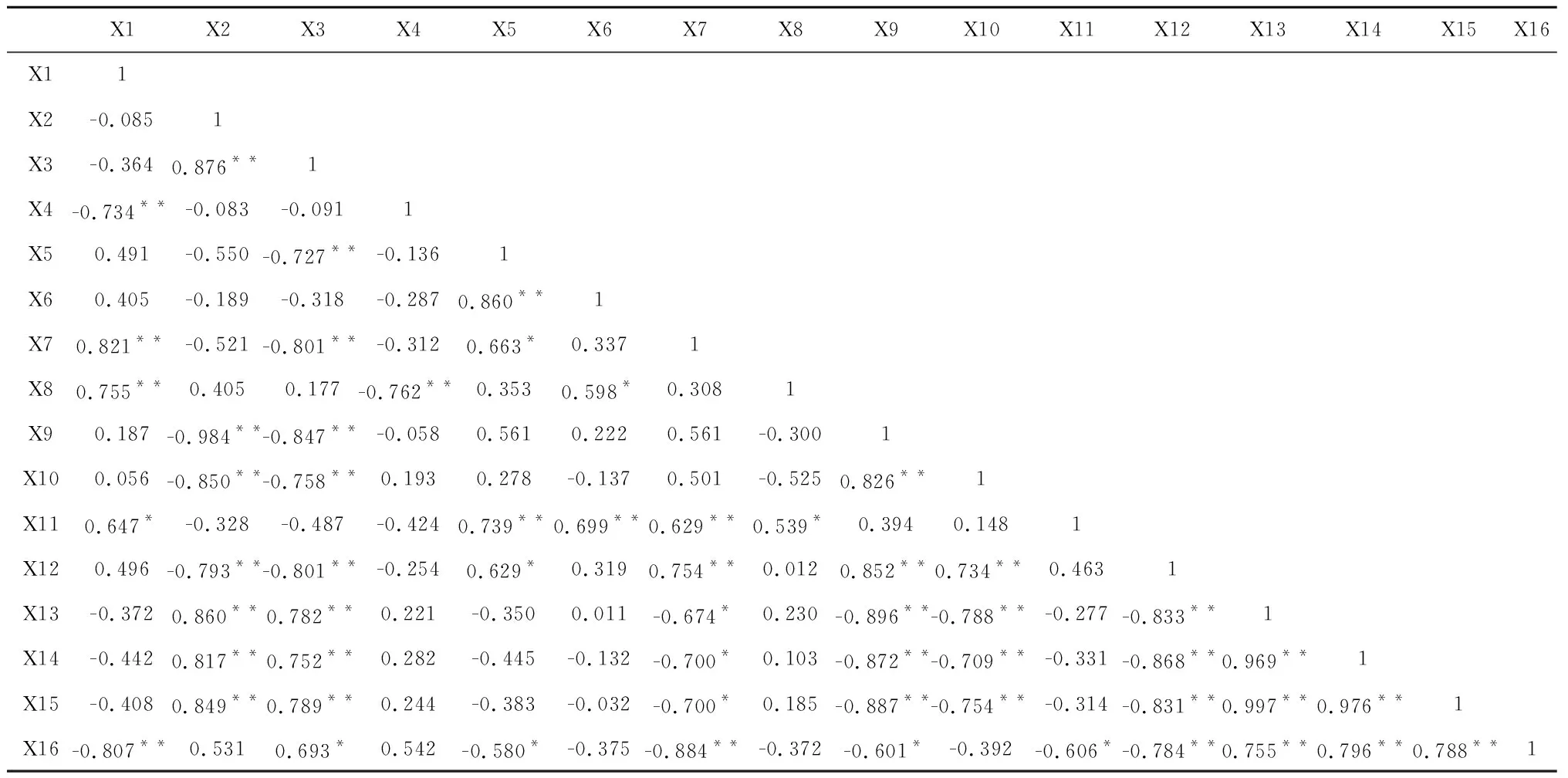
表4 不同干燥方式下当归活性物质与抗氧化物酶相关性分析
3.6 主成分分析
对11个活性成分进行主成分分析,得到11个成分的初始特征值及贡献率(表5)。结果显示:前3个主成分特征值均大于1,说明前3个主成分在当归质量评价中起着主导作用,3个主成分的累计方差贡献率达90.965%(>85%),可以代表当归中11个成分的大部分信息,能够客观地反映不同干燥方式当归药材的综合质量的影响。
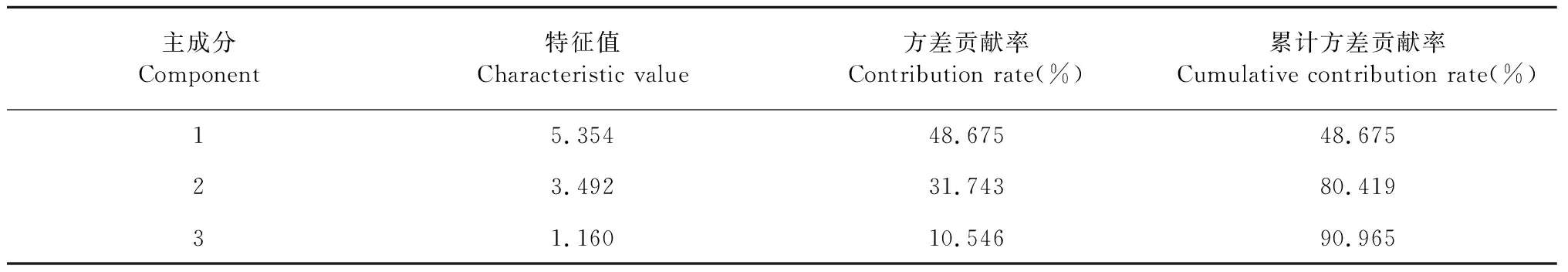
表5 旋转后的主成分特征值及方差贡献率
每个主成分包含的各因子其载荷系数综合反映了所测成分对各主成分的影响[14],由表6可知,洋川芎内酯A和藁本内酯对主成分1有较强的正负荷,洋川芎内酯H对主成分1有较强的逆负荷;欧当归内酯A对主成分2有明显的正负荷,阿魏酸松柏酯和挥发油提取率对主成分2有较强的逆负荷;正丁基苯酞的载荷因子在主成分3中较大,说明干燥方式对当归药材的活性成分影响较大。
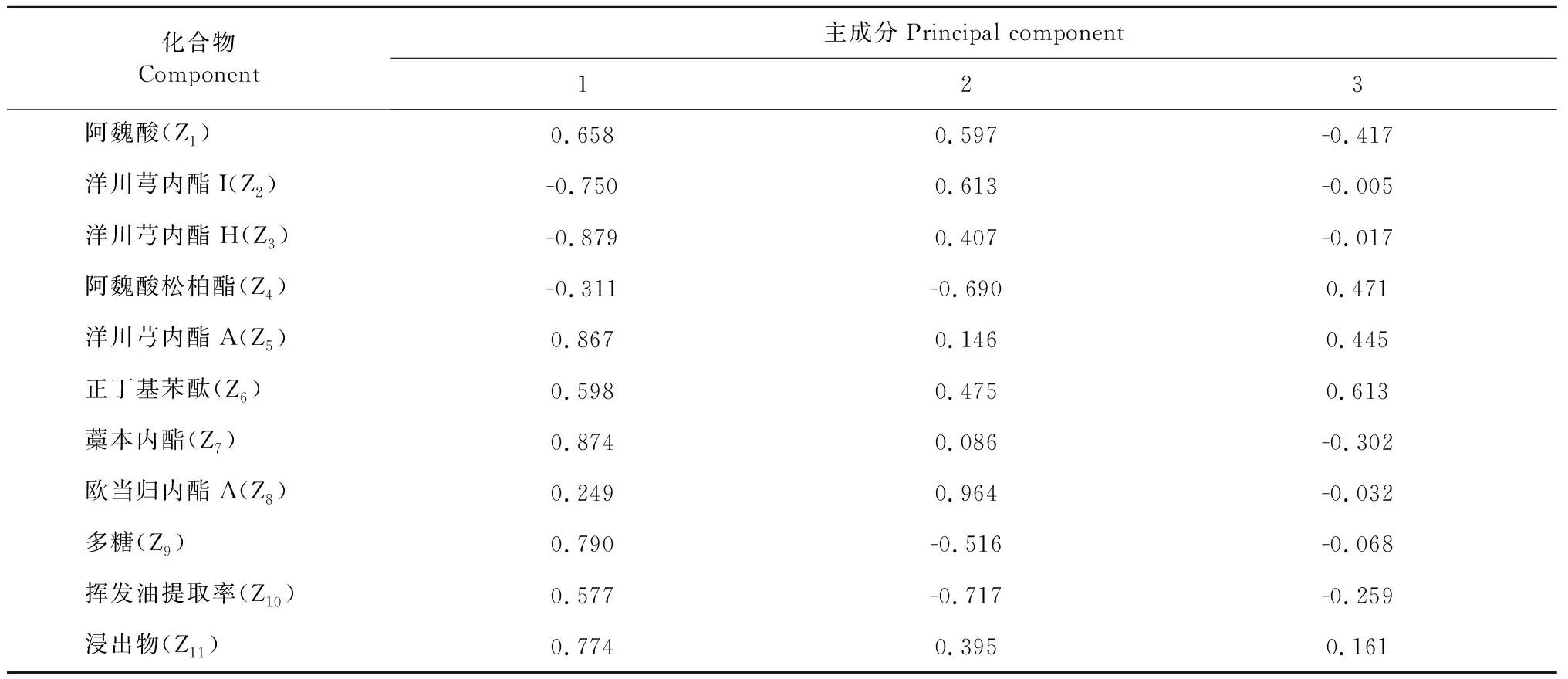
表6 旋转后主成分系数矩阵
由表6得出各主成分的表达式:
Y1=0.658Z1-0.750Z2-0.879Z3-0.311Z4+0.876Z5+0.598Z6+0.874Z7+0.249Z8+0.790Z9+0.577Z10+0.774Z11
Y2=0.597Z1+0.613Z2+0.407Z3-0.690Z4+0.146Z5+0.475Z6+0.086Z7+0.964Z8-0.516Z9-0.717Z10+0.395Z11
Y3=-0.417Z1-0.005Z2-0.017Z3+0.471Z4+0.445Z5+0.613Z6-0.302Z7-0.032Z8-0.068Z9-0.259Z10+0.161Z11
以各主要因子的方差贡献率与3个主成分的总贡献率之比为权重系数,即各主成分的权重系数为:0.535 1、0.349 0、0.115 9,得到主成分综合线性组合表达式Y总得分=0.535 1Y1+0.349 0Y2+0.115 9Y3,由表7可知,当归4种干燥方式下当归综合质量平衡脱水干燥>阴干>烟熏>晒干,且该方法干燥耗时较短,生产率较高,该方法可作为道地产区传统方法的替代。
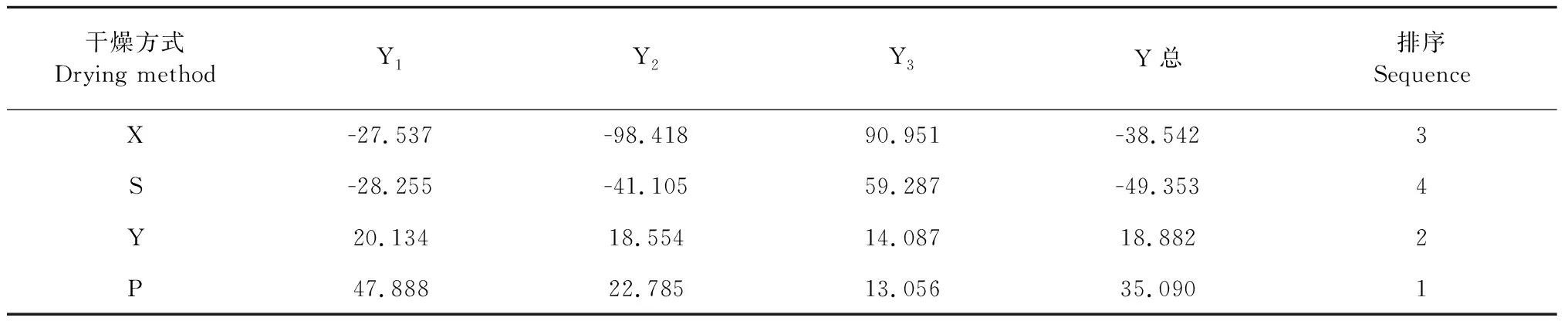
表7 旋转后主成分因子及综合评价
3.7 聚类分析
采用组间联接法对当归不同干燥方法进行聚类分析,结果见图6,由图6可知,当临界值介于5~10时,将当归干燥方式分为3大类,其中X1(熏干)样品聚为一类,S1、S2、X3、S3、X2聚为一类,Y1、Y2、Y3、P1、P2、P3样品聚为一类,说明阴干和平衡脱水干燥的当归药材成分含量较为接近。

图6 当归不同干燥方式的聚类分析Fig.6 Cluster analysis of different drying methods for CA
4 讨论
中药材道地性的内涵在药材表型上体现“优形”和“优质”,在临床应用价值上实现“优效”[15]。干燥过程在保障中药材的“优形”和“优质”和实现“优效”中起到最为关键的作用。根茎类中药材为多孔介质物料,其干燥过程一般分为升速、恒速和降速三个阶段。物料在干燥过程中,其介质的温度和含水量不断发生变化,属典型的非稳态不可逆过程[16]。熏干、晒干、阴干等传统干燥方式难以精准控制阶段性变温和调湿过程,而平衡脱水干燥技术可通过智能化自动控制系统调控阶段性变温和调湿过程,实现药材内外失水速率保持相对平衡,减少药材因脱水过快而发生的过度形变,抑制多种氧化酶活性,避免了苯肽类、挥发油、酚酸类等物质的氧化分解,最大限度地保持了药材的内在品质。
平衡脱水干燥的当归色泽鲜亮均匀、表面呈黄棕色,皱纹较疏松,油室大小、淀粉粒含量和活性成分含量均显著高于其它处理,其皮部油样光泽不明显,断面分泌腔呈棕色点状分布且较多。这与现行中国药典描述的性状存有差异。其原因可能与该工艺流程中对所干燥的当归药材未采用传统的搓揉工艺有关,需要在系统升级中加以改进。从中药资源生态学的观点看,中药材在干燥过程会受到许多非生物胁迫(如高温、高湿、干旱等)的影响,也会对活性成分组成及药效物质形成过程中相关的次生代谢途径、非酶促保护系统形成、抗性蛋白合成、应答基因表达等产生深刻影响。因此今后的研究有必要对中药材平衡脱水过程中的生理生化及分子机制作深入探究。也要对平衡脱水过程中的水分迁移规律与机制做进一步深入研究。

