滇产两面针中抗肿瘤活性生物碱成分研究
邓 颖,沈晓华,邓璐璐,3,郝小江,3,穆淑珍,3*
1贵州大学药学院,贵阳 550025;2贵州医科大学省部共建药用植物功效与利用国家重点实验室;3贵州省中国科学院天然产物化学重点实验室,贵阳 550014
中药两面针为芸香科花椒属植物两面针Zanthoxylumnitidum(Roxb.) DC.的干燥根[1],其药用部位为根,最早收载于清代赵其光所著的《本草求原》,名入地金牛,其苦、辛、平;有小毒;归肝、胃经[2]。主要分布于浙江、福建、台湾、湖南、广东、海南、广西、四川、云南等地,生于低丘陵地灌木丛中、路旁等向阳地[3]。目前关于其化学成分的研究主要集中在印度、广西、广东等地产的中药两面针上,近些年从两面针中新发现的次生代谢产物报道甚少[4],具有抗肿瘤作用化学成分的研究也主要集中在生物碱类化合物。
黑色素瘤是临床上发病率增长最快的恶行肿瘤之一,年增长率可达3%~5%,虽然在我国发病率较低,但近年来成倍的增长已对人民健康造成了极大的威胁。另外,黑色素瘤在我国长期以来都不被人们认识,市面上治疗黑色素瘤的方法多采用免疫治疗,而对天然药物治疗的选择并不多见。同时,对来源于两面针中具有广泛生物活性的生物碱研究目前主要聚焦在抑制人胃癌细胞、人肝癌细胞、人肾癌细胞、人肺癌细胞、人鼻咽癌细胞的增殖等方面,对抑制黑色素瘤的活性成分研究少见报道[5-7]。其中,白屈菜红碱具有人胃癌,宫颈癌活性[20],两面针碱可抑制人口腔鳞癌细胞,人肾癌细胞[21],鹅掌楸碱能显著抑制人肺癌细胞的增殖[22]。另外,据报道[23]两面针植物中部分生物碱成分对黑色素瘤细胞UACC62有较强的抑制活性,其中的白屈菜红碱能有效抑制黑色素瘤细胞B16的增殖和诱导凋亡作用,且显著升高半胱氨酸蛋白酶-3和Bax的基因表达水平,降低Bcl-2基因表达水平,该作用与抑制Wnt/β-catenim 信号通路的激活有关[24]。可见,两面针植物中可能存在潜在的抗黑色素瘤药物先导化合物。
因此,为了寻找一种活性显著,毒性低的创新型抗黑色素瘤药物,前期对滇产两面针根部乙醇提取物的不同萃取部位进行了活性追踪,发现石油醚萃取部位和氯仿萃取部位对黑色素瘤细胞株WM9的增殖具有明显的抑制作用,这对探索滇产两面针中抗黑色素瘤活性成分具有很重要的引导作用,为创新型抗肿瘤药物先导化合物的发现提供了物质基础。为此,本文针对滇产两面针根部乙醇提取物的石油醚萃取部位和氯仿萃取部位中的生物碱成分进行了分离纯化与结构鉴定,并测试其对黑色素瘤细胞WM9增殖的抑制活性。
1 实验部分
1.1 材料
滇产两面针采集于云南省西双版纳州勐腊县,经中国科学院西双版纳热带植物园肖春芬教授鉴定为两面针(Zanthoxylumnitidum(Roxb.) DC.),原植物标本(20140408)现存于贵州医科大学省部共建药用植物功效与利用国家重点实验室。
1.2 仪器与试剂
恒温振荡器HZQ-F160A(上海一恒科学仪器有限公司);立式压力蒸汽灭菌锅LDZX-50KBS(上海申安医疗器械厂);SW-CJ-2FD型双人单面净化工作台(苏州净化设备有限公司);电子天平FA2204B(上海精科天美科学仪器有限公司);INOVA-400 MHz核磁共振波谱仪;Bruker AM-400和DRC-100核磁共振仪(TMS为内标,瑞士Bruker公司);Sephadex LH-20凝胶(40~70 μm,瑞士Amershan Pharmacia Biotech AB公司);柱层析硅胶(200~300目和300~400目);硅胶H(10~40 μm)和薄层层析用硅胶GF254(0.20~0.25 mm,青岛海洋化工厂)。
本实验所用试剂均为分析纯试剂,二氯甲烷、石油醚、乙酸乙酯、甲醇、乙醇(分析纯,上海泰坦科技股份有限公司)和氯仿(工业级,使用前经重蒸处理),其余试剂为国产分析纯。黑色素瘤细胞WM9购于ATCC公司;阿霉素购于索莱宝公司;培养液:DMEM(Gibco,C11995500CP);胎牛血清(Bio IND,04-002-1A);Antibiotic-Antimycotic(Lifetechnologies,15240-112);MTT(四噻唑蓝:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,北京索莱宝科技有限公司)。
1.3 提取与分离
取滇产两面针干燥根,粉碎后称重,得20 kg。随后用50 升95%乙醇在60 ℃下加热回流提取三次,每次时间分别为4、3、2 h,过滤药渣,合并提取液,浓缩乙醇至无醇味,得浸膏。浸膏依次用石油醚,氯仿,正丁醇等体积萃取三次,将萃取物减压浓缩得到石油醚萃取部位180.1 g和氯仿萃取部位190.6 g。石油醚萃取部位用乙酸乙酯溶解后经300 g正相柱硅胶(200~300 目)拌样,然后用3 000 g正相柱硅胶(200~300目)湿法装柱,采用干法上样,进行柱层析色谱分离,用石油醚∶乙酸乙酯体系(15∶1→ 0∶1)进行梯度洗脱,得到Fr.1~7。Fr.6经硅胶柱层析和Sephadex LH-20凝胶柱色谱交替使用后,用石油醚∶乙酸乙酯混合溶剂(4∶1),经减压硅胶柱层析洗脱,得到化合物9(30 mg)。Fr.5(3 g)经硅胶柱层析,用氯仿∶甲醇=150∶1混合溶剂洗脱后,重结晶(氯仿∶甲醇)得到化合物4(1.3 g)。氯仿萃取部位用氯仿溶解后用400 g正相柱硅胶(200~300目)拌样,3 000 g正相柱硅胶(200~300目)湿法装柱,采用干法上样,进行柱层析色谱分离,用氯仿∶甲醇混合溶剂(100∶1→0∶100)梯度洗脱,得到Fr.1~9。Fr.4经硅胶柱层析(300~400目)和Sephadex LH-20凝胶柱色谱(氯仿∶甲醇=1∶1)反复使用后,用氯仿∶甲醇=100∶1混合溶剂经减压硅胶柱层析洗脱,得到化合物12(360 mg)。Fr.6经硅胶柱层析,用氯仿∶甲醇体系(150∶1→1∶40)梯度洗脱,得到Fr.6.1~6.8,Fr.6.3(600 mg)运用反相硅胶柱层析(RP-18,甲醇∶水=50∶50→90∶10)洗脱,再经Sephadex LH-20凝胶柱色谱(氯仿∶甲醇=1∶1)洗脱,得到化合物3(11 mg);Fr.6.4经硅胶柱层析,用氯仿∶甲醇体系(150∶1)洗脱后,运用减压硅胶柱层析(石油醚∶二乙胺=100∶1)洗脱,得到化合物5(30 mg);Fr.6.6经Sephadex LH-20凝胶柱色谱(氯仿∶甲醇=1∶1)洗脱,得到化合物7(7 mg)。Fr.7经硅胶柱层析,用氯仿∶甲醇=100∶1混合溶剂洗脱,得到Fr.7.1~7.4,Fr.7.1经硅胶柱层析,用氯仿∶甲醇=150∶1混合溶剂洗脱后,重结晶(氯仿∶甲醇)得到化合物10(460 mg);Fr.7.2用Sephadex LH-20凝胶柱色谱(氯仿∶甲醇=1∶1)洗脱后,再经正相硅胶柱层析(石油醚∶乙酸乙酯=20∶1)洗脱,重结晶(氯仿∶甲醇)得到化合物1(5 mg);Fr.7.3经减压硅胶柱层析(石油醚∶二乙胺=40∶1)洗脱得到化合物2(3 mg),经正相硅胶柱层析(氯仿∶甲醇=120∶1)得到化合物11(16 mg);Fr.7.4用Sephadex LH-20凝胶柱层析洗脱(氯仿∶甲醇=1∶1)后,再经反相硅胶柱层析(RP-18,甲醇-水)洗脱,重结晶(氯仿∶甲醇)得到化合物6(8 mg);Fr.7.4.2经正相硅胶柱层析,用氯仿∶甲醇=80∶1混合溶剂洗脱,得到化合物8(6 mg)。
1.4 抗肿瘤活性检测
采用MTT法测定化合物对肿瘤细胞增殖的抑制作用。分别取对数生长期的肿瘤细胞WM9消化,得到细胞悬液后计数,按照计数结果将细胞浓度调整为5×104个/mL,以每孔190 μL分别接种于96孔板中,在5% CO2,37 ℃条件下的细胞培养箱中培养24 h后,再分别加入10 μL阳性对照(阿霉素)以及不同浓度的12个化合物样品(每个化合物设置5个浓度梯度,分别为40、20、10、5、2.5和1.25 μM)加入到96孔板中,每个浓度设置3个复孔,于5% CO2,37℃细胞培养箱中培养72 h后。最后加入20 μL稀释好的MTT到96孔板中,继续培养4 h,取出96孔板于离心机上离心(2 500 rpm,25 min),用移液枪吸去上清液后,每孔加入DMSO 160 μL,在摇床上震动摇匀(160 rpm,10 min),用酶标仪在波长490 nm 下测定其吸光度A,实验重复三次。最后Craphad prism 5.0计算样品的半数抑制浓度(IC50)。
2 结果与讨论
2.1 化合物结构解析
化合物1~12的结构如图1所示(*标示的是新化合物)。
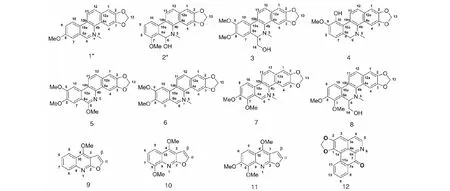
图1 滇产两面针根中化合物的结构(1~12)Fig.1 Structures of compounds 1-12 from the roots of Z.nitidum
化合物1橘黄色固体,ESI-MS:m/z341 [M + Na]+;对改良碘化铋钾显色剂呈阳性反应,推测为含氮生物碱类化合物。根据1H NMR、13C NMR和DEPT谱可知该化合物有16个氢信号,20个碳信号,分别为C×9,CH×8,OCH2O×1,NCH3×1以及OCH3×1,根据以上核磁数据并结合质谱信息可确定其分子式为C20H16NO3。通过对其1H NMR(如表1所示)的分析,可见结构中存在三个芳香质子信号δ8.12(1H,s,H-4),7.61(1H,d,J=1.2,H-7)和7.54(1H,s,H-1);两对苯环邻位耦合的质子信号δ8.20(1H,dd,J=8.9,1.2 Hz,H-9)和8.59(1H,d,J=8.9 Hz,H-10),8.51(1H,d,J=9.1 Hz,H-11)和7.99(1H,d,J=9.1 Hz,H-12);一个亚甲二氧基质子信号δ6.29(2H,s,H-13);一个氮甲基质子信号δ5.03(3H,s,-NCH3);一个甲氧基质子信号δ4.30(3H,s,8-OCH3);单峰的质子信号δ9.90(1H,s,H-6)。以上核磁数据显示化合物1应该是一个苯骈菲啶型生物碱[8]。
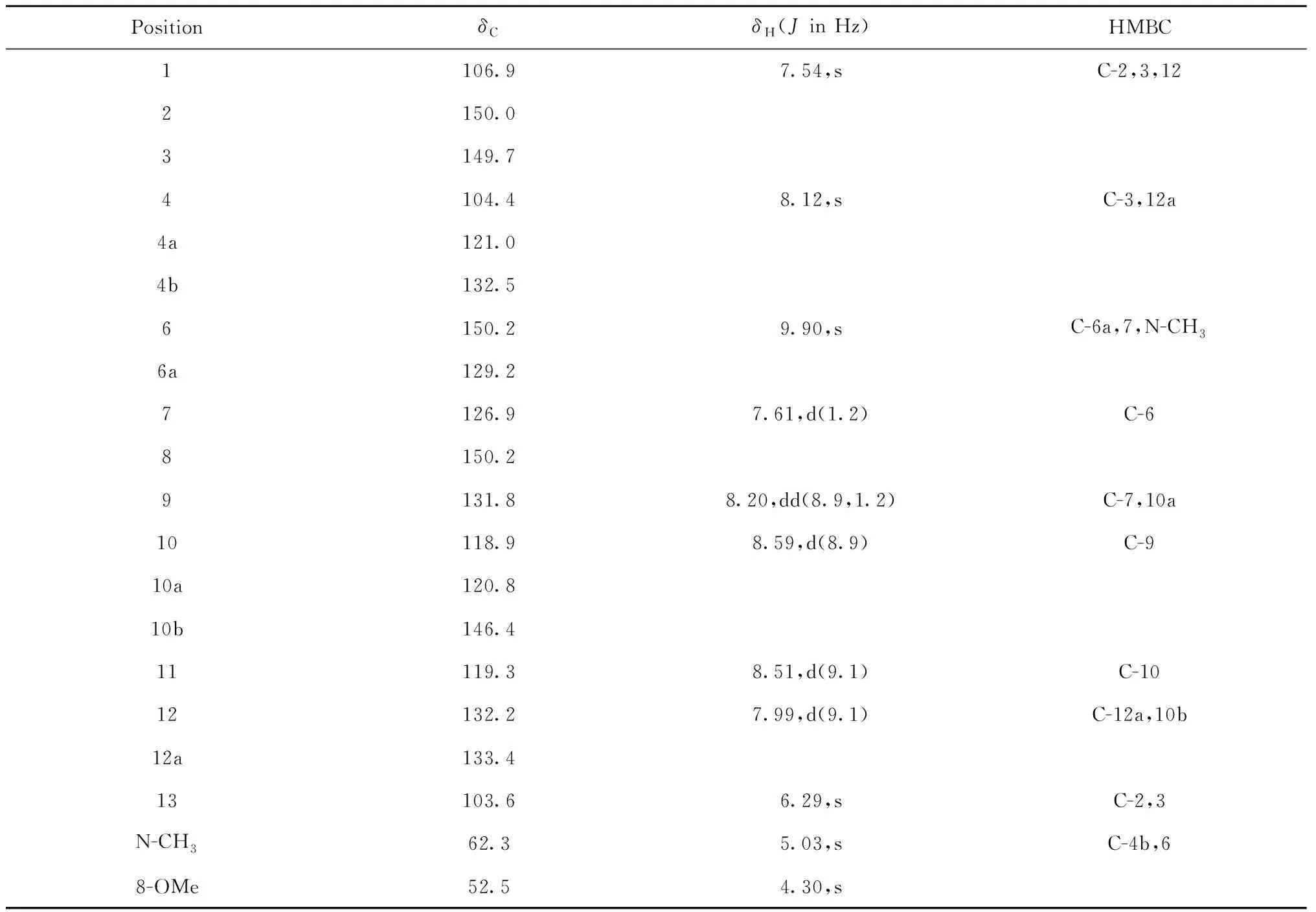
表1 化合物1的1H(400 MHz)和13C(100 MHz)NMR的核磁数据(CDCl3∶CD3OD=2∶1)
经文献报道发现,化合物1与文献[11]报道的化合物6(两面针碱)的核磁数据差别不大,主要的区别在于化合物1中C-9位的碳信号δC为131.8 ppm时,化合物6的C-9位的碳信号δC是127.8 ppm,并且化合物1比化合物6少一个甲氧基,而其他位置的碳信号基本一致。根据HSQC谱进一步分析可知,δH(8.20,dd,J=8.9,1.2,H-9)与δC(131.8,C-9)相关,表明C-9位含有一个氢质子,另外由HMBC相关谱(如图2所示)可知,H-9(δH8.20)与C-7(δC126.9)和C-10a(δC120.8)相关,H-10(δH8.59)与C-9(δC131.8)相关,由此可确定少的甲氧基在C-9位上;H-7(δH7.61)与C-6(δC150.2)和C-10a(δC120.8)相关,H-6(δH9.90)与C-6a(δC129.2),C-7(δC126.9)和N-CH3(δC62.3)相关,由此可知C-7位不含甲氧基。综上所述可鉴定化合物1为9-去甲氧基两面针碱,经查Scifinder数据库确认该化合物为一个新结构化合物。
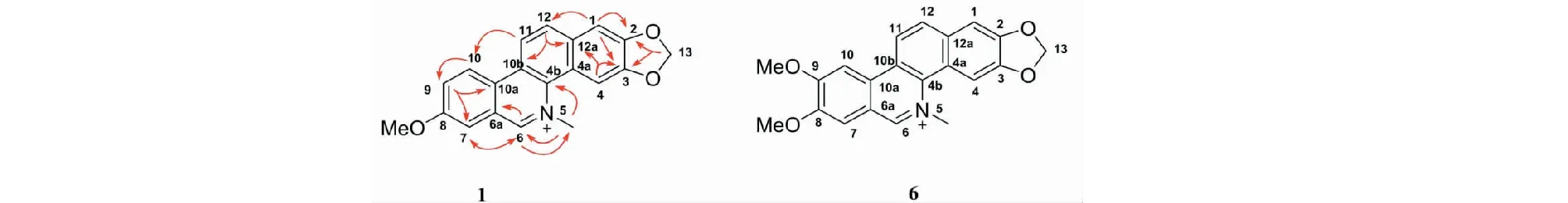
图2 化合物1的HMBC相关谱和化合物6的结构Fig.2 HMBC correlation spectrum of compound 1 and structure of compound 6
化合物2红色粉末,ESI-MS:m/z336 [M + H]+;对改良碘化铋钾显色剂呈阳性反应,推测为含氮生物碱类化合物。1H NMR、13C NMR和DEPT谱可知该化合物有17个氢信号,20个碳信号,分别为C×9,CH×8,OCH2O×1,NCH3×1以及OCH3×1,根据以上核磁数据可以确定其分子式为C20H17NO4。由1H NMR(如表2所示)谱分析,可见三个芳香质子信号δ7.12(1H,s,H-1),7.68(1H,s,H-4)和7.43(1H,d,J=4.9 Hz,H-8);两对苯环邻位耦合的质子信号δ7.74(1H,d,J=8.6 Hz,H-11)和7.47(1H,d,J=8.6 Hz,H-12),7.04(1H,d,J=8.5 Hz,H-9)和7.55(1H,d,J=8.5 Hz,H-10);一个亚甲二氧基质子信号δ6.07(2H,s,H-13);一个甲氧基质子信号δ3.96(3H,s,7-OCH3);氮甲基质子信号δ2.76(3H,s,N-CH3);一个单峰的质子信号δ5.52(1H,s,H-6)。以上核磁数据显示化合物2应该是二氢苯骈菲啶型生物碱[9]。
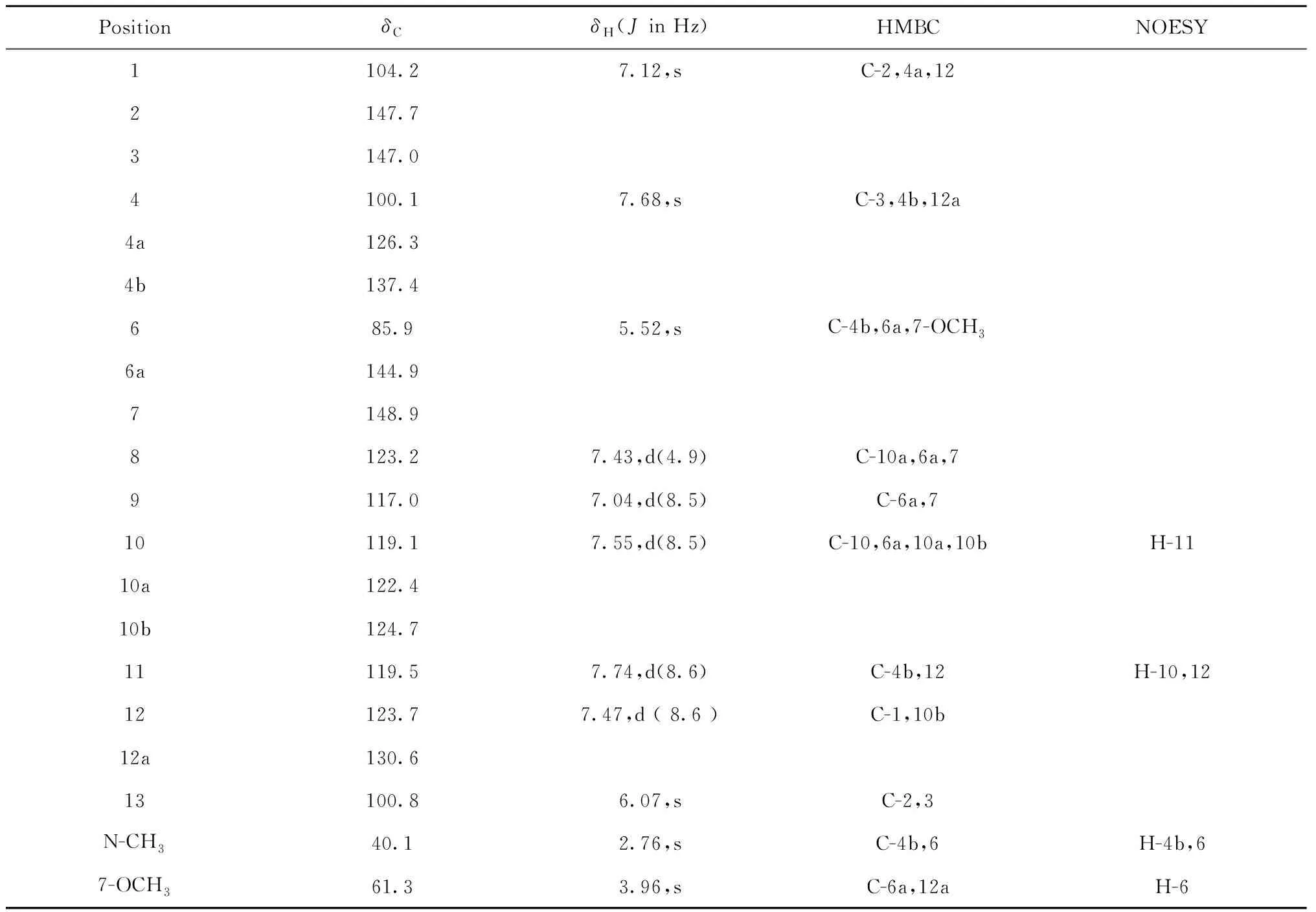
表2 化合物2的1H(400 MHz)和13C(100 MHz)NMR的核磁数据(CDCl3)
根据1H NMR和13C NMR(如表2所示)数据分析,化合物2(图3)和文献[10]中的已知化合物2′(buesgenine)相似(见图3),除了C-8,C-9的碳信号不同外,其他碳信号基本一致。由1H NMR数据可知化合物2比化合物2′多了一个芳香质子信号δH(7.43,d,J=4.9 Hz,H-8),分子量少了16,推测可能少一个酚羟基。根据HMBC相关谱(如图3所示)进一步分析可知,H-8(δH7.43)与C-6a(δC144.9),C-10a(δC122.4)和C-7(δC148.9)相关,由此可推测C-8位上没有取代基。另外,由于C-8缺少一个羟基,导致化合物2中C-9(δC117.0)位的碳信号向高场偏移3个化学位移值。综上所述可鉴定化合物2为8-dehydroxyl-buesgenine,经查Scifinder数据库确认该化合物为一个新结构化合物。化合物1和2的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
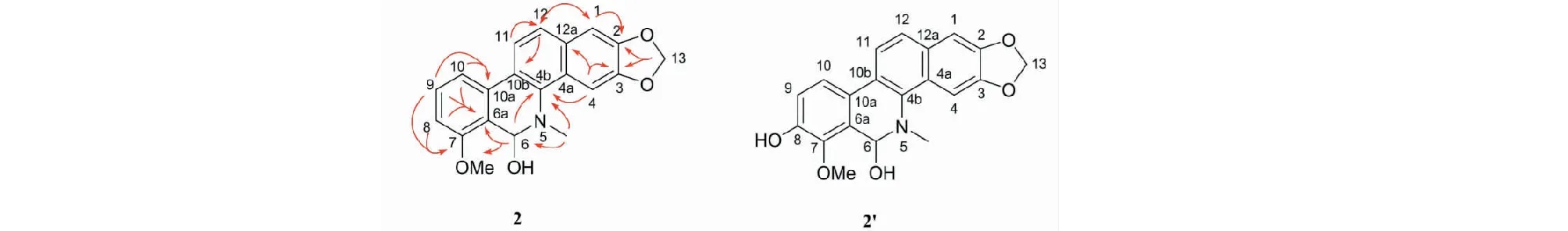
图3 化合物2的HMBC相关谱和化合物2′的结构Fig.3 HMBC correlation spectrum of compound 2 and structure of compound 2′
化合物3淡黄色粉末(CHCl3);ESI-MS:m/z380 [M + H]+。1H NMR(400 MHz,CDCl3)δ:7.69(1H,d,J=6.8 Hz,H-11),7.64(1H,s,H-4),7.52(1H,d,J=6.8 Hz,H-12),7.34(1H,s,H-10),7.13(1H,s,H-1),6.80(1H,s,H-7),6.06(2H,s,H-13),4.14(1H,m,H-6),4.00(3H,s,8-OCH3),3.96(3H,s,9-OCH3),3.45(1H,m,H14-a),3.15(1H,m,H14-b),2.74(3H,s,N-CH3);13C NMR(100 MHz,CDCl3)δ:149.0(C-8),149.0(C-9),148.5(C-3),147.5(C-2),137.8(C-4b),131.0(C-12a),127.0(C-4a),124.3(C-10a),124.3(C-12),124.0(C-6a),123.4(C-10b),119.5(C-11),110.5(C-7),106.3(C-10),104.6(C-1),101.1(C-13),99.8(C-4),65.3(C-6),62.8(C-14),56.1(8-OCH3),56.0(9-OCH3),42.7(N-CH3)。以上数据和文献报道一致[11],故鉴定化合物3为6β-hydroxymenthyldihydronitidine。
化合物4无色固体(CHCl3);ESI-MS:m/z320 [M + H]+。1H NMR(400 MHz,CDCl3)δ:9.61(1H,s,H-6),8.57(1H,s,H-4),8.33(1H,d,J=8.4 Hz,H-11),8.29(1H,d,J=9.2 Hz,H-7),7.83(1H,d,J=8.4 Hz,H-12),7.53(1H,d,J=9.2 Hz,H-8),7.25(1H,s,H-1),6.12(2H,s,H-13),4.11(3H,s,10-OCH3);13C NMR(100 MHz,CDCl3)δ:149.1(C-9),148.7(C-3),147.7(C-2),146.3(C-6),143.1(C-10),139.7(C-4b),130.2(C-12a),129.2(C-4a),128.2(C-6a),127.6(C-12),123.8(C-11),122.3(C-10a),121.2(C-10b),119.1(C-8),118.6(C-7),104.9(C-1),102.0(C-4),101.8(C-13),62.1(10-OCH3)。以上波谱数据与文献[9]中报道的花椒木精波谱数据基本一致,故鉴定化合物4为花椒木精。
化合物5棕色固体(CHCl3);ESI-MS:m/z386 [M + Na]+。1H NMR(400 MHz,CDCl3)δ:7.98(1H,d,J=6.8 Hz,H-11),7.92(1H,s,H-7),7.63(1H,s,H-4),7.58(1H,s,H-10),7.55(1H,d,J=6.8 Hz,H-12),7.18(1H,s,H-1),6.11(2H,s,H-13),4.11(3H,s,6-OCH3),4.06(3H,s,8-OCH3),3.98(3H,s,9-OCH3);13C NMR(100 MHz,CDCl3)δ:164.3(C-6),153.4(C-9),149.6(C-8),147.4(C-2),147.0(C-3),135.8(C-4b),131.8(C-12a),128.9(C-10a),123.2(C-12),121.0(C-4a),119.0(C-6a),118.3(C-11),116.6(C-10b),108.5(C-7),104.7(C-1),102.7(C-10),102.6(C-4),101.5(C-13),56.2(6-OCH3),56.1(8-OCH3),41.2(9-OCH3)。以上波谱数据与文献[12]中报道的rhoifoline B波谱数据基本一致,故鉴定化合物5为rhoifoline B。
化合物6黄色粉末(CHCl3);ESI-MS:m/z349 [M + H]+。1H NMR(400 MHz,CDCl3)δ:9.68(1H,s,H-6),8.19(1H,d,J=9.1 Hz,H-12),8.60(1H,d,J=9.1 Hz,H-11),8.17(1H,s,H-10),8.14(1H,s,H-4),7.81(1H,s,H-7),7.54(1H, s,H-1),6.30(2H,s,H-13),4.96(3H,s,N-CH3),4.31(3H,s,9-OCH3),4.16(3H,s,8-OCH3);13C NMR(100 MHz,CDCl3)δ:150.8(C-8),150.4(C-6),149.8(C-2),149.1(C-3),127.8(C-9),133.6(C-12a),133.1(C-4b),132.4(C-12),130.0(C-6a),126.6(C-7),146.1(C-10b),121.0(C-4a),120.2(C-10a),119.3(C-11),118.9(C-5),106.5(C-1),104.3(C-4),103.2(C-13),52.8(8-OCH3), 53.1(9-OCH3),60.9(N-CH3)。以上波谱数据与文献[13]中报道的两面针碱波谱数据基本一致,故鉴定化合物6为两面针碱。
化合物7黄色粉末(CHCl3);ESI-MS:m/z349 [M + H]+。1H NMR(400 MHz,CDCl3)δ:10.00(1H,s,H-6),8.65(1H,d,J=9.2 Hz,H-11),8.62(1H,d,J=8.9 Hz, H-10),8.23(1H,d,J=8.9 Hz,H-9),8.18(1H,d,J=9.2 Hz,H-12),8.13(1H,s,H-4),7.54(1H,s,H-1),6.30(2H,s,H-13),5.04(3H,s,N-CH3),4.34(3H,s,8-OCH3),4.17(3H,s,7-OCH3);13C NMR(100 MHz,CDCl3)δ:151.3(C-8),150.6(C-6),150.4(C-2),150.2(C-3),146.8(C-7),133.6(C-12a),132.8(C-4b),132.4(C-12),129.5(C-6a),127.0(C-9),126.7(C-10b),121.0(C-4a),120.2(C-10a),119.3(C-11),118.9(C-5),106.9(C-1),104.4(C-4),103.6(C-13),52.7(8-OCH3),57.4(7-OCH3),62.3(N-CH3)。以上波谱数据与文献[5]中报道的白屈菜红碱波谱数据基本一致,故鉴定化合物7为白屈菜红碱。
化合物8无色固体(CHCl3);ESI-MS:m/z380 [M + H]+。1H NMR(400 MHz,CDCl3)δ:7.70(1H,d,J=8.4 Hz,H-11),7.65(1H,s,H-4),7.55(1H,d,J=8.4 Hz,H-10),7.50(1H,d,J=8.4 Hz,H-12),7.12(1H,s,H-1),6.97(1H,d,J=8.4 Hz,H-9),6.06(2H,s,H-13),4.67(1H,dd,J=10.4,4.8 Hz,H-6),3.95(3H,s,7-OCH3),3.93(3H,s,8-OCH3),3.49(1H,t,J=10.4,4.8 Hz,H14-a),3.10(1H,t,J=10.4,4.8 Hz,H14-b),2.74(3H,s,N-CH3);13C NMR(100 MHz,CDCl3)δ:152.2(C-8),148.4(C-3),147.5(C-2),146.4(C-7),137.8(C-4b),131.0(C-12a),127.0(C-4a),125.8(C-6a),125.1(C-10a),124.3(C-12),123.4(C-10b),119.8(C-11),118.9(C-10),111.8(C-9),104.6(C-1),101.1(C-13),99.8(C-4),61.9(6-CH2OH),61.2(7-OCH3),55.8(8-OCH3),42.9(N-CH3)。以上波谱数据与文献[14,15]中报道的博落回醇碱波谱数据基本一致,故鉴定化合物8为博落回醇碱。
化合物9无色固体(CHCl3);ESI-MS:m/z200 [M + H]+。1H NMR(400 MHz,CDCl3)δ:8.29(1H,dd,J=8.6,1.4 Hz,H-5),8.01(1H,dd,J=8.6,1.4 Hz,H-8),7.69(1H,m,H-7),7.46(1H,m,H-6),7.64(1H,d,J=2.7 Hz,H-α),7.10(1H,d,J=2.7 Hz,H-β),4.47(3H,s,4-OCH3);13C NMR(100 MHz,CDCl3)δ:145.6(C-10),143.6(C-8),129.6(C-7),127.8(C-α),123.7(C-6),122.3(C-5),118.7(C-3),104.7(C-β),103.4(C-9),59.0(4-OCH3)。以上波谱数据与文献[16]中报道的白鲜碱波谱数据基本一致,故鉴定化合物9为白鲜碱。
化合物10淡黄色粉末(CHCl3);ESI-MS:m/z230 [M + H]+。1H NMR(400 MHz,CDCl3)δ:7.74(1H,dd,J=8.6,1.2 Hz,H-5),7.32(1H,dd,J=8.6,7.6 Hz,H-6),7.28(1H,dd,J=7.6,1.2 Hz,H-7),7.78(1H,d,J=2.8 Hz,H-α),7.12(1H,d,J=2.8 Hz,H-β),4.40(3H,s,4-OCH3),4.07(3H,s,8-OCH3);13C NMR(100 MHz,CDCl3)δ:163.0(C-4),156.7(C-8),154.3(C-2),143.7(C-α),137.3(C-9),123.2(C-6),119.4(C-10),113.9(C-5),107.5(C-β),104.4(C-7),103.6(C-3),58.8(4-OCH3),55.8(8-OCH3)。以上波谱数据与文献[17]中报道的γ-崖椒碱波谱数据基本一致,故鉴定化合物10为γ-崖椒碱。
化合物11淡黄色固体(CHCl3);ESI-MS:m/z260 [M + H]+。1H NMR(400 MHz,CDCl3)δ:8.00(1H,d,J=9.2 Hz,H-5),7.57(1H,d,J=2.8 Hz,H-α),7.23(1H,d,J=9.2 Hz,H-6),7.03(1H,d,J=2.8 Hz,H-β),4.48(3H,s,4-OCH3),4.12(3H,s,7-OCH3),4.03(3H,s,8-OCH3);13C NMR(100 MHz,CDCl3)δ:164.3(C-2),157.2(C-4),152.1(C-10),143.0(C-α),141.8(C-7),141.3(C-8),118.2(C-5),114.8(C-3),112.0(C-6),104.6(C-β),102.0(C-9),61.6(8-OCH3),59.0(4-OCH3),56.7(7-OCH3)。以上波谱数据与文献[9]中报道的茵芋碱波谱数据基本一致,故鉴定化合物11为茵芋碱。
化合物12黄色粉末(CHCl3);ESI-MS:m/z276 [M + H]+。1H NMR(400 MHz,CDCl3/CD3OD)δ:8.63(1H,d,J=5.2 Hz,H-5),7.61(1H,d,J=5.2 Hz,H-4),8.33(1H,dd,J=8.1,7.6 Hz,H-11),8.27(1H,dd,J=8.1,7.6 Hz,H-8),7.57(1H,m,H-10),7.45(1H,m,H-9),6.92(1H,s,H-3),6.28(2H,s,-O-CH2-O-);13C NMR(100 MHz,CDCl3/CD3OD)δ:182.5(C-7),152.2(C-2),148.6(C-1),144.4(C-3a),144.2(C-5),136.1(C-6a),134.4(C-10),132.9(C-11a),130.8(C-7a),128.6(C-9),128.4(C-8),127.5(C-11),125.0(C-4),123.1(C-4a),107.4(C-1a),103.4(C-3),103.2(-OCH2O-)。以上波谱数据与文献[18]中报道的鹅掌楸碱波谱数据基本一致,故鉴定化合物12为鹅掌楸碱。
2.2 抗肿瘤活性评价
采用MTT法测定了化合物1~12对黑色素瘤WM9细胞株增殖的抑制作用,结果见表3。与阿霉素相比,化合物3、5、6、7和12对WM9细胞均有不同程度的抑制作用,IC50分别为1.936、21.890、0.880、6.681和12.370 μM。其中化合物3(1.936 μM)和6(0.880 μM)对WM9细胞具有较强的抑制作用。

表3 化合物1~12对黑色素瘤WM9细胞的IC50值
3 结论
本实验从滇产两面针根茎的95%乙醇提取物的石油醚和氯仿萃取部位分离纯化,并通过一维和二维核磁数据鉴定了12个化合物的结构,其中化合物1~8为苯骈菲啶类,化合物9~11为呋喃喹啉类,化合物12为阿朴菲类,且化合物1和2为新化合物。此外对所有化合物首次进行了黑色素瘤细胞增殖的抑制作用研究,研究表明化合物3、5、6、7和12对WM9细胞均展现出较好的抑制活性,其中化合物3(IC50=1.936 μM)和6(IC50=0.880 μM)对WM9细胞的增殖具有明显的抑制作用。综合分析发现,活性较好的化合物均为苯骈菲啶类,这为苯骈菲啶类化合物的生物活性研究提供了一定的价值和意义;另外,在活性较强的化合物3和6中,因文献报道[19]化合物6具有一定的毒性,后续可从化合物3出发,进一步深入探讨其药理作用和构效关系,为寻找低毒高效的抗黑色素瘤细胞的药物分子提供物质基础。黑色素瘤是临床上发病率增长最快的恶性肿瘤之一,它极大的威胁着人们的健康,由于我国对治疗黑色素瘤的天然药物研究并不多见,这为发现新型天然抗黑色素瘤的药物提供了研究思路。本研究不仅丰富了两面针的化学成分及药理活性研究,还对寻找低毒高效的苯骈菲啶类化合物的抗黑色素瘤细胞生物活性和构效关系研究提供了研究依据,为滇产两面针进一步的开发和利用提供了理论基础。

