荠苧黄酮通过抑制氧化应激和炎症改善高原缺氧诱导的小鼠脑组织损伤
刘 睿,邵 瑾,赵 彤,何 蕾,马慧萍,景临林*
1联勤保障部队第九四〇医院干部病房;2联勤保障部队第九四〇医院药剂科 全军高原医学重点实验室,兰州 730050
高原约占地球表面的五分之一,而世界上约有1.4亿人生活在海拔超过2 500 m的高原,其中,我国约有800万人生活在平均海拔4 000 m以上的青藏高原[1]。大量研究表明:暴露于高海拔引起的低压低氧(hypobaric hypoxia,HH)环境下会对人体的病理生理变化产生严重影响[2]。其中,脑组织由于耗氧量大,是对缺氧最为敏感的器官之一[3]。随着中国经济的快速发展和人民生活水平的不断提高,奔赴高原进行工作、旅游和探险的人越来越多,如何改善低压低氧诱导的脑组织损伤成为目前研究的热点问题。
荠苧黄酮(5-羟基-6,7-二甲氧基黄酮;mosloflavone)(图1)是首次从苏州荠苧(MoslasoochowensisMatsuda)分离得到的一种黄酮化合物[4]。研究表明:荠苧黄酮具有抗氧化、抗炎和抗病毒等活性[5-7]。课题组前期研究发现:荠苧黄酮对缺氧PC12细胞具有明显的保护作用[8],进一步通过动物实验证明其还能够改善高原缺氧诱导的小鼠脑组织损伤[9],但是具体的作用机制尚不明确。有证据表明:急性低压缺氧能够诱导脑组织中活性氧(ROS)的增加[10]和炎性因子的释放[11],本研究将探究荠苧黄酮对低压低氧诱导小鼠脑组织氧化应激和炎性反应的影响,阐明其可能的作用机制。

图1 荠苧黄酮的结构Fig.1 Chemical structure of mosloflavone
1 材料与仪器
1.1 实验动物
雄性清洁级BABL/c小鼠(4周龄,体重20±2g),由联勤保障部队第九四〇医院动物实验科提供,许可证号:SYXK(军)2014-0029。
1.2 药物与试剂
荠苧黄酮按照文献方法制备,纯度>98%[8];芦丁购自陕西慈缘生物技术有限公司,纯度>98%。丙二醛(MDA,批号:20 150 812)测试盒、BCA法蛋白定量试剂盒(批号:20 150 921)、超氧化物歧化酶(SOD,批号:20 150 724)测试盒、过氧化氢酶(CAT,批号:20 150 613)测试盒和谷胱甘肽过氧化物酶(GSH-Px,批号:20 150 802)试剂盒均购自南京建成生物工程研究所;2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)购自sigma公司;白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)ELISA试剂盒购自Abcam公司。IL-1β、TNF-α、SOD1、CAT和β-actin等一抗购自Abcam公司;羊抗小鼠IgG-HRP抗体和羊抗兔IgG-HRP抗体购自北京中杉金桥生物技术有限公司;SDS-PAGE凝胶制备试剂盒、ECL Plus超敏发光液和PVDF膜购自北京索莱宝科技有限公司。
1.3 主要仪器
FLYDWC50-IIC低压低氧动物实验舱(贵州风雷航空军械有限公司);CriterionTM电泳槽(Bio-Rad公司);Spectramax i3多功能酶标仪(Molecular Devices公司);BPG-9 040精密鼓风干燥箱(上海一恒科学仪器有限公司);Microfuge 22R冷冻离心机(Beckman Coulter公司);多样品组织研磨仪Tissuelyser-24(上海净信实业发展有限公司)。
2 方法
2.1 常压密闭缺氧实验
清洁级健康BABL/c雄性小鼠50只,随机分为缺氧模型组、芦丁组(500 mg/kg)和荠苧黄酮低(125 mg/kg)、中(250 mg/kg)、高(500 mg/kg)剂量组,每组10只,连续灌胃给药5天,缺氧模型组给予等量生理盐水,最后一次给药后半小时后,将小鼠置于250 mL广口瓶中(瓶中放置5 g钠石灰用于吸收CO2),密闭瓶塞后开始计时,以小鼠最后一次大喘气为死亡指征,纪录小鼠存活时间,计算存活率=(给药组存活时间-模型组存活时间)/模型组存活时间。
2.2 低压低氧诱导脑组织损伤模型
低压低氧诱导脑组织损伤模型的构建参照课题组先前报道的方法进行[12]。清洁级健康BABL/c雄性小鼠84只,随机分为正常对照组、缺氧模型组、芦丁组(500 mg/kg)、荠苧黄酮组(500 mg/kg),每组21只,连续灌胃给药5天。正常对照组小鼠不给药,缺氧模型组给予等量生理盐水,最后一次给药后,除正常对照组外,将其它三组小鼠置于低压低氧动物实验舱中,以10 m/s的速度升至海拔8 000 m并维持12 h,随后以10 m/s的速度将实验舱中气压升至于外界大气压,迅速处死小鼠,摘除脑组织,并按照测定要求对其进行处理。
2.3 脑组织含水量测定
每组分别取12只小鼠的脑组织标本,平均将其分成两个半球。用精密电子天平称量左半球的重量以获得湿重。然后在80 ℃下干燥72 h,以达到恒定的干重。大脑含水量=(湿重-干重)/湿重×100%。
2.4 脑组织中ROS水平测定
每组分别取6只小鼠的脑组织右半球标本,用RIPA裂解液处理后,14 000 rpm低温(4 ℃)离心20 min取上清。将10 μM DCFH-DA的加入上清液中,37 ℃避光孵育15 min,测定激发波长535 nm,发射波长538 nm的吸光度值。ROS水平以相对于对照组的百分比表示。
2.5 脑组织中氧化应激相关指标的测定
每组分别取6只小鼠的脑组织右半球标本,称重后加入9倍量冰生理盐水,使用组织研磨仪制备脑组织匀浆,然后3 500 rpm低温(4 ℃)离心10 min后取上清。MDA和GSH含量以及SOD、CAT和GSH-Px活性的按照相关试剂盒说明书进行测定。MDA含量和GSH含量分别以nmol/mg protein和μmol/g protein表示,SOD、CAT和GSH-Px活性以U/mg protein表示。
2.6 脑组织中炎性因子含量测定
每组分别取6只小鼠的脑组织标本,用RIPA裂解液处理后,3 500 rpm低温(4 ℃)离心5 min。上清液中IL-1β,TNF-α和IL-6的浓度按照相关ELISA试剂盒说明进行测定。炎性因子含量以pg/mL表示。
2.7 脑组织蛋白表达水平的测定
每组分别取3只小鼠的脑组织标本,称重后加入9倍量RIPA裂解液,使用组织研磨仪制备脑组织匀浆,然后12 000 rpm低温(4 ℃)离心15 min,取上清,采用BCA法计算蛋白浓度。取等量蛋白样品上样,采用SDS-PAGE进行分离,然后将蛋白转至PVDF膜上,使用5%脱脂牛奶封闭2 h后,分别加入SOD1(1∶5 000)、CAT(1∶1 000)、IL-1β(1∶1 000)、TNF-α(1∶3 000)和β-actin(1∶1 000)等一抗,4 ℃摇床孵育过夜,用TBST缓冲液漂洗4次,每次10 min。加入二抗,β-actin蛋白使用羊抗小鼠IgG-HRP(1∶2 000稀释),其余均用羊抗兔IgG-HRP(1∶5 000稀释),室温孵育2 h,ELC发光,暗室曝光,灰度值用Image-Pro Plus6.0软件扫描测定。
2.8 统计学处理
3 结果
3.1 荠苧黄酮对常压密闭小鼠脑存活时间的影响
与缺氧模型组相比,荠苧黄酮低、中、高三个剂量组均能延长小鼠在常压密闭缺氧环境中的存活时间,且呈剂量依赖性,其中荠苧黄酮高剂量组的存活延长率达到49%,结果见表1。因此,后续实验中荠苧黄酮的给药剂量为500 mg/kg。
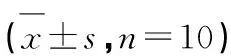
表1 荠苧黄酮对常压密闭缺氧小鼠存活时间的影响
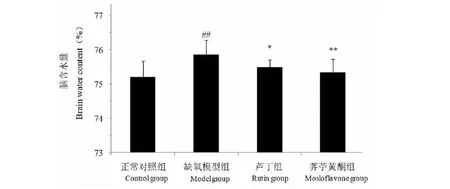
图2 荠苧黄酮对低压低氧小鼠脑组织含水量的影响Fig.2 Effects of mosloflavone on brain water content in mice after HH 注:与正常对照组相比,##P<0.01;与缺氧模型组相比,*P<0.05,**P<0.01。 Note: ##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group.
3.2 荠苧黄酮对低压低氧小鼠脑组织含水量的影响
与正常对照组相比,缺氧模型组小鼠脑组织含水量明显升高(P<0.01),经荠苧黄酮和芦丁干预后,脑组织含水量较缺氧模型组显著降低(P<0.01或P<0.05)。结果见图2。
3.3 荠苧黄酮对低压低氧小鼠脑组织中ROS和MDA含量的影响
缺氧模型组小鼠脑组织中ROS和MDA含量较正常对照组显著升高(P<0.01),经荠苧黄酮和芦丁预处理可以显著降低ROS和MDA水平(P<0.01)。结果见图3。
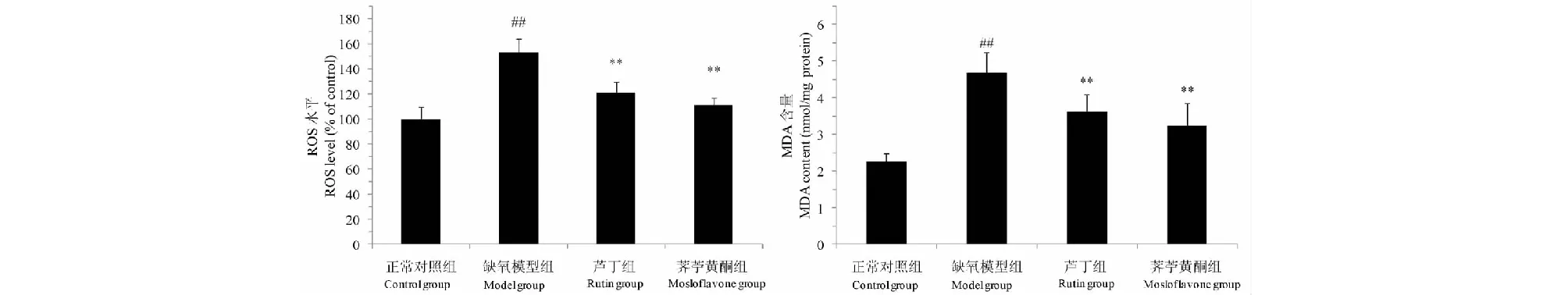
图3 荠苧黄酮对低压低氧小鼠脑组织中ROS和MDA含量的影响Fig.3 Effects of mosloflavone on the content of ROS and MDA in mice brain after HH 注:与正常对照组相比,##P<0.01;与缺氧模型组相比,**P<0.01。 Note: ##P<0.01 vs normal group;**P<0.01 vs model group.
3.4 荠苧黄酮对低压低氧小鼠脑组织中抗氧化体系的影响
缺氧模型组小鼠脑组织中GSH含量和SOD、CAT和GSH-Px活性较正常对照组显著下降(P<0.01),经荠苧黄酮和芦丁预处理可以显著提高GSH含量(P<0.01)和SOD、CAT和GSH-P的活力(P<0.01)。结果见图4。
图4 荠苧黄酮对高原缺氧小鼠脑组织中GSH、SOD、CAT和GSH-Px的水平的影响Fig.4 Effects of mosloflavone on the level of GSH,SOD,CAT and GSH-Px in mice brain after HH 注:与正常对照组相比,##P<0.01;与缺氧模型组相比,*P<0.05,**P<0.01。 Note:##P<0.01 vs normal group;*P<0.05,**P<0.01 vs model group.
3.5 荠苧黄酮对低压低氧小鼠脑组织炎性因子含量的影响
缺氧模型组与正常对照组相比,小鼠脑组织中IL-1β、TNF-α和IL-6的含量显著升高(P<0.01);经荠苧黄酮和芦丁预处理能够逆转这种变化,降低促炎性因子的水平。结果见表2。
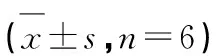
表2 荠苧黄酮对低压低氧小鼠脑组织中IL-1β、TNF-α和IL-6含量的影响
3.6 荠苧黄酮对低压低氧小鼠脑组织中SOD1和CAT蛋白表达的影响
与正常对照组相比,缺氧模型组SOD1和CAT的蛋白表达显著降低(P<0.01),经芦丁和荠苧黄酮预处理可以显著升高缺氧小鼠脑组织中SOD1和CAT的蛋白表达(P<0.01)。结果见图5。
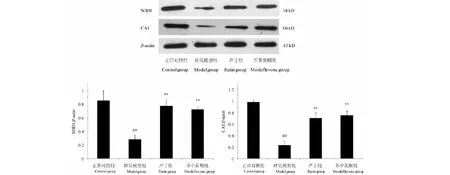
图5 荠苧黄酮对低压低氧小鼠脑组织中SOD1和CAT蛋白表达的影响Fig.5 Effects of mosloflavone on the expression of SOD1 and CAT in mice brain after HH 注:与正常对照组相比,##P<0.01;与缺氧模型组相比,**P<0.01。 Note:##P<0.01 vs normal group;**P<0.01 vs model group.
3.7 荠苧黄酮对低压低氧小鼠脑组织中IL-1β和TNF-α蛋白表达的影响
与正常对照组比较,缺氧模型组小鼠脑组织中IL-1β和TNF-α蛋白的表达显著升高(P<0.01);经芦丁和荠苧黄酮预处理可显著降低脑组织中IL-1β和TNF-α蛋白的表达(P<0.05或P<0.01)。结果见图6。
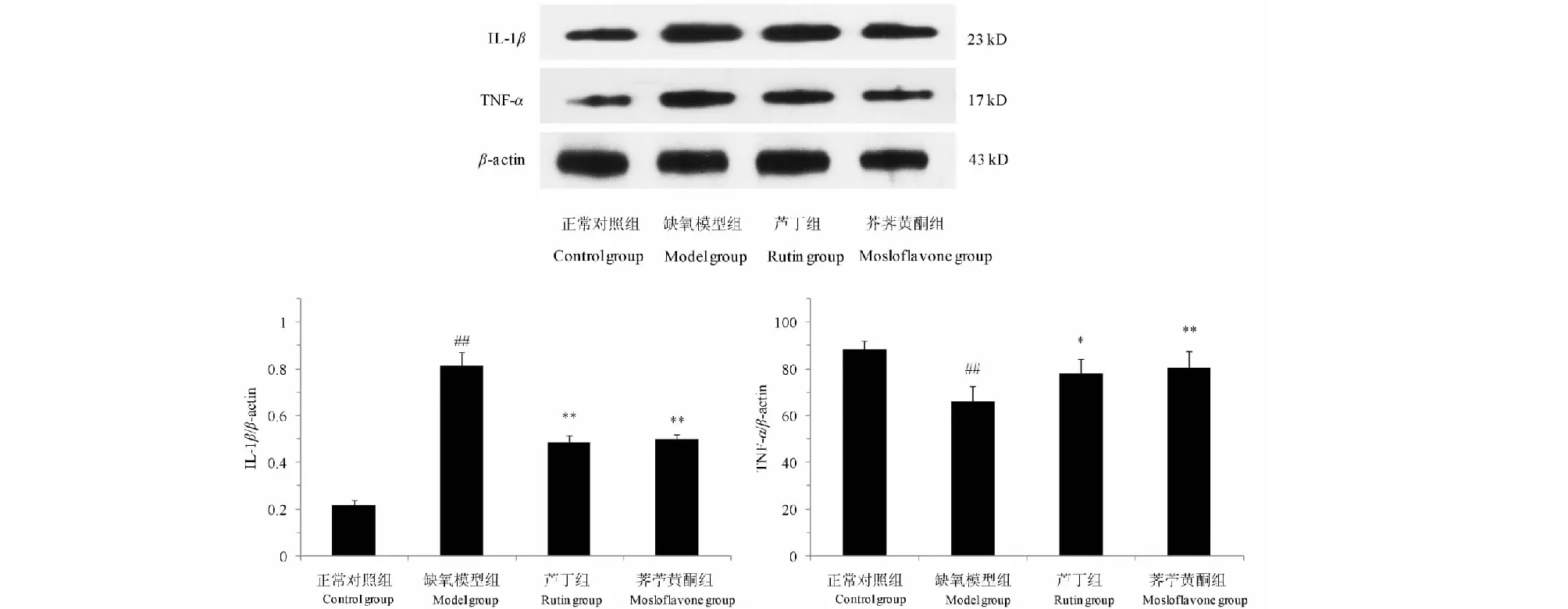
图6 荠苧黄酮对低压低氧小鼠脑组织中IL-1β和TNF-α蛋白表达的影响Fig.6 Effects of mosloflavone on the expression of IL-1β and TNF-α in mice brain after HH 注:与正常对照组相比,##P<0.01;与缺氧模型组相比,**P<0.01。 Note:##P<0.01 vs normal group;**P<0.01 vs model group.
4 讨论与结论
暴露于以低压低氧为特征的高原环境是一种极端的生理应激状态,对机体多个脏器都会造成有害影响。其中,大脑由于耗氧量巨大,是对高原缺氧最为敏感的器官之一。先前的研究指出,低压低氧诱发的氧化应激是导致脑组织损伤的因素之一[13]。体内外实验表明,低压低氧能够诱导细胞和组织中ROS的蓄积[10]。过量的ROS能够攻击脑组织中含量丰富的不饱和脂肪酸和生物大分子,诱发脂质过氧化,使MDA含量显著升高[3]。这与我们的实验结果相一致:缺氧模型组小鼠脑组织中ROS和MDA含量较正常对照组显著升高,而给予荠苧黄酮预处理能够显著降低脑组织中ROS和MDA的水平。以上结果说明荠苧黄酮可以显著抑制低压低氧诱导的氧化应激和脂质过氧化。
正常生理条件下,ROS不断生成并被体内的抗氧化酶和非酶抗氧化体系清除并维持在较低的水平。SOD、CAT和GSH-Px是细胞内重要的抗氧化酶。SOD将超氧阴离子转化为氧气和过氧化氢,CAT将过氧化氢转化为水和氧气,而GSH-px将脂质过氧化物还原为它们相应的醇类,并将游离的过氧化氢还原成水[14]。GSH是细胞内关键的非酶抗氧化剂,能够通过直接清除自由基从而保护生物大分子免受自由基的攻击,同时GSH-px还利用GSH作为电子供体,将其转化为谷胱甘肽二硫化物(GSSG),后者又被谷胱甘肽还原酶(GSSG-red)再生为GSH[15]。低压低氧诱导ROS大量产生的同时,还会破坏抗氧化体系,进而加剧氧化应激损伤[13]。在本研究中,急性低压低氧导致小鼠脑组织中GSH水平以及SOD、CAT和GSH-Px的活性显著降低,而荠苧黄酮能够提高GSH的含量,维持抗氧化酶的活性。同时研究还发现,急性低压低氧能够导致小鼠脑组织中SOD1和CAT蛋白表达显著下降,经荠苧黄酮预处理能够显著提高两个抗氧化蛋白的水平,改善脑组织的氧化应激失衡。
氧化应激和炎症是相互依存,相互关联的过程。一方面,炎性细胞在炎症部位释放大量的ROS,导致过度的氧化损伤。另一方面,许多ROS和氧化应激产物能够增强炎性反应[16]。近年来研究发现,炎症反应在高原缺氧损伤中具有非常重要的作用。Hartmann等[17]研究发现:健康志愿者在高海拔(>3 400 m)环境暴露三天,血液中IL-1和IL-6等炎症细胞因子水平显著升高。Song等[18]研究表明:人体内TNF-α、IL-1β和IL-6等促炎性因子水平与急性高山病(AMS)的症状呈正相关。这些促炎性因子能够诱导小胶质细胞活化,导致其它炎性介质的释放并导致炎症级联反应[19]。炎性介质可以通过刺激花生四烯酸的代谢使自由基释放增加,加重氧化应激损伤,通过增加水通道蛋白及其下游靶基因的表达,损伤脑微血管基膜、增加血管通透性、破坏血脑屏障进而造成血管原性脑水肿,加重脑组织损伤。我们的研究结果也显示:低压低氧小鼠脑组织中IL-1β、IL-6和TNF-α等促炎性因子水平显著增加,Western bolt实验进一步证明,低压低氧能够显著上调小鼠脑组织中TNF-α和IL-1β蛋白水平,给予荠苧黄酮预处理能够降低脑组织中促炎性因子含量,下调TNF-α和IL-1β蛋白水平。以上结果表明:荠苧黄酮对低压低氧诱导脑组织损伤的保护作用可能与其介导炎性因子的表达相关。
综上所述,荠苧黄酮对高原缺氧小鼠脑组织的保护作用机制与其清除过量自由基,缓解机体氧化应激,抑制炎性反应有关。

