基于网络药理学联合分子对接对逍遥散干预原发性肝癌的作用机制研究
商志浩,潘成镇,马月辉,谢卓容,韦紫怡,罗伟生,彭 岳,岑妍慧,2*
1广西中医药大学;2广西中医药大学第一附属医院,南宁 530000
原发性肝癌(HCC)是临床常见的消化系统恶性肿瘤,有流行广、起病缓慢、出现症状后疾病进展迅速、侵袭性强、病死率高[1]的特点。据统计,肝癌死亡率在恶性肿瘤城市死亡率中居于第二位,仅次于肺癌;农村居于第二位,仅次于胃癌。目前我国每年约有11万人死于肝癌,并且我国的肝癌发病率是全球最高,肝癌发病人数占全球的50%以上[2],对我国人民的身体健康造成严重威胁。肝癌可发生于任何年龄,其中以35~55岁最多,男女之比约为1∶1~4∶1。早期切除是疗效较好的治疗方法之一,但大多数肝癌患者确诊时已属晚期,多数已错过手术时机,所能采用的现代综合治疗方法常被限制在放化疗和免疫治疗上,而放化疗对本病的治疗毒副反应大,适应证少,疗效往往难以令人满意。目前,中西医结合治疗是本病的主要治疗手段之一。
逍遥散,中医方剂名。出自《太平惠民和剂局方》卷九。逍遥散为和解剂,具有疏肝解郁,养血健脾之功效,主治肝郁血虚脾弱证。目前,医疗工作者做了一定量的关于逍遥散治疗原发性肝癌及其并发症的临床研究,如Xiong等[3]选取了72例原发性肝癌患者,将其分成三组分别使用西药化疗加苦参注射液、西药单纯化疗、西药化疗加逍遥散加减进行治疗,结果用西药化疗加逍遥散治疗组相较于其他对照组取得了较好疗效,根据病人的各方面数据也显示逍遥散具有改善原发性肝癌患者的肝功能、生活质量、外周血白细胞等作用。但是由于逍遥散成分复杂多样,其治疗原发性肝癌的作用机制目前尚未有明确研究报道。
网络药理学是近年来新兴的的一门学科,融合了系统生物学、多向药理学、计算生物学、网络分析等多学科的技术和内容,将生物学网络与药物作用网络整合,探究疾病及药物的相互作用机理,与复杂疾病的治疗理念相吻合[4],已被广泛用于中药潜在活性成分和作用靶点的预测及中药作用机制的阐述。本研究基于网络药理学手段,结合文献调研、数据挖掘、统计推断、生物信息学等方法,构建逍遥散与原发性肝癌相互作用的药物与生物分子复杂关系网络,发掘药物作用靶点及药物与内源性蛋白及生物通路的作用关系,从而合理预测和科学推断有效物质成分的作用靶点及其调控的生物学过程和机制,力求更全面深入揭示逍遥散的药效物质基础和治疗原发性肝癌的疗效机制。
1 材料与方法
1.1 相关数据库
使用GEO数据库提取并分析得出HCC的差异基因;TCMSP数据库用于获取逍遥散中的有效成分及作用靶点;对应逍遥散与HCC的交集基因,综合BioGRID、BIND、MINT、HPRD、DIP、GRID数据库分析得出PPI蛋白互作网络;利用David数据库中的数据进行GO和KEGG富集分析;PDB数据库用于下载关键蛋白的3D结构。
1.2 基因芯片筛选
以“liver cancer normal”作为检索词,从GEO数据库筛选出同时含有肝癌组织和正常组织的人源基因芯片,并下载基因芯片的matrix文件,文件编号:GSE118916,以获取样本信息。
1.3 差异基因(DEGS)的筛选与处理
使用GEO2R在线分析工具,从基因芯片中筛选肝癌组织与正常组织的差异基因。并以adj.P.Val<0.05,2Ilog2(FC)I>1为条件,从中筛选出肝癌组织中较正常组织显著上调、下调的差异基因,借助MEV4.9.0(Multi Experiment Viewer)绘制基因聚类热图及火山图。
1.4 逍遥散的活性成分及靶点挖掘
中药系统药理学数据库和分析平台(TCMSP)是一个独特的中草药系统药理学平台,它能捕捉药物、靶标和疾病之间的关系,能够从整体层面研究药物靶标网络和疾病网络,揭示中药性质与作用机制[5-7]。从TCMSP在线平台(http://lsp.nwu.edu.cn/tcmsp.php)获取逍遥散(柴胡、当归、白芍、白术、茯苓、甘草)中各味中药的化学成分,根据口服生物利用度(OB)和类药性(DL)筛选出符合条件的候选活性成分及其对应靶点,将OB≥30%,DL≥0.18设为筛选条件[8]。借助美国国家生物技术信息中心数据库(NCBI)和Uniprot数据库,将物种限定为“人”,将靶点转换成对应的基因。
1.5 “中药化学成分-作用靶点”网络的构建和分析
将中药的预测靶点与HCC相关靶点取交集,所得交集靶点即为逍遥散作用于HCC的预测靶点。构建中药化学成分-作用靶点网络,通过Cytoscape3.7.2软件中的“Network Analyzer”功能对中药化学成分-作用靶点网络进行分析,节点(node)代表逍遥散中所含药物化学成分与潜在作用靶点;边(edge)展现了中药活性成分和其作用靶点之间的联系,根据活性成分与靶点连接情况筛选出逍遥散作用于HCC的关键成分。
1.6 蛋白互作网络构建和关键靶点筛选
蛋白质相互作用网络绘制主要借助Cytoscape3.7.2软件中的BisoGenet插件,其中BisoGenet由6种蛋白质相互作用关系数据库构成的,包括Biological General Repository for Interaction Datasets(BioGRID)、Biomolecular Interaction Network Database(BIND)、Molecular Interaction Database(MINT)、Human Protein Reference Database(HPRD)、Database of Interacting Proteins(DIP)和Biological General Repository for Interaction Datasets(GRID)。本研究将上述逍遥散的作用靶点和HCC相关的疾病靶点分别映射到蛋白质相互作用关系网络中,借助 BisoGenet 插件对2个蛋白质相互作用关系网络进行绘制,同时利用 cytoscape3.7.2合并2个蛋白质相互作用关系网络,并对交集网络进行抽取,抽取获得的交集网络即为逍遥散治疗HCC的直接和间接靶点调控网络。
结合相关文献,并借助自由度、紧密度、特征向量中心性、中心中介性、网络中心性和局部边连通性等指标,采用网络拓扑分析插件CytoNCA进行进一步的蛋白互作网络拓扑结构分析,筛选出边数大于250的网络节点,即“Big hubs”;然后筛选网络中介数中心度大于61的节点,即为蛋白互作网络中的关键基因[9]。上述获得的相关成分及靶点则有可能是直接、间接调控这些节点,发挥治疗HCC的作用。
1.7 GO基因功能富集分析
通过R语言中的“DOSE”、“clusterProfiler”、“enrichplot”R包对交集基因进行GO功能富集分析,进一步阐释中药活性成分的靶点蛋白在基因功能中的作用。
1.8 KEGG通路富集分析
通过R语言中的“clusterProfiler”、“org.Hs.eg.db”、“enrichplot”、“ggplot2”R包对交集基因进行KEGG功能富集分析,进一步阐释中药活性成分的靶点蛋白在通路功能中的作用。
1.9 逍遥散核心成分与关键靶基因的分子对接验证
先用ChemOffice软件构建活性成分的3D结构保存为mol2格式并使其能量最小化。从PDB数据(https://www.rcsb.org/)下载关键蛋白的3D结构PDB格式,运用PyMOL软件对蛋白质进行去水、加氢等操作,利用AutoDock软件将活性成分及靶蛋白格式转换为pdbqt格式,最后运行Vina进行对接。结合能小于0说明配体与受体可以自发结合,目前对于活性分子的靶点筛选尚无统一标准,这里通过对“药物—HCC”交集靶点与蛋白互作网络进行分析,筛选出两者共有且度值最高的两个蛋白分别与药物中与之作用的同样度值最高的两个分子进行分子对接验证。
2 结果
2.1 HCC相关差异基因表达分析
通过对GEO芯片数据库的基因芯片进行挖掘分析,获取HCC患者肝组织与正常人肝组织的基因表达谱中明显影响和改变的基因共580个,其中上调基因280个,下调基因413个。差图1,火山图见图2。

图1 HCC差异基因热图Fig.1 The thermogram of HCC differential gene
2.2 化合物有效活性成分筛选
以OB≥30%,DL≥0.18为条件,对TCMSP数据库进行检索,得到逍遥散中活性成分2 241个,其中来自柴胡的活性成分347个,来自当归的活性成分65个,来自白芍的活性成分118个,来自白术的活性成分22个,来自茯苓的活性成分29个,来自甘草的活性成分1 660个。
2.3 逍遥散有效活性成分—HCC网络构建及分析结果
将2 241个靶点与580个HCC差异基因取交集,得到27个交集基因,对应逍遥散中99个候选活性成分,其中对应甘草化合物77个,柴胡活性成分7个,茯苓活性成分4个,白术活性成分3个,白芍活性成分2个,混合活性成分6个。逍遥散有效活性成分见表1。借助软件 Cytocsape3.7.2构建中药活性成分—靶点基因相互作用网络,网络中有127个节点(逍遥散活性成分节点100个,靶基因节点27个)和183条边,见图3。图中度值最高的活性成分为槲皮素(quercetin),其次为山柰酚(kaempferol)、β-谷甾醇(beta-sitosterol)、豆甾醇(stigmasterol)、甘草查尔酮A(licochalcone A)等。这些度值较高的活性成分可能是逍遥散治疗HCC的关键活性成分。

表1 逍遥散干预HCC的有效分子成分
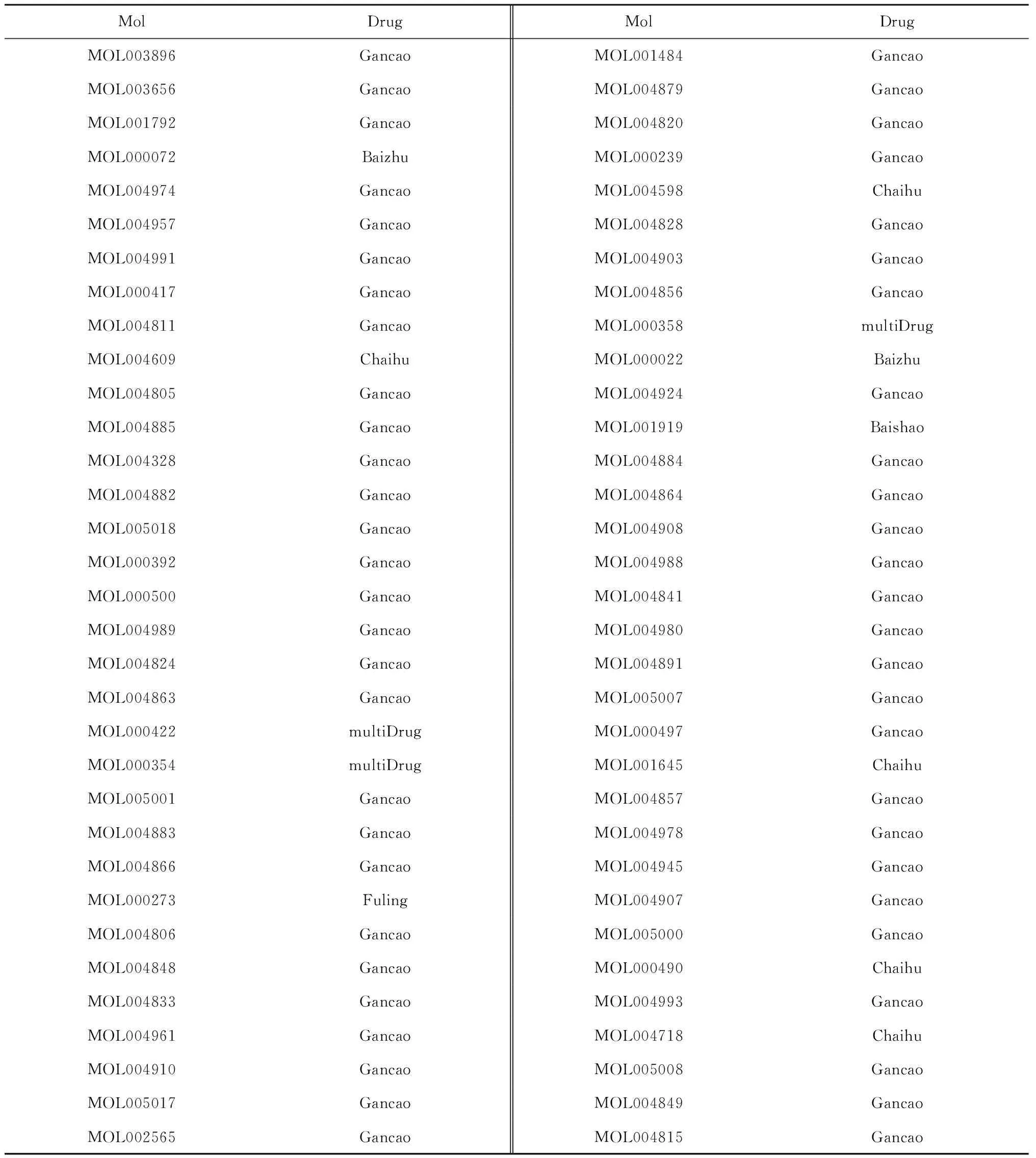
续表1(Continued Tab.1)

图3 逍遥散有效活性成分—靶点网络Fig.3 Xiaoyaosan compound-target network注:绿色椭圆:甘草活性成分;绿色椭圆:白芍活性成分;蓝色椭圆:柴胡活性成分;红色椭圆:白术活性成分;灰色椭圆:逍遥散复合物活性成分;黄色椭圆:茯苓活性成分;粉色三角:靶基因。Note:Green ellipse:Gancao compound;Light green ellipse:Baishao compound;Blue ellipse:Chaihu compound;Red ellipse:Baizhu compound;Gray ellipse:Xiaoyaosan complex compound;Yellow ellipse:Fuling compound;Pink Triangle:Target gene.
2.4 逍遥散治疗HCC的蛋白相互作用网络构建与关键靶点筛选
2.4.1 PPI蛋白互作网络构建
通过蛋白相互作用网络的构建,本研究发现逍遥散可以与1 375个靶点产生直接或间接作用,而这些靶点与靶点之间的相互联系多达24 942种。本研究利用蛋白质相互作用网络,进一步深入分析逍遥散影响HCC发生、发展中的靶点,绘制蛋白质相互作用靶点网络,为网络分析和机制的探讨提供了可能。
2.4.2 PPI蛋白互作网络关键靶点筛选
本研究使用Bisogenet插件,以DC≥61,BC≥250为条件,对逍遥散调控HCC的蛋白相互作用网络节点进行拓扑结构分析及关键靶点筛选,旨在寻找网络中关键节点,并在网络中获得更多节点的传递信息和更高的节点信息传递效率,充分发挥其在网络中重要的作用。通过网络拓扑分析,本研究共发现关键节点50个,见表2,筛选策略示意图见图4。

图4 逍遥散干预HCC核心靶点筛选策略示意图Fig.4 Schematic diagram of Xiaoyaosan’s selection strategy for interfering with HCC core targets
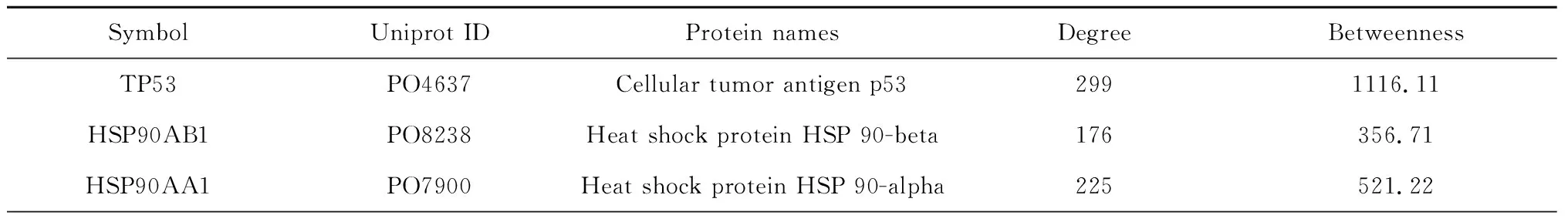
表2 PPI蛋白互作网络关键靶点

续表2(Continued Tab.2)

续表2(Continued Tab.2)
2.5 GO功能分析结果
27个逍遥散—HCC交集基因影响了271个生物学过程,选取P值排名20的功能信息,图5~7。图表显示逍遥散活性成分主要富集在无机物质细胞反应、细胞激素代谢过程金属离子反应、类固醇分解过程、伯醇代谢过程等生物过程中,在分子功能方面,主要涉及趋化因子活动、氧化还原酶活性、趋化因子受体结合等,细胞组成主要影响细胞周期蛋白复合物、蛋白激酶全酶复合物、丝氨酸/苏氨酸蛋白激酶复合物等。

图5 GO富集功能分析柱状图(CC富集结果)Fig.5 Histogram of GO enrichment function analysis(CC enrichment results)

图6 GO富集功能分析柱状图(BP富集结果)Fig.6 Histogram of GO enrichment function analysis(BP enrichment results)

图8 KEGG富集通路气泡图Fig.8 Bubble diagram of KEGG enrichment pathway注:圆点越大,富集基因数目越多;圆点颜色越红,P值越小;逍遥散治疗HCC的关键靶点参与的通路信息。Note:The larger the dot,the greater the number of enriched genes.The redder the dot,the smaller the P value;Pathway information on the involvement of key targets of Xiaoyaosan in the treatment of HCC.
2.6 KEGG富集通路分析结果
KEGG通路富集分析发现,27个交集靶点基因显著富集在17条通路上(P<0.05,FDR<0.01),见图8,其中最有意义的10条通路包括细胞衰老信号通路、甾类激素生物合成信号通路、p53信号通路、化学性致癌信号通路、IL-17信号通路、肿瘤坏死因子信号通路、视黄醇新陈代谢信号通路、药物代谢-细胞色素P450信号通路、代谢细胞色素P450的外源性物质信号通路、类风湿性关节炎信号通路,提示逍遥散通过作用以上多条通路来发挥治疗HCC的作用。
2.7 逍遥散核心成分作用于CYP1A2、PTGS2和CDK1的分子对接验证
对“逍遥散有效成分—靶点”调控网络分析可知,山奈酚、槲皮素与β-谷甾醇是逍遥散作用于HCC最为关键的核心成分,CYP1A2、PTGS2和CDK1不仅作为疾病的靶点,也同样出现在最终所得的PPI蛋白互作网络之中且度值较高。一般认为配体与受体结合的构象稳定时能量越低,发生的作用可能性越大。分子对接结果显示槲皮素与CYP1A2和PTGS2,β-谷甾醇与PTGS2和CDK1,山奈酚与PTGS2和CYP1A2的分子对接结合能均远远小于0 kJ/mol,由此表明二者之间具有较好的结合活性,结果见表3和图9~14。
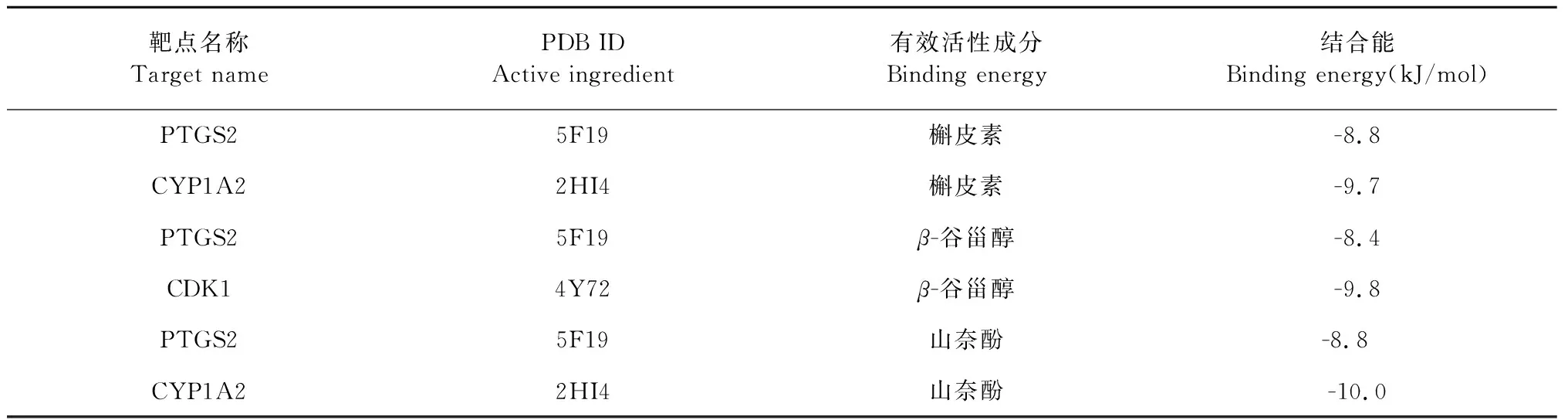
表3 逍遥散中部分核心活性成分与CYP3A4、PTGS2和CDK1的结合能

图9 槲皮素-PTGS2Fig.9 Quercetin-PTGS2

图10 β-谷甾醇-PTGS2Fig.10 β - sitosterol-PTGS2

图12 β-谷甾醇-CDK1Fig.12 β-Sitosterol-CDK1

图13 山奈酚-CYP1A2Fig.13 Kaempferol-CYP1A2

图14 山奈酚-PTGS2Fig.14 Kaempferol-PTGS2
3 讨论
网络药理学是通过分析大数据来进行药物研究的新模式。将网络药理学与传统的中医药有机结合,其整体性、系统性、动态性的特点与中医整体观念、辨证论治的理论相一致[10]。使用网络药理学方法研究中药复方的作用机制是当下药理学研究的一个热点[11]。逍遥散具有疏肝解郁,养血健脾,调和肝脾之功,是和解剂的代表方之一,临床中常用以治疗原发性肝癌。本研究借助网络药理学手段,初步挖掘、分析逍遥散在干预HCC中多成分、多靶点、多途径的治疗机制。
本研究分析了原发性肝癌与正常人相比其致癌的差异基因,得到明显影响和改变的基因共580个,其中上调基因280个,下调基因413个,并将此作为疾病干预的靶基因。接着系统分析了逍遥散6味中药(柴胡、白芍、甘草、白术、当归、茯苓)的有效成分,构建有效成分-靶点网络,分析化合物与靶点的相互作用关系。其中槲皮素、β-谷甾醇、山柰酚等是有效成分—靶点网络中的关键。槲皮素是甘草中的有效成分,β-谷甾醇是当归中的有效成分,山柰酚是甘草中的有效成分。已有研究表明,槲皮素具有良好的抑制细胞增殖,调控血管新生的作用,能够抑制体外培养的人脐静脉血管内皮细胞(EVC304)生长[12];具有抗肿瘤,抑制Eca109细胞的迁移、侵袭及血管新生[13],下调VEGF[14]的作用;同时还可以降低毛细血管脆性、扩张冠状动脉、增加冠脉血流量等。β-谷甾醇主要是抑制血管新生,其通过调节VEGF的表达,对H22荷瘤小鼠具有一定的抑瘤作用[15],还能够调节人肺癌A549细胞增殖及凋亡[16]。山柰酚是一种有抗炎、抗氧化作用的黄酮类化合物;具有明显的抗肿瘤作用,高摄入山柰酚可降低晚期大肠腺瘤的复发,体外实验表明山柰酚对小鼠黑色素瘤细胞B16具有增殖抑制作用[17];还能通过抑制铜离子诱导低密度脂蛋白氧化,成为氧化低密度脂蛋白,能降低单核巨噬细胞表面CD36蛋白的表达,阻止该细胞对氧化低密度脂蛋白的摄取,有效预防动脉粥样硬化。除此之外,化合物中的多个成分具有抑制血管生长、减低细胞侵袭力、下调VECF表达等抗肿瘤机制作用。
对逍遥散的靶点进行PPI映射并构建网络,对网络分析后发现了多个与多种复杂疾病紧密相关的关键靶点,如TP53、HSP90AB1、HSP90AA1、VCP、TOP2A、ITGA4、VCAM1、ESR1、HSPA8、MDM2等。研究将有效成分中的核心成分槲皮素、β-谷甾醇与关键靶基因进行了分子对接验证,证明了其具有良好的亲和力,进一步佐证了本次研究的科学性。为了说明作用靶点在基因功能和信号通路中的作用,本研究进行了 GO 功能富集和KEGG 通路富集分析。发现逍遥散能够调节细胞对无机物的反应、细胞激素代谢、细胞周期素依赖性蛋白激酶全酶复合物、趋化因子活性及受体结合、激素代谢等功能,大多数基因富集到了与癌症有直接或间接关系的通路上,包括甾体激素生物合成通路、P53信号通路、细胞衰老通路、化学致癌通路、IL-17信号通路、TNF信号通路、视黄醇代谢通路、药物代谢-细胞色素p450通路、孕酮介导的卵母细胞成熟通路等。已有研究表明P53信号通路能够调节细胞周期、活化凋亡信号转导,进而诱导细胞凋亡。其通路中的p53蛋白大量表达时,可以上调Bcl-2的表达水平、下调Bax的表达来共同完成细胞凋亡的调控[18]。Zhu等[19]发现TNF信号通路激活时可提高了人肝癌细胞株MHCC-97L中的VEGF及MMP9的表达,使得癌细胞的侵袭能力得到增强。据此,可以推断逍遥散可能通过抑制该通路来达到延缓HCC发生发展的目的。IL-17通路是一条与炎症反应相关的信号通路,近年来研究发现,IL-17在抗肿瘤治疗中同样发挥着重要作用。当IL-17通路被激活时,荷瘤小鼠体内的 MHCⅠ、MHCⅡ和LFA-1大量表达,同时促进了IFN-γ、IL-12的分泌、进而发挥CTL杀伤肿瘤细胞的作用[20]。
已有研究表明逍遥散能够抑制实体肿瘤的生长,并且对荷瘤造成的脾和胸腺指数具有一定的恢复作用[21];通过引起细胞内钙离子变化,诱导肝癌 SMMC-7721细胞凋亡[22];提高机体免疫功能和调节癌基因的表达[23];抑制MCF-7的细胞生长,诱导细胞自噬性死亡等[24]。但对于其所影响的具体蛋白,具体信号通路的研究尚少,根据本次研究分析结果可以推断其影响与肝癌直接或间接相关的蛋白及通路对肝癌组织进行抑制,从而达到一定的治疗目的。
综上所述,本研究应用网络药理学方法,初步探究了逍遥散多成分、多靶点、多通路的复杂机制过程,对进一步理解药物—靶点相互作用机制提供了重要信息,为后续从逍遥散中提取有效药物成分治疗HCC提供了依据,也对未来论证中医药基础理论的科学性提供了参考。

