大别山白及多糖酶法辅助提取及活性研究
朱富成,罗书岚,郑 宣,王 芳,何晓梅,邓 辉,韩邦兴
皖西学院 生物与制药工程学院 安徽省中药资源保护与利用工程实验室,六安 237012
大别山中药资源丰富,是野生中药材道地产区之一,但中药资源普查发现,部分野生中药如白及受全国药材市场影响,野生资源减少速度逐年增加,为加强保护,皖西学院对大别山野生白及进行保护和研究[1]。白及为兰科白及属(BletillaRchb. f.)植物白及Bletillastriata(Thunb. ex A. Murray) Rchb.f.的干燥块茎[2],研究表明白及块茎中含有大量天然水溶性多糖,即白及多糖,是白及的主要药效成分[3]。白及多糖在医药、化妆品及食品领域均有较广泛的应用,且具有无毒性、生物相容性等特征,使白及多糖备受关注[4],然而白及多糖的提取率不高,研究不够系统广泛,因此如何高效制备白及多糖是该领域急需解决的关键问题。
根据已有文献,目前已有多种新颖提取技术应用于白及多糖提取[5],如,超声辅助提取,微波辅助提取,超临界流体萃取以及红外辅助提取等方法,每种提取方法在提高提取率的同时也有各自的缺点,例如需要昂贵的精密设备,部分提取方法对多糖结构会造成不同程度影响甚至造成多糖降解[6]。因此,开发简便高效的提取方法对于白及多糖提取极为重要。生物酶(如纤维素酶、果胶酶等)作为高效催化剂,能作用于植物细胞,增加细胞通透性,促进胞内物质渗漏,研究表明生物酶辅助植物多糖提取可以促进提取率[7]。Xia等[8]利用淀粉酶水解提取枸杞多糖,提取率达到13.2%;Zhu等[9]利用复合酶制剂酶解灵芝提取多糖,提取率达到4.4%;Wang等[10]研究纤维素酶酶解荸荠多糖,提取率为32.3%。目前,利用酶法辅助白及多糖的提取仍然鲜有报道。果胶酶是一种高效生物催化剂,能专一性识别并作用于植物细胞壁中的果胶,增加细胞壁通透性。Song等[11]通过比较几种酶辅助提取荷莲叶多糖,发现果胶酶对于多糖的结构最具保护性。基于果胶酶的水解选择性高,作用专一,可以在保护多糖结构不受破坏的基础上增加细胞壁的通透性,进而提升多糖的提取率,故在白及多糖的提取研究中具有重要的意义。
本研究通过果胶酶预处理大别山白,结合传统水提方式提取白及多糖,运用响应面法优化果胶酶预处理,获得最优白及多糖提取工艺,并进而分析果胶酶辅助提取对多糖天然构象影响,研究其体外抗氧化活性。本研究为酶法辅助提取白及多糖奠定基础,同时研究结果对产业化应用具有重要参考意义。
1 材料仪器
1.1 材料与试剂
大别山白及(皖西学院植物园栽培);果胶酶(国药集团,活力单位50 U/g);葡萄糖;硫酸;苯酚;无水乙醇;邻苯三酚(焦性没食子酸);盐酸;邻二氮菲;三羟甲基氨基甲烷(Tris);1,1-二苯基-2-三硝基苯肼(DPPH);硫酸亚铁;双氧水;氯化钠;氯化钾;磷酸二氢钾;十二水磷酸氢二钠;均为市售国产分析纯。
1.2 仪器与设备
UV-5500型紫外可见分光光度计(上海元析仪器有限公司);SU8010发射场扫描电镜(日立有限公司);TU-1901紫外分光光度计(北京普析通用有限公司)。
2 方法
2.1 白及多糖提取
将白及于60 ℃烘干后打粉,并过30目筛,得到固体粉末用石油醚脱脂,并用10 mL/g的95%(V/V)乙醇回流两次去除寡糖,色素以及其他小分子化合物,经过离心过滤后得到产物进行真空干燥(40 ℃)获得预处理白及粉。称量一定量的白及粉,加入果胶酶于一定温度下预热一定时间,80 ℃下热浴10 min变性果胶酶终止酶解,然后热水浸提3 h,离心后取上清测定多糖得率,多糖得率采用苯酚-硫酸法测定[12]。
2.2 响应面法优化白及多糖提取工艺
设计单因素变量,保持其他条件不变,以果胶酶为酶制剂,分别考察酶解时间、酶解温度、酶添加量对白及多糖提取率的影响,每个因素平行测定3次,取平均值。
在单因素实验基础上,采用Box-Behnken[13]设计原理,以酶解时间(70、80、90 min)、酶解温度(40、50、60 ℃)、酶添加量(7.5%、10.0%、12.5%)为自变量组合,多糖提取率为响应值进行响应面优化实验,利用Design-Expert 8.0.6Trial软件对数据进行分析,得最优酶解提取工艺。
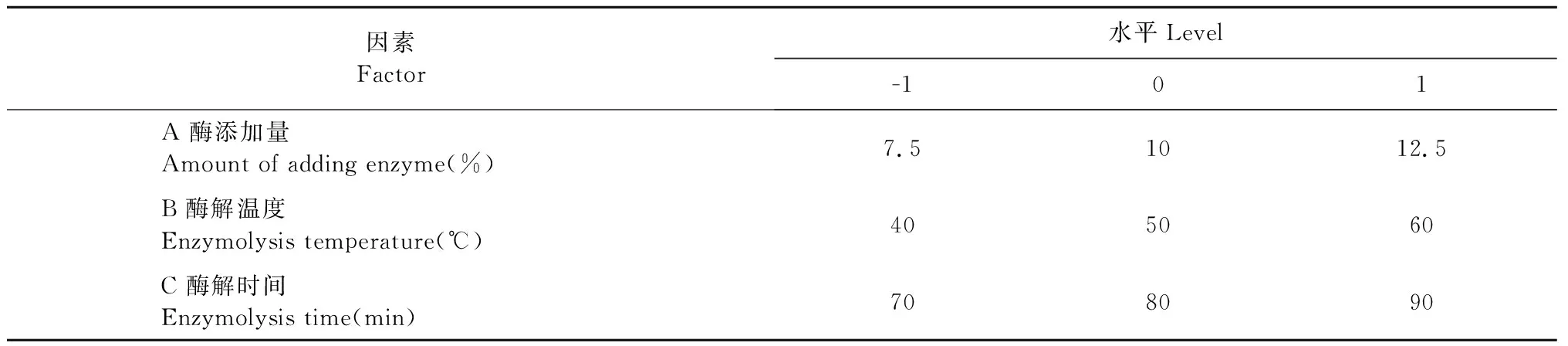
表1 响应面设计因素与水平
2.3 白及多糖纯化
将提取的白及多糖溶液进行真空浓缩至原体积的1/3,利用Sevag试剂(氯仿∶丁醇=4∶1,V/V)脱出蛋白[14],直到脱出后的液体在260 nm和280 nm处吸收值为0,表明核酸和蛋白已经脱完。然后加入无水乙醇至终浓度为80%(V/V),静置24 h,离心过滤获得多糖沉淀并保存。
2.4 白及多糖扫描电镜分析
参考已有文献[15],白及多糖提取液经过冷冻干燥后,利用发射场扫描电镜(HITACHI SU8010)分析白及多糖冻干粉的的纤维结构,将白及多糖冻干粉均匀铺展在试样架上,利用标度尺进行扫描观察,测定时的放大倍数为400倍,加速电位为5.0 kV。
2.5 白及多糖三级结构分析
根据已有文献报道方法[16],利用刚果红分析方法测定白及多糖构象结构。向2.0 mL的0.2 mg/mL的白及多糖溶液中加入2.0 mL的100 μmol/L刚果红溶液。向混合溶液中加入梯度的NaOH溶液(0~0.4 mol/L)。利用紫外分光光度计(普析通用TU-1901)对混合溶液进行扫描(250~600 nm),获得最大吸收峰。其中不含有白及多糖的刚果红溶液作为空白对照。
2.6 白及多糖体外抗氧化实验
2.6.1 羟基自由基清除能力测定
采用Fenton反应体系[17]测定白及多糖对羟自由基的清除能力。在20 mL试管中依次加入0.1 moL/L、pH7.4的磷酸盐缓冲液(PBS)2 mL、5 mmoL/L邻二氮菲1 mL、1 mmoL/L硫酸亚铁1 mL、白及多糖样品液1 mL、1 mL H2O2(1.0%,V/V),再用0.1 moL/LPBS定容至10 mL,混合溶液在37 ℃水浴中保温60 min后,于536 nm处测其吸光值A2。用1 mL蒸馏水代替1.0%的H2O2,于536 nm处测得吸光值为A1。用1 mL蒸馏水代替多糖样品液,于536 nm处测得吸光值为A0。用2 mL蒸馏水代替多糖样品液和H2O2为空白对照。经计算获得羟自由基清除率。
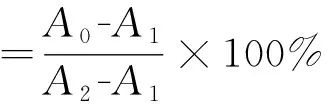
2.6.2 白及多糖对超氧阴离子清除能力测定
采用邻苯三酚自氧化法[18]测定白及多糖对超氧阴离子的清除率。在20 mL试管中,加入pH8.2、0.1 moL/L Tris-HCL 4.5 mL,再加入4.2 mL蒸馏水,混匀后于25 ℃水浴中保温20 min,加入预热的4 mmoL/L邻苯三酚0.3 mL,混匀后于325 nm处测定吸光值,每过20 s记录一次吸光值,共记录3 min,绘制邻苯三酚自氧化曲线,曲线斜率为A1。用相应体积的蒸馏水代替邻苯三酚为空白对照管。用1 mL不同浓度的白及多糖样品液依次代替1 mL蒸馏水,绘制曲线,曲线斜率为A0。经计算获得超氧阴离子清除率。
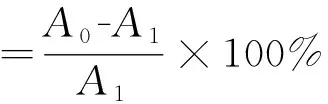
2.6.3 白及多糖对DPPH自由基清除能力测定
根据已有文献[19],分别取2 mL不同浓度的白及多糖样品液置于试管中,加入2 mL的DPPH(0.1 mmoL/L)溶液,混合均匀,室温避光反应30 min,取上清于517 nm处测定吸光值A1。同时测定2 mL乙醇代替2 mL样品的吸光值A2以及2 mL水代替2 mL DPPH的吸光值A0。按下式计算白及多糖对DPPH的清除率。
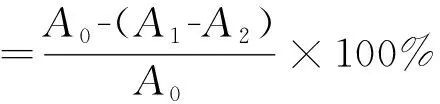
3 结果与分析
3.1 单因素对白及多糖提取率的影响
酶的添加量可以决定酶活力,因此对白及多糖的提取具有较大影响,大量的添加酶量可以促进提取率,但是将会增加提取成本,同时大量的酶蛋白存在也将会增加去除的难度,因此加酶量对白及多糖影响十分必要。如图1A所示,白及多糖提取率随果胶酶添加量增加而提高,在12.5%~20.0%之间提取率趋于稳定。因此,结合酶制剂的实际情况,为了把成本降到最低,选择酶添加量为7.5%、10.0%、12.5%三水平进行响应面实验。
温度对酶活力影响较大,因此分析温度对白及多糖酶法提取十分重要。如图1B所示,白及多糖提取率随温度的升高而提高,并在50 ℃时达到最大值,为62.3%。再升高温度,白及多糖提取率反而下降。这可能是由于温度过高,果胶酶发生失活,导致酶活性降低,从而提取率下降。综合考虑,选择酶解温度为40、50、60 ℃三水平进行响应面实验。
酶解时间对白及多糖提取率影响如图1C所示。白及多糖提取率随时间的增长而提高,并在80 min到达最大值,为63.0%。酶解时间再加长,白及多糖提取率反而下降,可能是提取时间过长,果胶酶微弱水解白及多糖,致使得率有所降低。综合考虑,选择酶解时间为70、80、90 min三水平进行响应面优化实验。
3.2 基于响应面优化白及多糖的提取
响应面法被广泛应用于实验数据的优化处理,该方法具有实验次数合理,实验数据可靠等优点,所以本研究根据单因素确定的最佳水平,以白及多糖提取率为响应值,做Box-Behnken响应曲面设计,如表2所示。利用Design Expert 8.0.6软件对表数据进行分析,得白及多糖提取率(Y)对酶添加量(A)、酶解温度(B)和酶解时间(C)的二次多项回归方程:Y=63.77+2.57A+0.92B+1.16C-0.020AB+0.20AC-0.080BC-2.01A2-2.12B2-3.40C2,各因素交互作用结果如图2所示。

图1 单因素对白及多糖提取率的影响Fig.1 The effect of single factor on extraction rate of BSP
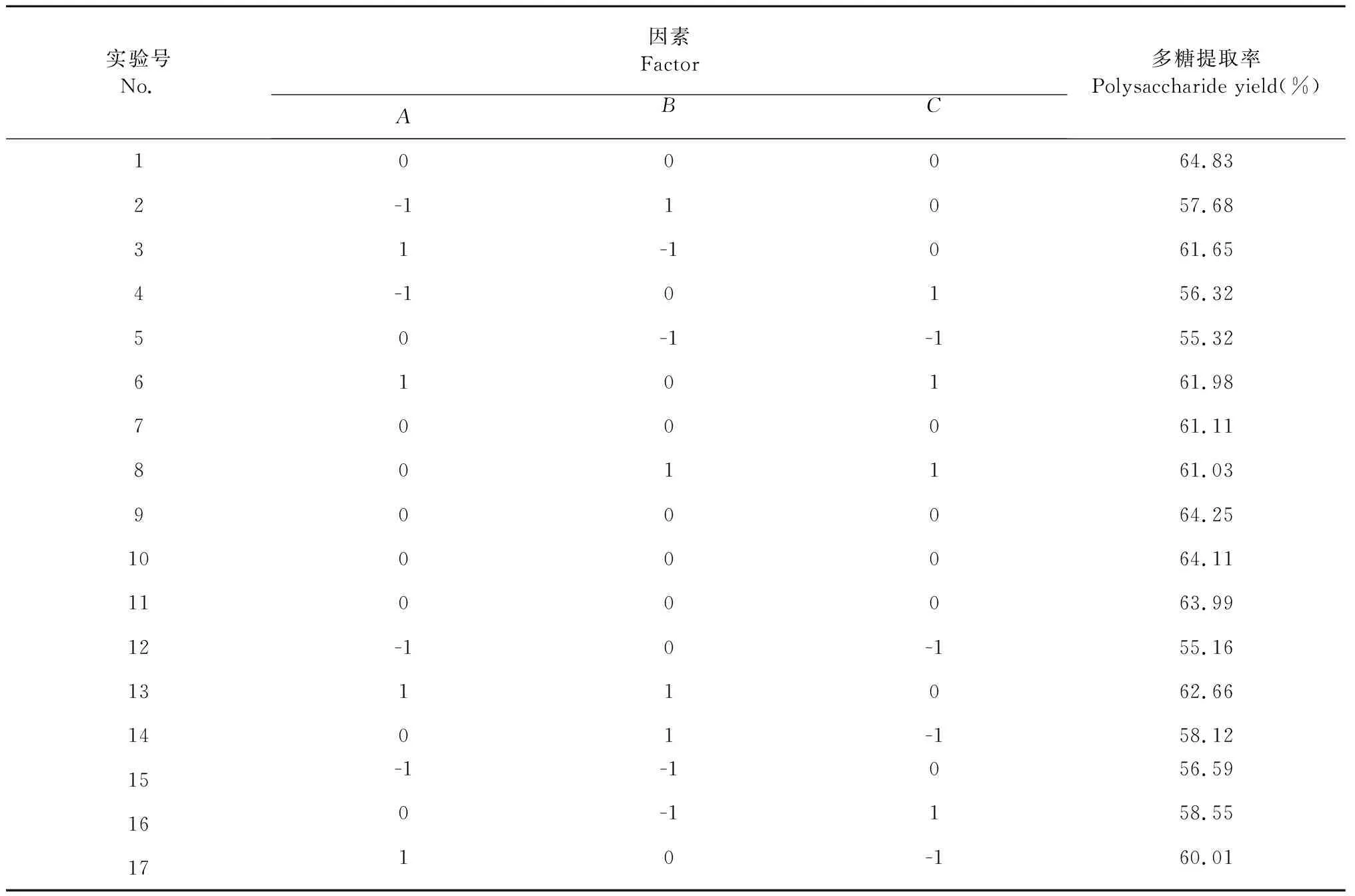
表2 响应曲面设计及多糖得率
对获得的相应曲面进行回归线性系数的显著性分析,如表3所示,影响因素A影响极显著;B和C影响显著,即酶添加量对酶法辅助提取白及多糖提取率有着极其显著的影响,酶解时间和酶解温度有着显著的影响关系,且影响显著顺序为A>C>B。二次项A2、B2、C2影响均为极显著;交互项中均影响不显著,这说明白及多糖提取率与各个因素之间不单单是线性关系。此外,试验整体模型的P= 0.000 7 < 0.01,表明模型达到极显著水平,失拟项的P=0.656 3>0.05,表明模型失拟不显著。R2= 0.953 3,说明该模型能解释95.33%的响应值的变化。由此可见,利用Design-Expert 8.06软件得到的二元多项回归方程及其显著性分析结果准确可靠,可以用此模型分析白及多糖酶提工艺结果。
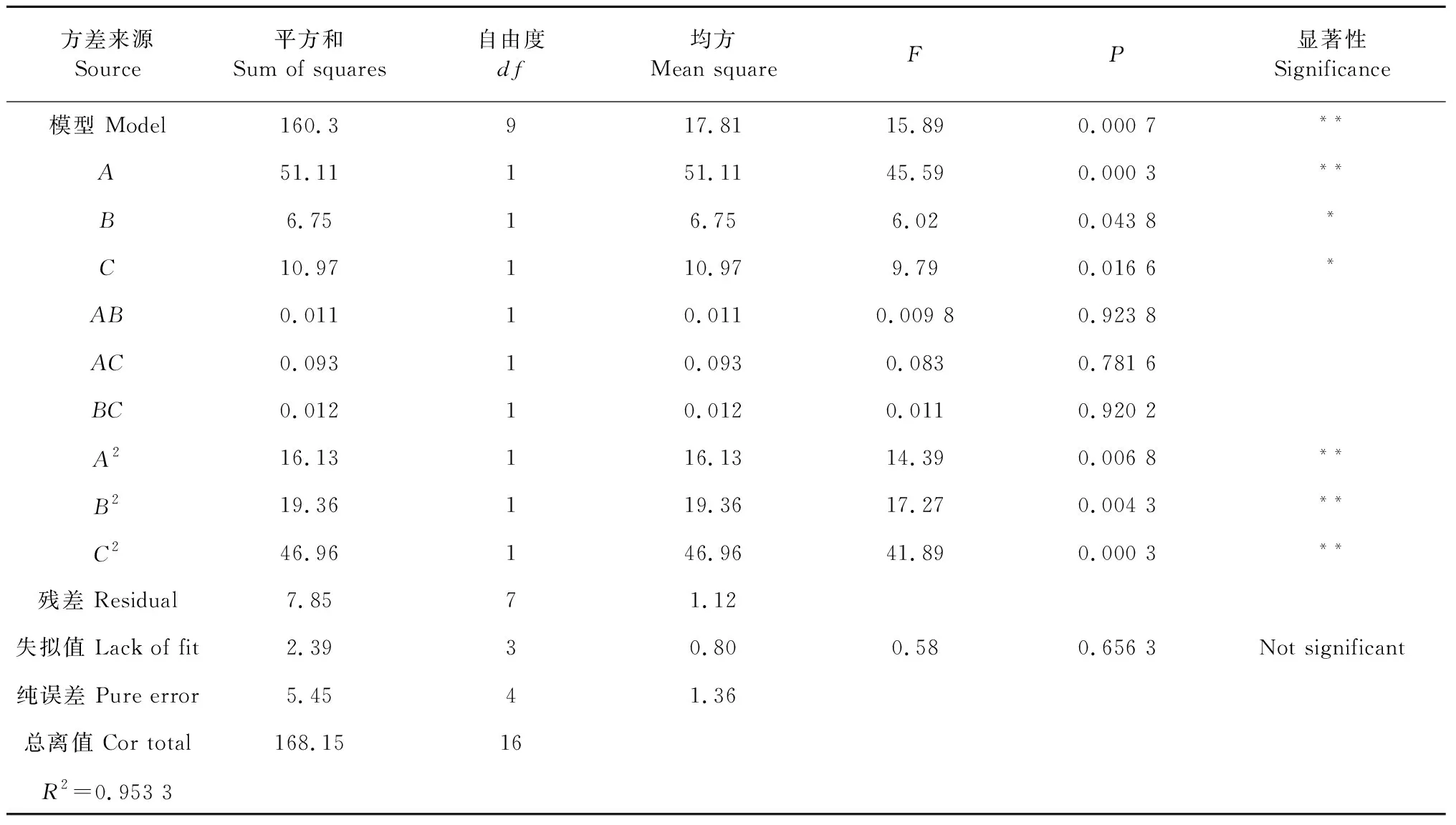
表3 显著性及方差分析
通过响应面法分析得到白及多糖酶提工艺的最优条件为:果胶酶添加量12.5%、酶解温度51.5 ℃、酶解时间81.8 min,但考虑到实际生产条件的操作,可将最佳条件修改为果胶酶添加量12%、酶解温度52 ℃、酶解时间82 min,在此工艺下,白及多糖提取率为64.8%。采用酶法提取获得的白及多糖提取率明显高于利用传统水提的效率[20]以及微波辅助提取白及多糖的效率[21]。本研究通过响应曲面优化酶法提取白及多糖的得率是目前已报道最高提取率,本方法的开发为白及多糖进一步开发利用及工业化生产提供了良好的依据。
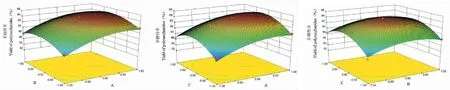
图2 响应曲面法优化优化白及多糖提取率Fig.2 The response surface method was used to optimize the polysaccharide extraction
3.3 白及多糖构象
考虑到果胶酶可能对白及多糖发生酶催化作用,破坏其天然构象,因此本研究进一步分析了提取的白及多糖的构象。刚果红试剂可以与多糖的三链螺旋结构形成复合物使得最大吸收值会发生红移,当三链螺旋发生解链变成单链时,刚果红-多糖复合物的最大吸收值会降低。分析多糖在不同浓度的NaOH溶液中的最大吸收值的变化将有助于分析多糖的构型[15]。如图3所示,含有白及多糖的刚果红溶液最大吸收波长比刚果红空白对照大,表明白及多糖可以使得吸收值发生红移,表明在498~487 nm波长下白及多糖三股螺旋与刚果红络合物形成。当NaOH浓度超过0.4 mol/L后,含有白及多糖的刚果红溶液最大吸收波长发生明显的蓝移,表明高浓度的NaOH导致白及多糖构象发生去折叠,由三股螺旋演变为单链。本研究中的构象分析结果与前人报道通过微波辅助白及多糖提取保持天然构象的结果一致[21],表明本研究中提取的白及多糖形成了三股螺旋的天然构象,说明本实验提取的白及多糖构象没有收到果胶酶破坏。
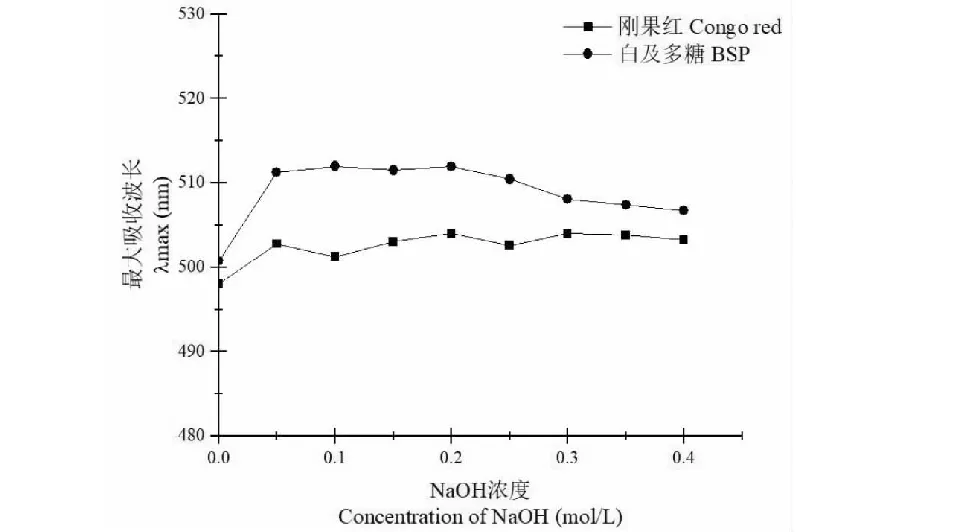
图3 白及多糖在不同浓度NaOH种构型转变分析Fig.3 Conformation transition analysis of BSP at different concentration of NaOH.
3.4 扫描电镜分析
如图4所示,本研究中提取的多糖微观结构在扫描电镜下呈现一定的孔状结构,与Qu等[21]报道的微波辅助法提取的多糖相比,电镜结构更为致密。这一结果进一步说明在酶法辅助提取中果胶酶没有破坏白及多糖;与微波辅助提取相比,酶法提取对白及多糖的保护性更好。

图4 白及多糖在扫描电镜下的微观结构Fig.4 SEM images of BSP micro-structure
3.5 白及多糖体外抗氧化研究
羟基自由基、DPPH以及超氧阴离子均是活性很强的自由基,可损伤体内多种蛋白质、核酸、脂质等生物大分子,对人体健康不利,因此,对这三种物质的清除可以有效表征其抗氧化活性[22]。本研究采用Fenton反应体系检测白及多糖对羟自由基的清除能力,结果如图5A。由图5A分析可知白及多糖对羟自由基有显著的清除能力,且表现出良好的剂量依赖关系,清除率随着白及多糖浓度的增加而升高,白及多糖浓度为15 mg/mL时,清除率为87.6%。本研究白及多糖对DPPH自由基的清除效果如图5B。分析图5B可知,白及多糖对DPPH有很强的清除作用,且在1~10 mg/mL的浓度范围内,白及多糖对DPPH的清除率随多糖浓度的升高而逐渐增强。当多糖浓度为10 mg/mL时,白及多糖对DPPH自由基的清除率为83.9%。实验采用邻苯三酚自氧化法测定白及多糖对超氧阴离子的清除能力,结果如图5C。由图分析可知白及多糖对超氧阴离子具有明显清除作用,且在白及多糖浓度为1~10 mg/mL时,表现出良好的剂量依赖关系,随着样品质量浓度升高其清除能力增强,当白及多糖浓度为10 mg/mL时,对超氧阴离子自由基清除率最大,为71.5%。实验表明本研究的白及多糖对羟自由基、DPPH及超氧阴离子的清除作用具有清除率高、效果稳定的特点。
部分研究报道表明白及多糖可以在较低多糖浓度下(如0.5 mg/mL)展现出较强的抗氧化活性[22],但本研究结果表明为本实验所提取白及多糖在10 mg/mL以上浓度时才可以表现出较强的体外抗氧化活性,该结果与Yang等[23]报道表现一致。
4 结论
现有文献对果胶酶辅助提取白及多糖工艺及其抗氧化活性研究鲜有报道。本研究采用果胶酶辅助法提取白及多糖,采用响应面分析法优化提取工艺。在最优条件下,白及多糖提取率达到64.8%,为目前最高报道量。通过对白及多糖空间构象分析及电镜观察表明果胶酶提取对白及多糖具有较好的保护作用。体外性质研究表明,白及多糖对羟自由基、超氧阴离子、DPPH自由基均有很强的清除能力。综上,本研究首次报道果胶酶辅助提取白及多糖的工艺优化及体外活性,本研究为白及多糖的工业化应用提供了良好的参考条件。
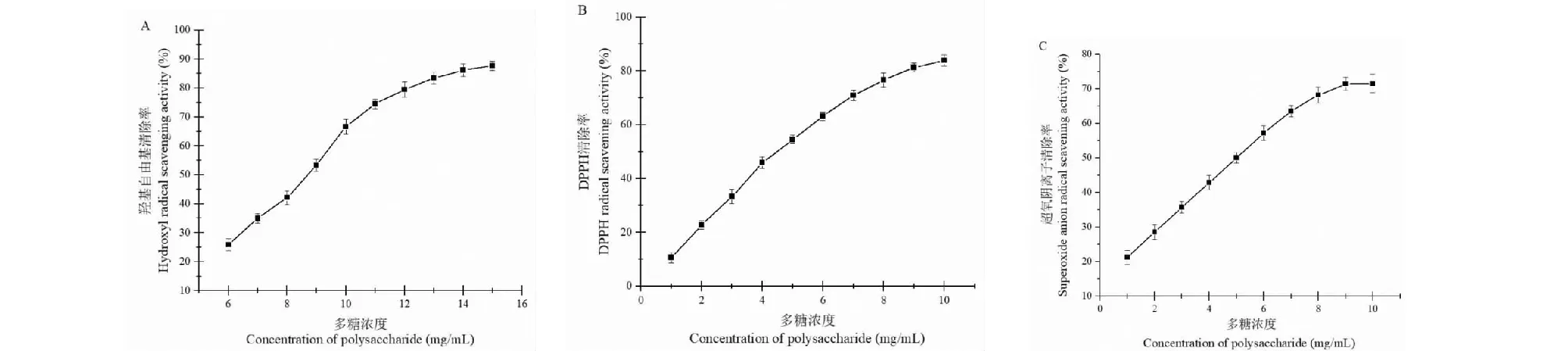
图5 不同浓度的白及多糖抗氧化性测定Fig.5 Resistance to oxidation analysis of different concentration of BSP

