松萝烟酰胺的合成及抗肿瘤活性研究
连文静,贺小琼,赵 庆,王宜挺,吴 怡,尤雨桐
(1) 昆明医科大学公共卫生学院,云南昆明 650500;2) 苏州药明康德新药开发有限公司,江苏苏州 215104;3) 云南中医药大学中药学院,云南昆明 650500;4) 中国科学院昆明植物研究所,云南昆明 650201;5) 昆明医科大学科研实验中心,云南昆明 650500)
松萝属于地衣门,松萝科植物,近几年松萝的药用价值引起了药物化学领域的关注[1-3],松萝胺[C18H17NO6,6-乙酰基-2-(1-氨基-亚乙基)-7,9-二羟基-8,9b-二甲基-9bH-二苯呋喃-1,3-二酮]是从松萝中提取的天然抗肿瘤活性物质,初步试验结果证明对神经胶质瘤、人鼻咽癌细胞等有较强的体外抗癌活性[4-5]。
从植物中寻找分离活性化合物的方法效率低、时间长,而对天然活性先导化合物进行结构修饰可解决植物资源短,分离困难的难题,同时也是改善活性化合物毒性,减少毒副作用的高效方法[6]。经过对先导化合物的结构修饰改造,合成具有抗癌抗菌活性的新型结构衍生物一直是科研工作者们研究的热点。
本次实验受姜黄素烟酸酯[7]及香豆素烟酸酯[8]合成的启发,选用具有促进代谢,调节血脂同时又可以作为药物合成中间体[9-12]的烟酸作为酰化剂,新型高效碱性亲核催化剂4-二甲氨基吡啶(4-Dimethylaminopyridine,DMAP) 作为催化剂,以 N,N'-二异丙基碳二酰亚胺 (N,Napos;-Diisopropylcarbodiimide,DIC) 作为脱水剂,通过酰化反应将烟酸连接到松萝胺分子结构中制备有抗癌活性的衍生物,以期得到性状优良的结构修饰产物,丰富抗癌候选药物种类。
1 材料与方法
1.1 人癌细胞株
人鼻咽癌细胞(CNE2)、人胶质瘤细胞(U-251)、人结肠癌细胞(HCT-116) 均由云南省肿瘤医院提供。
1.2 药物试剂与仪器
松萝胺(C18H17NO6) 由实验室合成,经HPLC 鉴定,其纯度大于99.8%。4-二甲氨基吡啶(DMAP) (九鼎化学科技有限公司),N,N-二异丙基碳二亚胺(DIC)、烟酸、二氯甲烷(分析纯,均购自上海麦克林生化科技有限公司)。注射用顺铂(齐鲁制药有限公司,生产批号:8C0174B02)胰蛋白酶、胎牛血清、磷酸盐缓冲液(均购自HyClone 公司)。
旋转蒸发仪RE-2000B(上海亚荣生化仪器厂),循环水真空泵SHZ-D(Ⅲ)(上海力辰邦西仪器科技有限公司),超声波清洗机SB-5200DTD(宁波新芝生物科技股份有限公司),Thermo Forma SeriesⅡ二氧化碳培养箱(美国Forma 公司),高效液相色谱仪L-2000(日本日立公司),紫外可见分光光度计U-3010(日本日立公司)。
1.3 方法
1.3.1 合成设计及原理 称取松萝胺343 mg,置于旋蒸瓶中,室温下加入约100 mL 的二氯甲烷溶剂,超声10 min 使松萝胺完全溶解。称量约246 mg 烟酸和约15 mg DMAP 加入旋蒸瓶中,边搅拌边加入约1 mL DIC,然后用锡箔纸密封,静置反应,每隔1 h 取样,用TLC 检测反应情况,当有反应产物出现且不再变化时,停止反应。加入约3 mL 蒸馏水搅拌约20 min,然后将反应溶剂蒸干,拌样上300~400 目硅胶柱,用石油醚:乙酸乙酯(3:1~1:1) 梯度洗脱,得到化合物N。合成设计线路见图1。
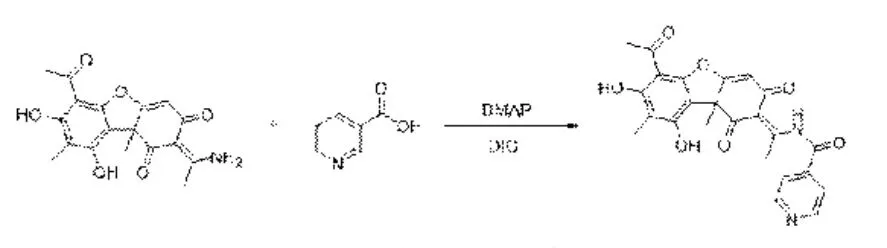
图1 合成设计线路Fig.1 Synthetic routes of compounds
1.3.2 体外抗肿瘤活性研究 采用MTT 法[13-15],将对数生长期的肿瘤细胞接种于96 孔板中,浓度为6 000 个/孔,顺铂作为阳性药物。24 h 后,弃去培养液加入含有不同药物浓度的完全培养液,置于细胞培养箱中培养72 h,弃去原细胞培养液,加入200 μL 含有10%MTT 的完全培养液,再继续培养4 h 后,弃去培养液,加入150 μL 二甲基亚砜,避光震摇10 min 后,置于酶标仪中检测吸光度(A),检测波长490 nm,计算对肿瘤细胞的抑制率。

实验分组:(1) 空白对照组:不接种癌细胞,其他处理同实验组;(2) 溶剂对照组:每1 mL 培养液中加入1 μL DMSO;(3) 阳性对照组:用PBS 将顺铂配制成2 μg/mL;(4) 药物处理组:松萝烟酰胺组浓度为0.625、1.250、2.500、5.000、10.000 μmol/L,松萝胺组浓度为0.625、1.250、2.500、5.000、10.000 μmol/L。
1.3.3 在不同溶剂中的溶解度测试[18-19]取适量的化合物N 用色谱甲醇稀释至适量浓度,用紫外分光光度计做全波长扫描,确定其最大吸光波长223 nm,配制浓度为2、4、6、8、10 μg/mL 松萝烟酰胺和松萝胺标准溶液,取3 mL 置于紫外分光光度计中检测,记录吸光度,以检测药物浓度(X,μg/mL) 为横坐标,吸光度值为纵坐标(Y) 绘制标准曲线。
松萝烟酰胺在甲醇、无水乙醇、75%乙醇、50%乙醇及正辛醇溶剂中的吸光度回归方程分别为:Y=0.109X-0.080 4,R2=0.998 4;Y=0.078 3X-0.028 9,R2=0.9988;Y=0.083 9X-2E-05,R2=0.999 6;Y=0.096 4X-0.007 4,R2=0.999 4;Y=0.071 4X-0.004 3,R2=0.999 1。
松萝胺在甲醇、无水乙醇、75%乙醇、50%乙醇及正辛醇溶剂中的吸光度回归方程分别为:Y=0.098X-0.022 3,R2=0.999 6;Y=0.088 6X-0.076 5,R2=0.998 6;Y=0.121X-0.056 7,R2=0.999 3;Y=0.095 7X-0.016,R2=0.999 8;Y=0.100 3X+0.027 6,R2=0.998 5。
带塞三角烧瓶中分别倒入约20 mL 甲醇、无水乙醇、75%乙醇、50%乙醇及正辛醇,分别加入过量的松萝胺和化合物N,每个样品平行三份。置于恒温摇床上震摇24 h,用0.22 μm 微孔滤膜过滤,取3 mL 置于紫外分光光度计中检测。
1.4 统计学处理
用统计软件进行数据分析,样本数据服从正态分布,采用单因素方差分析,数据结果用(±s)表示,P<0.05 为差异有统计学意义。
2 结果
2.1 化合物N 的波谱数据
化合物N 为淡黄色粉末,收率31.8%;1H NMR (500 MHz,CDCl3)δ12.12 (s,1H),11.97 (s,1H),9.40(s,1H),8.90(d,J=4.3 Hz,1H),8.56 (d,J=8.0 Hz,1H),7.59(dd,J=7.9,5.1 Hz,1H),7.06(d,J=15.1 Hz,1H),5.78 (s,1H),2.60 (s,3H),2.46 (s,3H),2.09(s,4H),1.73(s,4H)。
13C NMR(126 MHz,CDC13)δ197.96(C),194.17(C),190.20(C),175.41(C),173.64(C),163.91(C),156.25(C),155.31(C),152.59(CH),150.33(CH),148.83(C),139.13(CH),126.10(C),124.16(CH),116.42(C),113.15(C),108.65(C),102.79(CH),101.57(C),56.89(C),32.61(CH3),31.69(CH3),26.07(CH3),8.83(CH3)。
经专家鉴定得到化合物E) -N-(1-(6-乙酰基-7,9-二羟基-8,9b-二甲基-1,3-二氧代-3,9b-二氢二苯并[b,d]呋喃-2(1-H)-亚烷基)乙基)异烟酰胺,分子式为C24H20N2O7,分子量448;中文名为烟酰松萝胺,结构式见图2。
2.2 体外抗肿瘤活性测试
与阴性对照组相比,新化合物松萝烟酰胺在不同浓度下对CNE2、U251、HCT-116 肿瘤细胞均有不同程度的抑制,IC50 分别为(1.68±0.51)、(2.14±0.41)、(1.93±0.13) μmol/L。在三种测试细胞株中,对HCT-116 细胞的抑制作用最强。相同条件下松萝胺对三种肿瘤细胞的IC50 分别为(1.53±0.14)、(1.48±0.3)、(1.40±0.07)μmol/L。实验结果见表1、表2。
2.3 溶解度测试
松萝胺经酰化反应后得到的化合物松萝烟酰胺在正辛醇溶剂及75%乙醇溶剂中的溶解度提升,在甲醇及无水乙醇溶剂中的饱和溶解度下降,见表3。
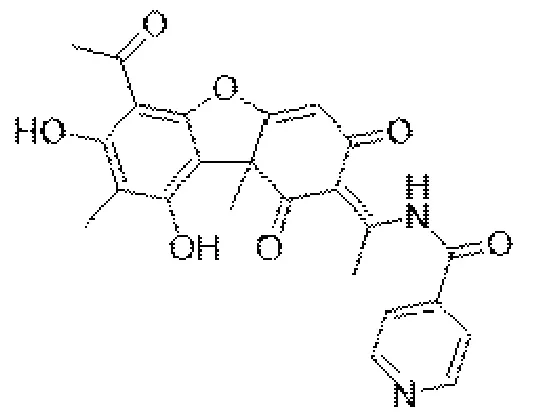
图2 化合物N 的结构图Fig.2 Structure diagram of compound N
表1 松萝烟酰胺对CNE2、U251、HCT-116 细胞作用72 h 的抑制率[(±s),n=3]Tab.1 Inhibition rate of usnea nicotinyl amine on CNE2,U251 and HCT-116 cells for 72 h[(±s),n=3]
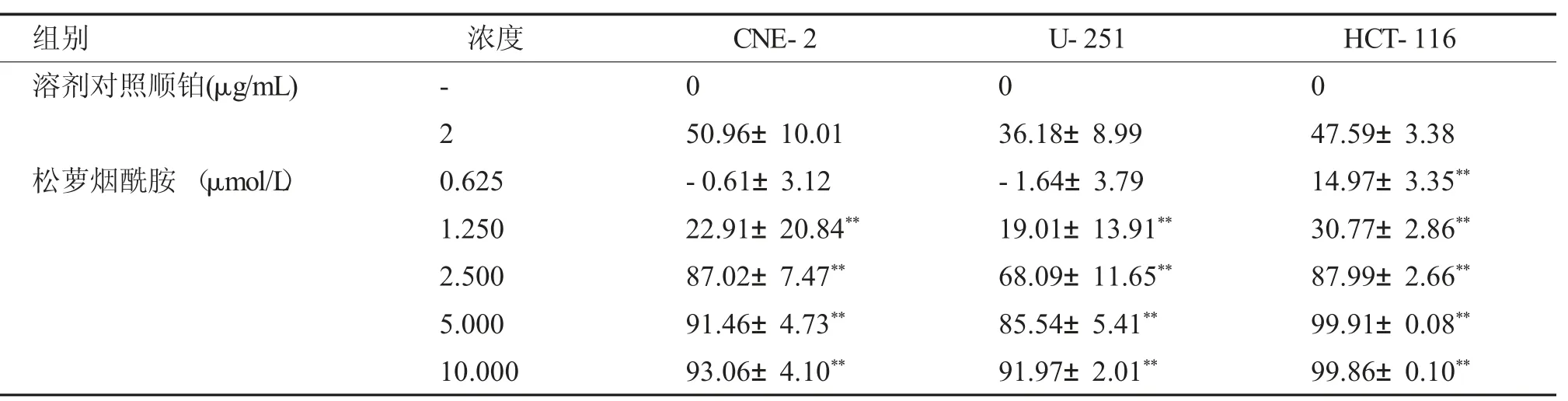
表1 松萝烟酰胺对CNE2、U251、HCT-116 细胞作用72 h 的抑制率[(±s),n=3]Tab.1 Inhibition rate of usnea nicotinyl amine on CNE2,U251 and HCT-116 cells for 72 h[(±s),n=3]
与溶剂对照组比较,**P <0.01。
表2 松萝胺对CNE2、U251、HCT-116 细胞作用72 h 的抑制率[(±s),n=3]Tab.2 Inhibition rate of usenamine on CNE2,U251 and HCT-116 cells for 72h[(±s),n=3]
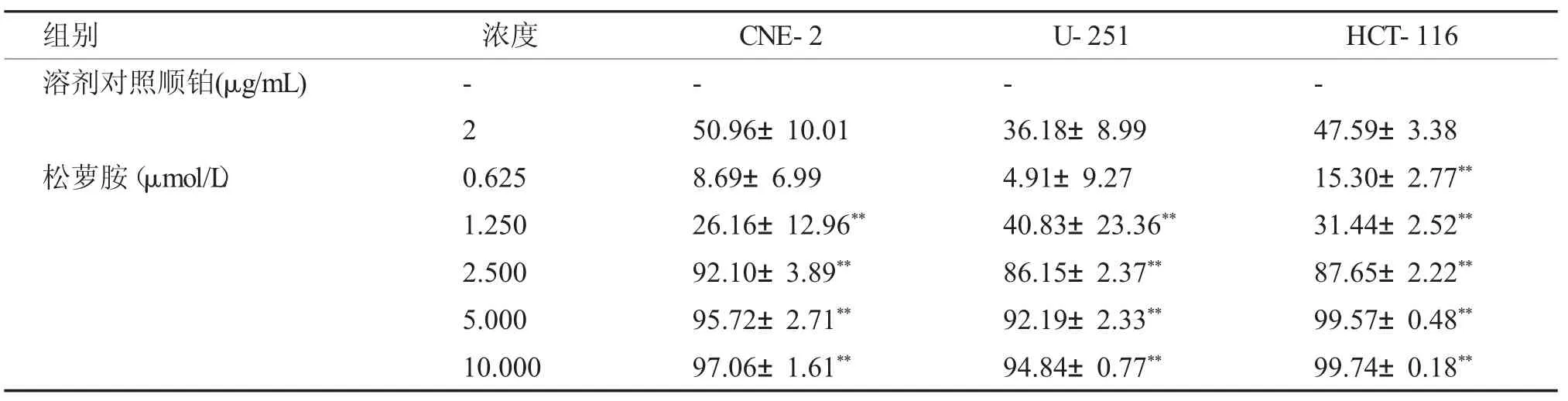
表2 松萝胺对CNE2、U251、HCT-116 细胞作用72 h 的抑制率[(±s),n=3]Tab.2 Inhibition rate of usenamine on CNE2,U251 and HCT-116 cells for 72h[(±s),n=3]
与溶剂对照组比较,**P <0.01。
表3 在不同溶剂中的饱和溶解度测试结果[(±s),n=3]Tab.3 Saturated solubility test results of two compounds in different solvents[(±s),n=3]
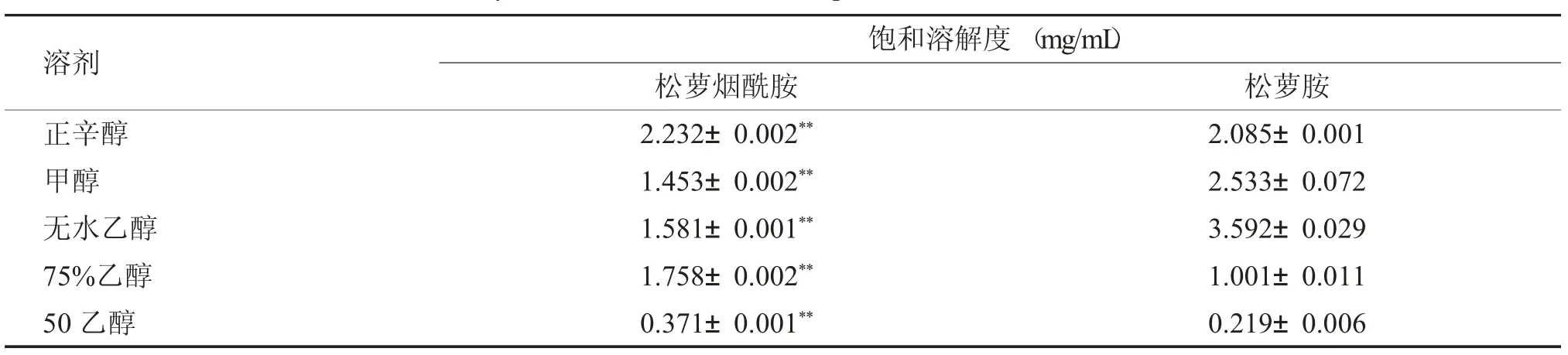
表3 在不同溶剂中的饱和溶解度测试结果[(±s),n=3]Tab.3 Saturated solubility test results of two compounds in different solvents[(±s),n=3]
与松萝胺比较,**P <0.01。
3 讨论
长松萝有抗炎、抗菌、抗氧化、抗辐射等作用,具有清热解毒、祛湿止痛、祛痰止咳、清肺热等功效[2,20-22],同时也是蒙药的常用药材[23],松萝胺作为长松萝的抗肿瘤活性成分被发现,本课题组近年来一直致力于松萝胺的研究,本次实验是首次对松萝胺的结构进行修饰,通过酰化反应将烟酸连接到松萝胺的氨基中,得到一个未见报道的化合物松萝烟酰胺。经过体外活性测试,结构修饰物松萝烟酰胺具有抗肿瘤活性,对人鼻咽癌细胞、人胶质瘤细胞、人结肠癌细胞有明显的增殖抑制作用。说明松萝胺的氨基可作为结构修饰的位点连接基团,其产物松萝烟酰胺仍具有抗癌活性,且在含水乙醇和正辛醇溶剂中的饱和溶解度提高。
在本次实验中采用高效催化剂DMAP,其催化效果显著优于无水吡啶,且用量少;DIC 作为脱水剂在反应过程中产生的副产物较少,容易水解去除。整个合成线路简单,反应条件温和,后处理及操作简单且容易控制,对松萝胺结构修饰及优良抗癌活性化合物的发现具有重要的参考意义。

