艾塞那肽对NAFLD 大鼠SREBP1、ACCα 及SCD1 表达的影响
梁蔚蔚,李晓波,李 燕,刘 华,武俊紫
(云南省第一人民医院老年医学科,云南昆明 650032)
近年来我国人民的生活水平日益提高,饮食结构和生活方式发生明显改变,肥胖、脂肪肝、2型糖尿病、代谢综合征等患者逐年增多。其中,非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD) 是世界范围内最常见的肝病,10 a 前即有报道NAFLD 与糖尿病、心血管疾病等密切相关[1-2],日益受到广泛重视。NAFLD 是指除外过量饮酒和其他明确的损肝因素所致的肝细胞内脂肪沉积。NAFLD 病变主体在肝小叶,以弥漫性肝细胞大泡性脂肪变性和脂肪贮积为病理特征的临床病理综合征。包括从单纯的肝脂肪变性(simple nonalcoholic fattyliver,NAFL) 到非酒精性脂肪性肝炎(nonalcoholicsteatohepatitis,NASH),以致一部分最终发展为肝硬化(Cirrhosis),甚至演变为肝细胞性肝癌(hepatocellularcarcinoma,HCC)。目前,NAFLD 在全球及亚洲人群患病率约为25%[3-4],我国的患病率为6%~27%[5]。然而,目前尚无确切治疗NAFLD 的药物,对NAFLD 治疗有效的药物是有限的。研究显示,维生素E 和胰岛素增敏剂噻唑烷二酮TZDs 吡格列酮可以改善NAFLD 肝酶水平及肝脏组织学表现,但两种药物均缺乏长期疗效和安全性[6-7]。国内研究显示,黄连素可治疗伴糖代谢异常的NAFLD 患者,降低肝脏脂肪含量,增加胰岛素敏感性,随机双盲对照试验尚在进行中[8]。
体重减少3%~5%可能会改善肝脏脂肪变性,但减少肝脏炎症需要更显著的体重下降(5%~10%体重)[6,9-10]。目前治疗NAFLD 最安全、有效的方法是改变生活方式、降低体重[11],然而有效率仅50%[9]。艾塞那肽作为GLP-1 的一种受体动剂,近年来发现其具有显著的减肥作用,能控制食欲、减少食物吸收,同时调节脂肪代谢,降低血糖而不引起低血糖反应[12-13]。本研究观察艾塞那肽治疗后NAFLD 大鼠肝脏病理、胰岛素抵抗、SREBP-1、ACCα 以及SCD1 表达的改变,探讨艾塞那肽对NAFLD 大鼠的治疗作用。
1 材料与方法
1.1 动物
昆明医科大学动物实验中心提供150 只实验用 SD 大鼠[(合格证号:SYXK (Yunnan)2011-0004],每只大鼠体重约为180~200 g。
1.2 动物模型的建立及分组给药
1.2.1 NAFLD 大鼠的模型建立 NAFLD 大鼠造模使用的灌胃100%高脂溶液的配方为:97%猪油(市场自购)、2%胆固醇、及1%胆酸钠。大鼠灌胃量为每100 g 大鼠体重予1 g 高脂溶液。每天早上7:00-9:00 灌胃,持续12 周。高脂饮食灌胃12 周后,HE 染色显示肝脏组织脂肪变性及血清肝功能的改变是评价大鼠造模成功的重要因子[14-15]。
1.2.2 分组和给药剂量 SD 大鼠灌胃造模成功后,100 只随机分为模型对照组(HFD)、艾塞那肽低剂量(ELD)、中剂量(EMD)、高剂量(EHD) 干预组,每天分别予艾塞那肽1 μg、2 μg、4 μg/kg(大鼠体重) 注射,多烯磷脂酰胆碱治疗组(PDC) 每天予PDC 46 mg/kg(大鼠体重) 注射。NAFLD 模型组及空白组(CON) 予普通生理盐水注射,以上各组均在大鼠颈部皮下注射。
1.2.3 实验药品和试剂 艾塞那肽购自Baxter Pharmaceutical Solutions LLC,多烯磷脂酰胆碱购自赛诺菲安万特制药有限公司,琼脂糖购自美国Invitrogen 生物公司;胰岛素试剂盒购自Bio-Swamp 公司,血糖试剂盒购自南京建成生物工程研究所;总RNA 提取试剂盒购自天根公司,多克隆抗体试剂盒购自美国Santa Cruz 公司,相应二抗购于中杉金桥公司;引物购自上海英俊生物科技有限公司。
1.3 收集标本
治疗4 周和8 周后使用3.6%的水合氯醛,按照每100 g 体重1 mL 麻醉大鼠,大鼠仰卧位固定后,沿剑突下斜行向上刺入2.5~3.0 cm 入心脏取血[16],离心后取上清液;并留取肝脏匀浆提取上清液,以上标本-86℃冰箱保存备用。
1.4 检测指标
1.4.1 病理 组织于4%的甲醛液中固定后切片、HE 染色观察大鼠肝脏病理学变化。
1.4.2 生化指标检测 血糖及肝功能指标测方法为酶法。胰岛素检测采用双抗体夹心法。

1.4.3 SREBP1、ACCα 及SCD1 mRNA 表达采用RT-PCR 检测 取肝脏组织提取总RNA,进行PCR 反应扩增。PCR 反应产物电泳完成后采集图像,计算各条带的荧光强度值,以β-actin 作为内参进行标准对照。每组重复试验3 次。
SERBP1 Primer:A:5'CGTTCGCCATAACCAAG TAGAG 3',B:5'GGCGATGCTGTACACTGTTGA 3',产物长度:126 bp;ACCαPrimer:A:5'AGCGCTA CCGTTCCTCTATCAA 3',B:5'GCTGTAAGAAGCGG ATGTAGTCG 3',产物长度:118 bp;SCD1 Primer:A:5'CATCGCCAACACCATGGCATT3',B:5'TCTGGAA CATCATCACCAGCTTCTC3',产物长度:186 bp;β-actin Primer:A:5'GTGACGAGGCCCAGAGCAAGA G-3',B:5'ACGCAGCTCATTGTAGAAGGTGTGG3',产物长度:123 bp。
1.4.4 Western blot 检 测SREBP1,ACCα,SCD1 蛋白表达 取肝脏组织匀浆测定蛋白含量,定量后电泳,切取目标蛋白,半干转法转移至PVDF 膜,5%脱脂牛奶封闭2 h 后加入多克隆一抗,4℃过夜,洗膜后加入辣根酶标记的二抗孵育,洗涤后与发光试剂反应,洗片后扫描图像,计算各条带的灰度值,以β-actin 作内参进行标准对照。每组重复试验3 次。
1.5 统计学处理
采用SPSS 进行数据分析,定量资料符合正态分布,以均数±标准差表示。多组间比较采用单因素方差分析,t检验进一步比较两组间差异,显著性检验标准P<0.05。
2 结果
2.1 艾塞那肽治疗后NAFLD 大鼠肝脏病理学改变
大鼠肝脏组织HE 染色显示:HFD 组表现细胞变性及脂肪颗粒沉积;艾塞那肽干预后4 周后,各干预组脂肪颗粒均明显减少,8 周时改变亦显著,见图1。
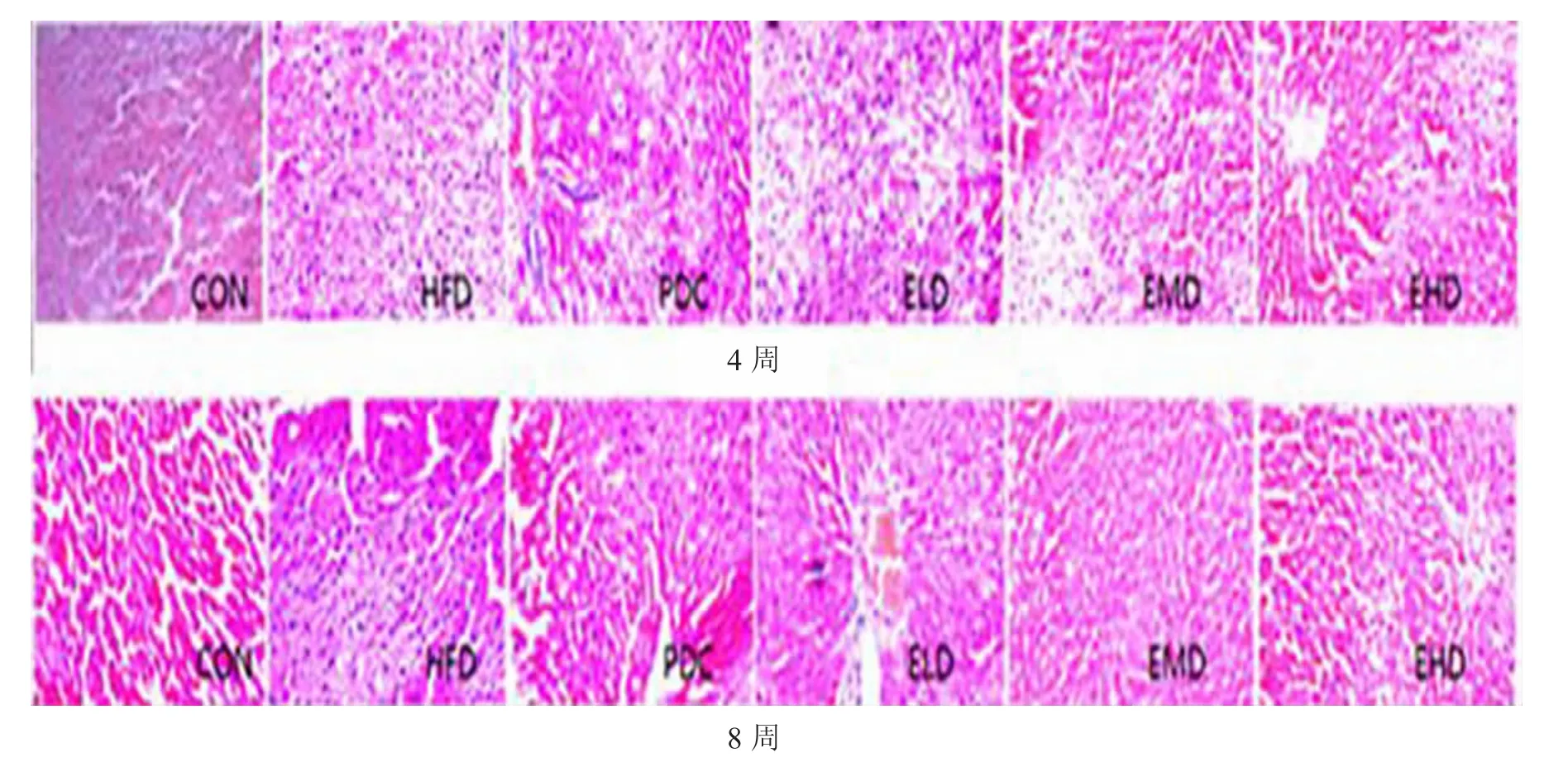
图1 肝脏HE 染色变化图(20×20)Fig.1 The pathological changes of liver by HE staining (20×20)
2.2 艾塞那肽治疗后NAFLD 大鼠肝功能改变
2.2.1 艾塞那肽治疗4 周、8 周后 艾塞那肽治疗NAFLD 大鼠4 周和8 周后,大鼠天门冬氨酸氨基转移酶(AST)、丙氨酸转移酶(ALT) 指标明显降低(P<0.05),见表1、表2。
2.2.2 胰岛素抵抗指数的变化 艾塞那肽治疗4周、8 周后,艾塞那肽三个治疗组胰岛素抵抗指数(insulin resistant index,IRI) 较HFD 组下降(P<0.05),见图2。
2.3 观察艾塞那肽使用前后对NAFLD 大鼠脂肪酸基因表达的影响
2.3.1 SREBP1,ACCα,SCD1 mRNA 表达治疗4 周、8 周后,SREBP1 及ACCαmRNA 表达逐渐下降,SCD1mRNA 表达明显增加(P<0.05),见图3、图4。
2.3.2 SREBP1,ACCα,SCD1 蛋白表达 治疗4 周、8 周后,SREBP1、ACCα 蛋白表达逐渐下降(P<0.05);SCD1 蛋白表达上升(P<0.05),见图5、图6。
表1 治疗4 周后大鼠肝功能比较[U/L,(±s)]Tab.1 Comparison of the liver function indicators after 4 weeks of treatment[U/L,(±s)]
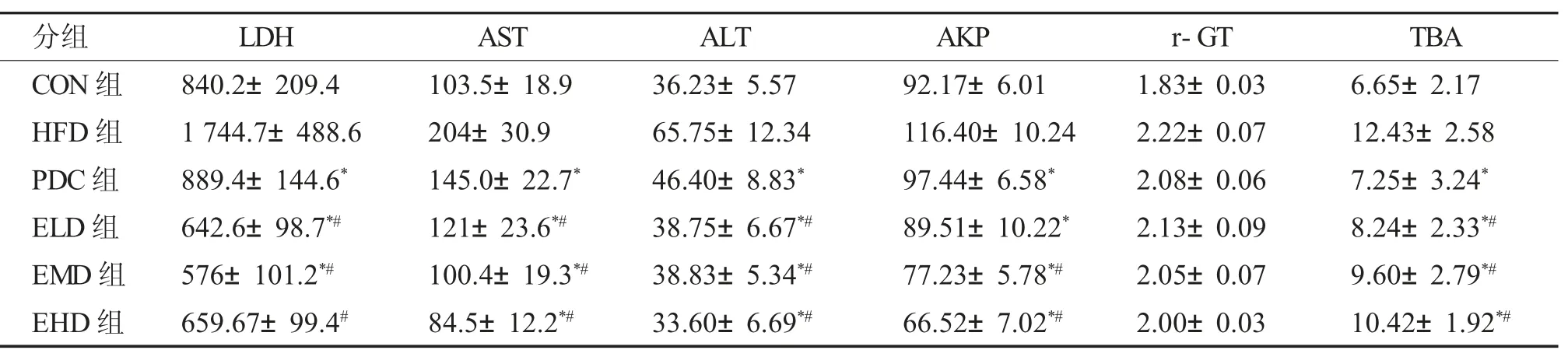
表1 治疗4 周后大鼠肝功能比较[U/L,(±s)]Tab.1 Comparison of the liver function indicators after 4 weeks of treatment[U/L,(±s)]
与HFD 组比较,*P <0.05;与PDC 组比较,#P <0.05。
表2 治疗8 周后大鼠肝功能比较[U/L,(±s)]Tab.2 Comparison of the liver function indicators after 8 weeks of treatment[U/L,(±s)]
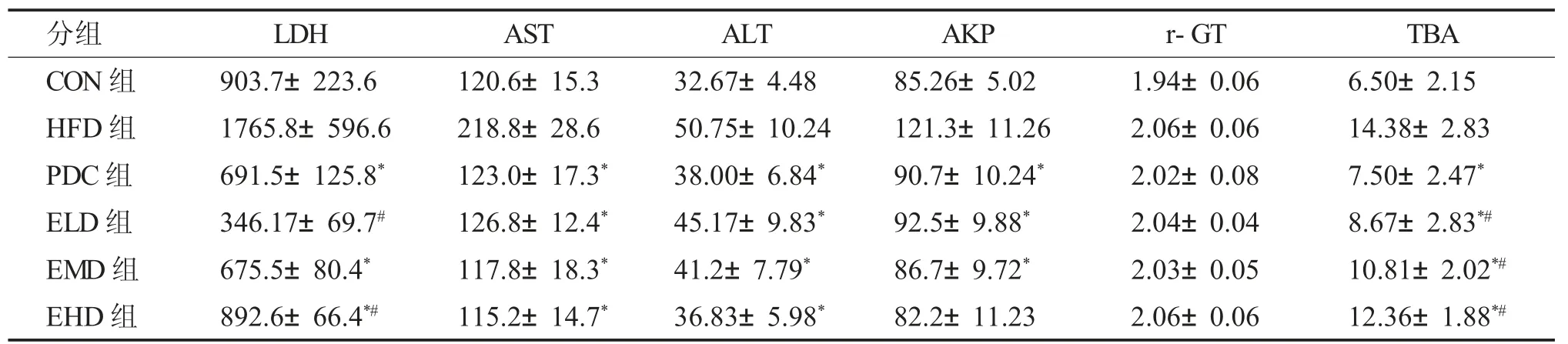
表2 治疗8 周后大鼠肝功能比较[U/L,(±s)]Tab.2 Comparison of the liver function indicators after 8 weeks of treatment[U/L,(±s)]
与HFD 组比较,*P <0.05;与PDC 组比较,#P <0.05。

图2 胰岛素抵抗指数比较Fig.2 Comparison of the insulin resistance index
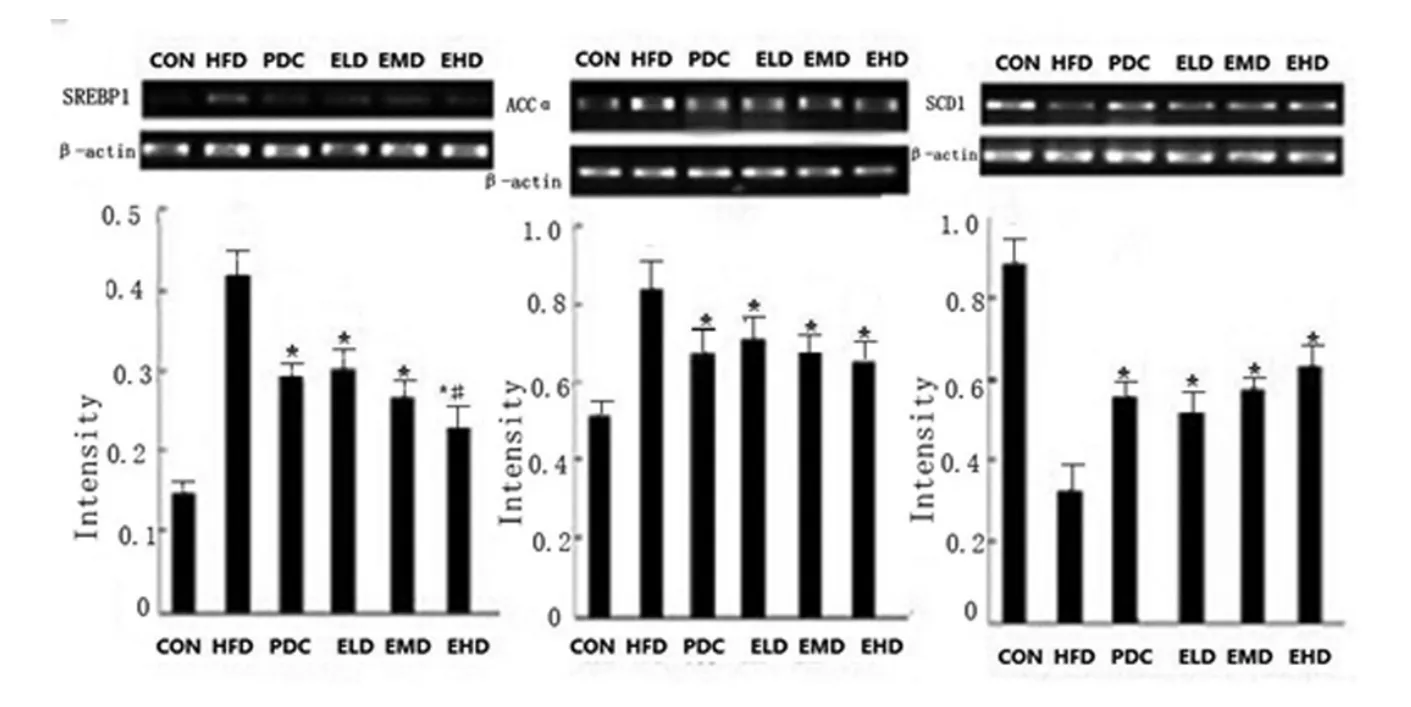
图3 治疗4 周后大鼠SREBP-1,ACCα 及SCD1 mRNA 表达Fig.3 SREBF-1c,ACCα and SCD1 mRNA expression in livers of rats after 4weeks of treatment
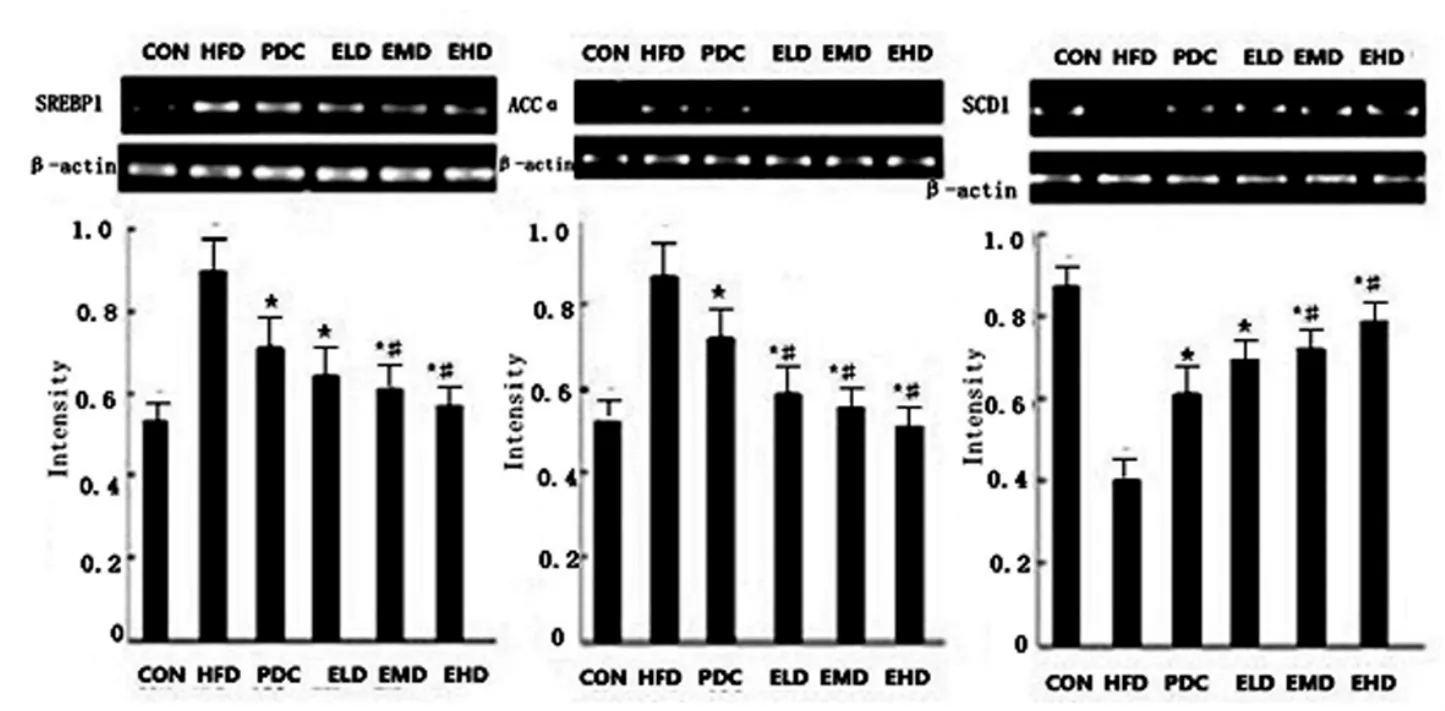
图4 治疗8 周后大鼠SREBP-1,ACCα 及SCD1 mRNA 表达Fig.4 SREBF-1c,ACCα and SCD1 mRNA expression in livers of rats after 4weeks of treatment
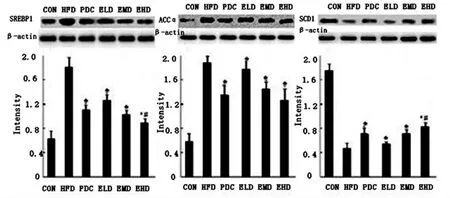
图5 治疗4 周后大鼠SREBP-1,ACCα 及SCD1 蛋白表达Fig.5 SREBF-1c,ACCα and SCD1 protein expression in livers of rats after 4 weeks of treatment
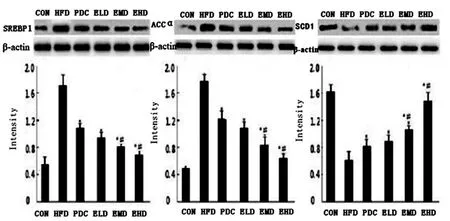
图6 治疗8 周后大鼠SREBP-1,ACCα 及SCD1 蛋白表达Fig.6 SREBF-1c,ACCα and SCD1 protein expression in livers of rats after 8weeks of treatment
3 讨论
非酒精性脂肪性肝病(NAFLD) 是一种与胰岛素抵抗(insulin resistance,IR) 和遗传易感密切相关的代谢应激性肝损伤,包括一系列的严重程度,从简单的脂肪变性到更高级的形式,非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)[17-18]。NASH 发生在30%的NAFLD 患者中,它显著增加了肝硬化的风险[19]。据预测NAFLD 将成为肝细胞癌的主要危险因素。大量临床证据表明,NAFLD与心血管疾病、慢性肾脏病和2 型糖尿病独立相关[20]。
目前公认NAFLD 病因研究是1998 年Day[21]提出的二次打击学说。第一次打击主要是指肝脏细胞内的脂肪颗粒过量积累,而胰岛素抵抗可能贯穿于NAFLD 发病的全过程,是NAFLD 第一次打击的始动及中心环节。固醇调节元件结合蛋白l(sterolregulatoryelement-bindingprotein-l,SREBP-l)作为脂肪生成转录的关键因子,其通过参与脂肪酸和甘油三酯合成基因的活化来调节脂肪生成的过程[22]。SREBP1 介导脂肪生成相关甘油三酯合成和积累的表达[23-24],SREBP1 可导致肝脏中过多的甘油三酯积聚,从而导致NAFLD 的发生[25]。
乙酰辅酶A 羧化酶α(acetyl-CoA carboxylase alphα,ACCα) 在脂肪酸碳链延长酶系的作用下合成长链脂肪酸,促进脂肪变性,造成脂肪颗粒在肝脏聚集,从而导致了NAFLD 发生[26]。硬脂酰辅酶A 去饱和酶1(stearoyl-CoA desaturase1,SCD-1) 是合成单不饱和脂肪酸的关键调节酶,参与脂肪肝的发病过程。胰岛素抵抗时,SREBP-1过量表达,而SREBP-1 除可以控制脂肪代谢外,也是肝脏中所分泌调节脂肪代谢酶ACCα 和SCD-1 的调节酶,SREBP-1 的表达升高,会造成肝脏中ACCα 酶的过量表达,促使SCD1 酶表达降低,三个蛋白相互作用,相互影响,导致肝脏脂肪代谢障碍,最终造成非酒精性脂肪肝的发生和发展[27]。而加剧脂肪肝进一步发展的重要因素是氧化应激与脂质过氧化损伤[28]。当肝细胞内脂质过度堆积到一定程度时,会导致脂质过氧化,加速肝细胞损伤,最终发生肝纤维化和肝细胞死亡。本研究对艾塞那肽治疗NAFLD 大鼠的作用进行探讨,结果显示艾塞那肽治疗NAFLD 大鼠4 周及8周后:PDC、ELD、EMD 以及EHD 四个干预组脂肪颗粒均明显减少、肝功能指标明显下降,提示艾塞那肽可以明显改善NAFLD 大鼠肝脏的病理状态及肝功能;艾塞那肽三个治疗组胰岛素抵抗指数较HFD 组下降明显(P<0.05),PDC 组不明显,提示艾塞那肽可改善胰岛素抵抗,而PDC 对改善胰岛素抵抗不明显;艾塞那肽治疗后NAFLD 大鼠的SREBP1 及ACCαmRNA 表达逐渐下降(P<0.05),SCD1mRNA 表达明显增加(P<0.05),SCD1mRNA 表达在ELD、EMD、EHD 组呈逐步增加的趋势,SREBP1mRNA 以及ACCαmRNA 则呈逐步降低的趋势;SREBP1、ACCα 蛋白表达逐渐下降(P<0.05),SCD1 蛋白表达上升(P<0.05)。提示艾塞那肽和PDC 增加SCD1mRNA 和蛋白的表达,降低SREBP1 以及ACCα mRNA 和蛋白的表达,且与艾塞那肽剂量相关。说明艾塞那肽和PDC 能增加SCD1 酶的活性,降低SREBP1 和ACCα 酶活性。
综上所述,艾塞那肽可以通过降低NAFLD 大鼠SREBP1 以及ACCα 表达,升高SCD1 表达,降低胰岛素抵抗,抑制脂肪变性发生和脂肪颗粒在肝脏内的聚集,可能对NAFLD 大鼠有一定的治疗作用,给临床上寻找治疗NAFLD 的有效药物提供了一条新的思路。

