低氧微环境对脑胶质瘤细胞增殖、凋亡及HIF-1α 表达的影响
余朝军,赵迁浩,赵宁辉
(1) 江油市九〇三医院神经外科,四川江油 621700;2) 昆明医科大学第二附属医院神经外科二病区功能神经外科,云南昆明 650101;3) 昆明市儿童医院神经外科,云南昆明 650034)
肿瘤的恶性增殖使其组织内耗氧及血管形成不全,导致微环境含氧量不足,使肿瘤各区域处于不同低氧微环境中,研究已发现包括神经胶质瘤在内的大多实体肿瘤均存在着广泛的缺氧区域[1]。并且随着神经胶质瘤恶性程度的增加瘤内的氧分压逐渐降低,研究发现在许多高级别的神经胶质瘤中存在着明显的缺氧区域,其生长的局部氧含量甚至低于1%[2]。缺氧微环境也与神经胶质瘤细胞的增殖、凋亡、侵袭、迁移、血管生成和耐药性密切相关[3]。低氧诱导因子-1α(HIF-1α) 在机体及细胞水平上调节低氧适应性反应和糖酵解速率,是肿瘤细胞适应低氧生存增殖的关键因素[4]。本研究通过三气培养箱模拟神经胶质瘤细胞的低氧微环境,观察处于缺氧环境的人脑胶质瘤细胞株T98G 随时间变化的生长情况,以及细胞不同生长时间及密度对HIF-1α 表达的影响。
1 材料与方法
1.1 细胞培养及实验分组
将人脑胶质瘤细胞株T98G(购于中国科学院昆明动物研究所),用基础培养基(DMEM/高糖+10%FBS+1%P/S) 培养,设为常氧组(21%O2)和低氧组(1%O2)。以不同密度将低氧组细胞分为低密度组(1 万个/cm2),中密度组(4.3 万个/cm2),高密度组(8.5 万个/cm2) 和极高密度组(12.5 万个/cm2),于CO2培养箱及三气培养箱中以相应氧浓度及培养基中分别培养24、48、72、96及120 h 后检测细胞存活与增殖。
1.2 MTT 实验检测细胞存活及增殖
取对数生长期的T98G 细胞,设置常氧组(21%O2)、低氧组(1%O2) 及调零组,以每孔3 000 个细胞/200 μL 的密度铺于96 孔板,按分组分别培养24、48、72、96、120 h 后进行加入20 μL 0.5 mg/mL MTT 溶液进行增殖检测。在酶标仪上于492 nm 波长处读取吸光度值(A 值),以培养时间为横坐标,吸光度值为纵坐标,绘制细胞生长曲线,实验重复3 次。
1.3 Hoechst 染色凋亡检测
根据实验分组,以每孔0.8×105细胞密度接种到6 孔板中,达到处理时间后消化细胞,清洗后以1 mL 4%PFA 重悬、固定细胞,避光下向每孔加1 mL 终浓度为10 μg/mL 的Hoechst33342 染液后滴于载玻片后到荧光显微镜观察。
1.4 HIF-1α 的表达检测
根据不同的实验组,提取各组相应时间段的细胞总蛋白后用Western blot 检测HIF-1α 表达。蛋白质浓度测定后,各组样本取总蛋白20 μg 上样进行电泳、转膜、封闭后,加入HIF-1α 一抗过夜,以β-actin 做内参,洗膜后加入二抗,显影曝光后用image J 进行灰度值分析。
1.5 免疫细胞化学(ICC)
根据实验分组在带有细胞爬片的6 孔板中铺上密度为0.8×105/孔的T98G 细胞进行处理,达到处理时间后,用4%的多聚甲醛进行细胞固定后室温下加入密封液(0.5%TritonX-100+3%BSA+5%山羊血清) 处理1.5 h。弃封闭液,加一抗(HIF-1alpha Rabbit Monoclonal Antibody,1:200) 室温孵育2 h,加二抗(Goat anti-rabbit IgG-FITC,1:200) 室温孵育1 h,DAPI 液染色10 min;取出玻片,树胶封片;上荧光显微镜观察。
1.6 统计学处理
2 结果
2.1 Hoechst 染色检测低氧组与常氧组细胞凋亡
倒置显微镜下的低氧组T98G 细胞(图1A)和常氧组细胞(图1B) 的比较显示良好的生长状态且无明显的细胞凋亡;Hoechst33342 进行细胞核染色后见低氧组(图1C) 和常氧组(图1D) 核形态完好,未见明显的细胞凋亡。
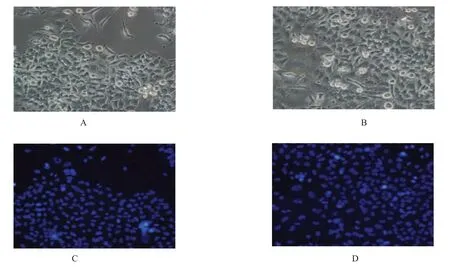
图1 1%O2 氧浓度和常氧下培养72 h 细胞镜下形态Fig.1 Cells cultured under 1%O2 oxygen concentration and normoxia for 72 h
2.2 MTT 法检测低氧组和常氧组的细胞增殖
常氧组和低氧组T98G 细胞连续培养24、48、72、96、120 h 生长曲线发现(图2):常氧组和缺氧组细胞均表现出增殖趋势且表现出良好的生长状态。低氧组在<72 h 时增殖速率略高于常氧组,但在120 h 内生长趋势差异无统计学意义(P>0.05)。

图2 T98G 低氧组和常氧组细胞生长曲线Fig.2 Growth curve of T98G cells in hypoxia group and normoxia group
2.3 低氧对T98G 细胞HIF-1α 蛋白表达的影响
T98G 细胞在低氧和常氧下处理24 h 后,根据免疫荧光结果,常氧下T98G 细胞中HIF-1α 少量表达(图3 A),而低氧下呈现高表达(图3 B)。Western blot 也证实了常氧下HIF-1α 蛋白少量表达(图4 A),低氧时HIF-1α 蛋白明显高表达(P<0.001),见图4 B。
2.4 不同时间梯度下低氧条件对HIF-1α 表达的影响
根据蛋白质印迹结果,低氧条件下T98G 细胞的HIF-1α 表达在<24 h(4、6 和12 h) 随时间增加(P<0.05) (图5A、5B),在24 h(48、72 h) 后随着时间延长,HIF-1α 表达量逐渐下降((P<0.05) 图5 C、5D)。该结果还证明了在缺氧条件下HIF-1α 不会长时间大量表达,而是急性快速表达。

图3 T98G 细胞在低氧和常氧下处理24 h 后HIF-1α 免疫荧光检测Fig.3 Immunofluorescence detection of HIF-1α in T98G cells treated with hypoxia and normoxic for 24 h
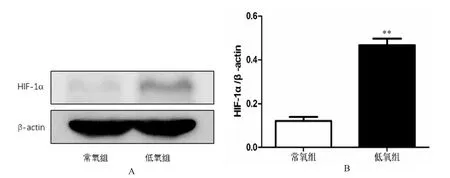
图4 T98G 细胞在低氧和常氧下处理24 h 后Western blot 检测HIF-1α 表达水平Fig.4 HIF-1α expression level of T98G cells by Western blot 24 h after hypoxic and normoxic treatment
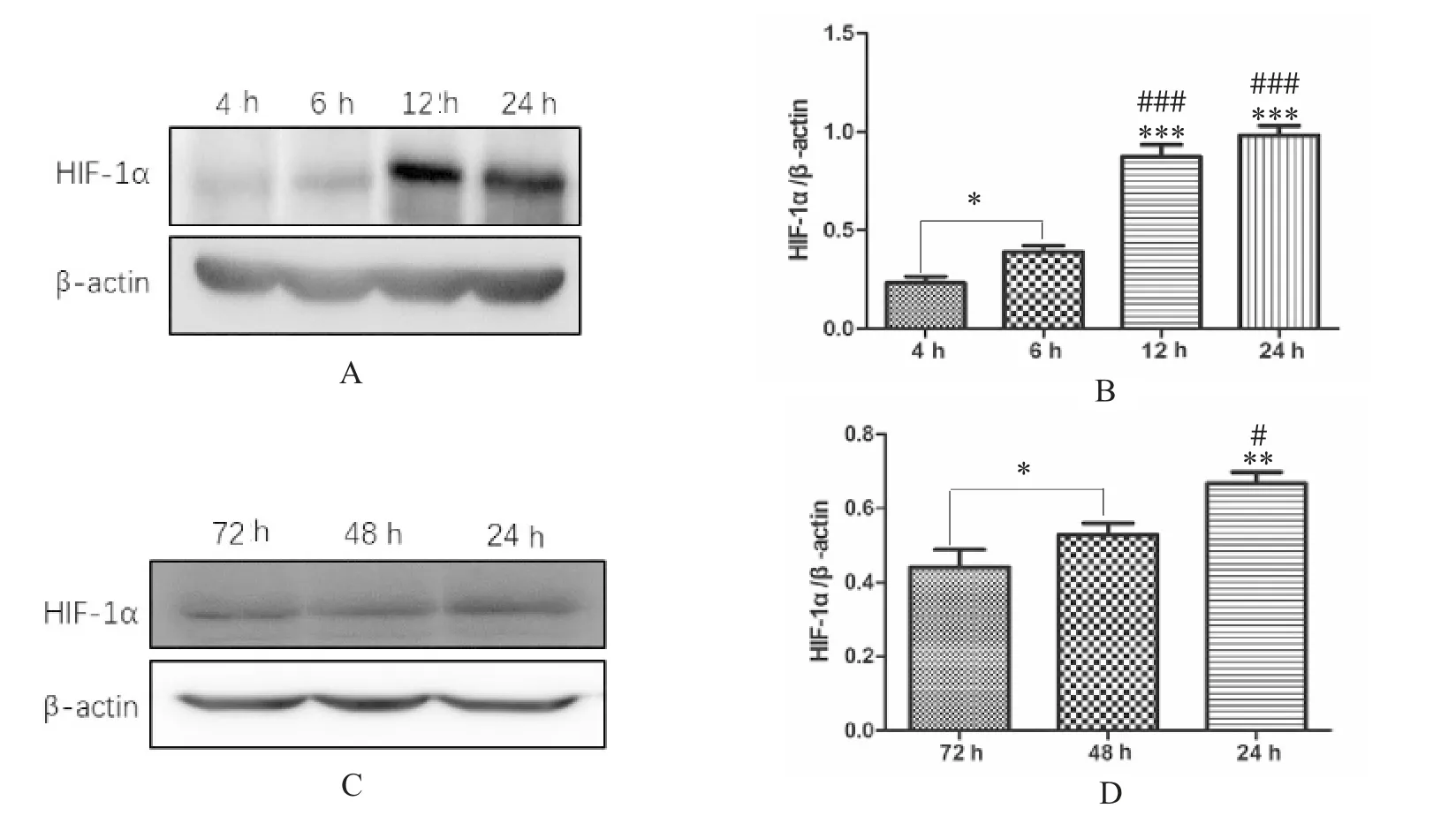
图5 T98G 细胞在低氧条件下不同时间段(4、6、12、24、48、72 h) HIF-1α 的表达水平Fig.5 HIF-1α expression in T98G cells at 4 h,6 h,12 h,24 h,48 h and 72 h under hypoxia
2.5 低氧条件下不同细胞密度对HIF-1α 表达的影响
根据Western blot 结果提示(图6):低氧下T98 G 细胞中HIF-1α 的表达会受到细胞密度变化的影响,其中在高细胞密度(8.5 万/cm2,其细胞汇合度约为95%) 表达量最高,密度过高或过低HIF-1α 蛋白表达均会降低。

图6 Western blot 检测低氧下不同T98G 细胞密度对HIF-1α 表达的影响Fig.6 Effect of different T98G cell densities on HIF-1α expression under hypoxia by Western blot
3 讨论
如同大多数实体肿瘤一样,胶质瘤的生长速度远快于肿瘤血管的生成速度,导致肿瘤细胞局部微环境中氧含量及营养物质的缺乏[5]。在氧含量及营养不足的情况下,低氧诱导一系列适应性反应,使肿瘤细胞得以在缺氧微环境中保持存活并增殖[6]。目前胶质瘤的缺血、缺氧和再复氧体内外模型能充分模拟细胞生长的低氧微环境,本研究在三气培养箱中通过调控脑胶质瘤细胞株T98G 的培养氧浓度从而观察其生长反应。
局部缺氧导致的一系列链式反应是造成肿瘤恶性发展和治疗抵抗的重要原因。多形性胶质母细胞瘤(GBM) 通过快速表低氧诱导因子-1(HIF-1)激活一系列适应性分子机制,以应对细胞中氧环境的变化[7]。HIF 是由一个结构型表达的HIF-1β 亚基和一个O2调节亚基(HIF-1α、HIF-2α 和HIF-3α) 构成的异源二聚体,在组织处于低氧时HIF-1α 不发生降解并与β 亚基配合构成功能转录因子[8]。在基因水平上HIF-1α 是氧敏感转录激活因子,通过结合靶基因启动子内的DNA 共有序列(缺氧应答元件HRE) 而发生反式激活,HIF-1α 的激活会促进参与细胞自主及非自主适应缺氧的数百种基因发生表达[9]。即使微环境中氧含量正常时,HIF-1α 也经常通过癌基因激活和/或抑癌基因抑制在癌细胞中被激活[10]。研究证明HIF-1α 在GBM 的发展和进展中起着关键作用,调控细胞血管生成、侵袭和转移等癌变过程中所涉及的许多基因[11]。
缺氧激活HIF-1α 的表达可导致糖酵解的氧化磷酸化(OXPHOS) 转向无氧糖酵解的基因发生改变,这种转变也是GBM 的代谢特点[12]。缺氧时HIF-1 通过降低线粒体功能,减少电子传递链的电子泄漏,防止ROS 的过度产生,以确保GBM细胞在缺氧环境中的存活并增殖[13]。因此,HIF-1α 在控制GBM 有氧糖酵解以满足其高能量消耗的同时,还在防止缺氧所致的损伤方面起着重要的调节作用。HIF-1α 的稳定表达引发与无氧糖酵解相关的一系列酶增多,导致周围组织乳酸水平升高、细胞外环境酸化,进一步激活与肿瘤增殖相关的信号通路[14]。致癌信号通路的激活在转录水平上促进了HIF-1α 表达[15]。依据GBM 偏爱糖酵解作为能量代谢的特点,靶向HIF-1α 的研究可能为胶质瘤的治疗提供机会。基于上述原理,本实验通过三气培养箱来检测T98G 细胞在1%O2的低氧浓度下的增殖与凋亡情况。通过实验观察到缺氧(1%O2)培养环境不能诱导T98G 细胞发生明显的凋亡;在低氧微环境(1% O2) 中,T98G 细胞HIF-1α 的蛋白表达不是恒定不变的,其表达量与缺氧时间及细胞密度密切相关。
综上所述,通过本研究可以初步推断缺氧微环境对脑胶质瘤T98G 细胞增殖、凋亡的影响,以及不同细胞生长阶段和生长密度对HIF-1α 表达的影响。低氧环境对胶质瘤细胞的影响尚需更多研究证明,HIF-1α 的研究能进一步阐明其代谢途径和调控凋亡对胶质瘤细胞的作用机制,促进以HIF-1α 为靶点的GBM治疗研究。

