菌株Alcaligenes sp. P156中一个新型烟酸羟化酶的克隆与功能验证*
孙倩姝, 赵书雪, 徐 康, 白 洁, 于 浩, 胡春辉**
(1. 中国海洋大学环境科学与工程学院, 海洋环境与生态教育部重点实验室, 山东 青岛 266100;2. 青岛农业大学生命科学学院, 山东 青岛 266109)
烟酸又称为尼克酸、维生素B3,是生物生长发育所必须的一种生长因子,是烟酰胺腺嘌呤二核苷酸(NAD+)、烟酰胺腺嘌呤二核苷酸磷酸(NADP+)以及其他多种辅因子的必要组成成分。在日常生活中,烟酸被普遍使用,经常作为添加剂被应用于食品、化妆品、饲料等行业[1]。同时,烟酸是合成多种烟碱类农药、药品的原材料,因此被广泛的应用于化工合成领域和医疗领域。烟酸是最常见的吡啶类化合物之一,存在于各种生物体内,随着生物的死亡、分解进入环境中。生物体中烟酸降解的代谢途径多种多样,因此烟酸常被当作模式化合物用于吡啶类化合物降解的研究。目前已报道多株能够降解烟酸的微生物[2-7]。
研究表明,好氧微生物主要通过6-羟基烟酸途径来降解烟酸,首先烟酸在烟酸羟化酶的催化下生成6-羟基烟酸[4,6,8],随后6-羟基烟酸在6-羟基烟酸单加氧酶的催化下生成2,5-二羟基吡啶,2,5-二羟基吡啶在酶的催化下生成N-甲酰马来酰胺酸、马来酰胺酸、马来酸、富马酸,并最终进入三羧酸循环,实现烟酸的完全矿化[4,9]。6-羟基烟酸还可以通过转化为2,6-二羟基烟酸来实现烟酸的降解[7,10]。在烟酸的厌氧降解途径中,6-羟基烟酸会被转化成为1,4,5,6-tetrahydro-6-oxonicotinate,并最终转化为丙酮酸和丙酸盐,实现完全矿化[5]。此外在菌株伯克霍尔德菌属(Burkholderiasp.)DSM 6920中还发现烟酸能够被转化为2-羟基烟酸,但是生成的2-羟基烟酸并不能够被进一步转化[11]。从已经报道的文献可以看出,无论通过好氧呼吸还是厌氧发酵,烟酸降解的第一步反应都是在吡啶环的ɑ位加羟基。通过吡啶环上电子密度分布可以推测,吡啶环ɑ位的羟基化反应通常都是由脱氢酶催化而不是单加氧酶催化[12-13]。目前已报道的吡啶环ɑ位的羟基化反应都是钼结合的羟化酶催化的。例如,3-羟基吡啶被一个钼结合的3-羟基吡啶2-羟化酶催化生成2,5-二羟基吡啶[14];2-吡啶羧酸在一个钼结合2-吡啶羧酸羟化酶的作用下生成6-羟基-2-吡啶羧酸[15];还有异烟酸、3-琥珀酰吡啶、6-羟基假氧化尼古丁的转化都是由钼结合脱氢酶催化的[16-18]。同样,催化烟酸生成6-羟基烟酸的烟酸羟化酶也是一个钼结合脱氢酶。
目前,已有多个烟酸羟化酶被克隆并验证功能,其中大部分为多亚基钼结合羟化酶。除了钼结合结构域之外,这些酶上面还有其他的结构域,如[2Fe-2S]簇,FAD结合结构域、细胞色素c结构域等[4,19-24]。研究表明,羟基化反应中羟基中的氧原子是来自于H2O而不是氧气,因此这些烟酸羟化酶属于脱氢酶而不是单加氧酶[25]。随着基因组测序技术的发展,多个烟酸羟化酶被克隆并进行了功能验证。恶臭假单胞菌(Pseudomonasputida)KT2440中报道了一个双亚基的烟酸羟化酶[21];睾丸酮丛毛单胞菌(Comamonastestosteroni)JA1中报道了一个三亚基的烟酸羟化酶[20],极小单胞菌(Pusillimonassp.)T2中也报道了一个新型的三亚基烟酸羟化酶[19]。由于烟酸在自然界中存在的时间很长,因此不同的微生物进化出了不同的烟酸降解途径,这些途径中的烟酸羟化酶结构域序列存在很大差异,新型烟酸羟化酶的克隆不仅有助于了解吡啶类化合物的降解机理,而且能够对钼结合羟化酶家族蛋白的进化和催化机理有更为深入的了解。
菌株产碱杆菌(Alcaligenessp.)P156是实验室筛选的一株能够以烟酰胺作为唯一碳氮源进行生长的菌株,菌株P156在烟酰胺水解酶的催化下将烟酰胺转化为烟酸,烟酸随后被转化为6-羟基烟酸,6-羟基烟酸通过2,5-二羟基吡啶途径最终转化为富马酸进入三羧酸循环[26]。之前的研究中鉴定到了一个烟酰胺降解基因簇,克隆并验证了烟酰胺水解酶、6-羟基烟酸单加氧酶和2,5-二羟基吡啶双加氧酶等基因的功能[26],但没有鉴定到烟酸羟化酶。在本研究中,本文作者克隆了一个新型烟酸羟化酶(NaaB),该酶含有三个亚基,分别由naaBL1、naaBS、naaBL2基因所编码,其中包括两个含有钼辅因子结合结构域的大亚基和一个含有[2Fe-2S]簇结合结构域的小亚基,并对NaaB的功能进行了验证。本研究对吡啶ɑ位羟化酶不同亚基以及不同结构域在钼辅因子类型选择方面有深入了解,为吡啶ɑ位羟化酶的改造提供了理论依据。
1 材料与方法
1.1 主要试剂
烟酸、6-羟基烟酸、黄素腺嘌呤二核苷酸(FAD)、5’-核黄素磷酸钠盐二水(FMN)、NAD+购买自生工生物工程(上海)股份有限公司;2,6-二氯靛酚钠(DCIP)、吩嗪硫酸甲酯(PMS)、氯化硝基四氮唑蓝(NBT)、异丙基-β-D-硫代半乳糖苷(IPTG)购买自上海阿拉丁生化科技股份有限公司;色谱级甲醇购买自上海安谱实验科技股份有限公司;Golden Mix(green)购买自北京擎科新业生物技术有限公司;基因组提取试剂盒和质粒提取试剂盒购买自生工生物工程(上海)股份有限公司。
1.2 培养基和培养条件
LB培养基(去离子水1 000 mL):酵母粉5 g,蛋白胨10 g,NaCl 10 g,121 ℃高压蒸汽灭菌20 min。无机盐(MSM)培养基配方参考Yu等[27]的研究。烟酰胺、烟酸过滤除菌,在接种前加入培养基中,终浓度为1 000 mg/L。固体培养基是在液体培养基中加入1.5%琼脂粉。柠檬酸培养基是在MSM培养基中加入终浓度1 000 mg/L柠檬酸钠和终浓度1 000 mg/L NH4Cl。
大肠杆菌在LB培养基中培养,温度为37 ℃,转速150 r/min。产碱杆菌P156在MSM培养基中进行培养,以烟酸或者烟酰胺作为底物,培养温度为30 ℃,转速150 r/min。
1.3 烟酸羟化酶基因的克隆
以菌株P156的基因组作为模板,利用引物naaBL1SL2-F和naaBL1SL2-R进行naaBL1SL2基因的PCR扩增。PCR的反应体系为:98 ℃ 2 min;30个循环(98 ℃ 20 s,62 ℃ 20 s,72 ℃ 3 min);72 ℃ 5 min。将PCR产物利用胶回收试剂盒进行回收。同时将载体pME6032利用EcoRI酶进行线性化。将线性化的pME6032载体和纯化后的PCR产物利用一步克隆试剂盒(诺唯赞ClonExpress II One Step Cloning Kit)进行连接,构建重组质粒pME6032-naaBL1SL2。利用引物naaBL1SL2-F和naaBL1S-R进行naaBL1S基因片段的克隆,并利用同源重组一步克隆的方法连接到EcoRI线性化后的pME6032载体中,构建重组质粒pME6032-naaBL1S。利用引物naaBSL2-F和naaBSL2-R进行naaBSL2基因片段的克隆,利用同样的方法连接到EcoRI和XhoI线性化后的pME6032中,构建pME6032-naaBSL2重组质粒。将重组质粒转化到大肠杆菌Trans1-T1中进行筛选,并进行测序验证。构建成功的重组质粒通过电击转化到无色杆菌SJY1中进行功能验证。电击转化在Eppendorf Eporator电转化仪中进行,转化条件为1 800 V,使用的电击杯的宽度为2 mm。
1.4 烟酸羟化酶功能验证
大肠杆菌和无色杆菌的重组菌株在LB培养基中培养,培养时加入25 μg/mL四环素和1 mmol/L IPTG,培养温度均为30 ℃。引物序列见表1。待菌株生长至稳定前期的时候,8 000g离心10 min收集细胞。利用PBS缓冲液(pH=7.0)重悬洗涤菌体细胞2次,最后一次将菌体细胞重悬,使OD600 nm为6.0。在休止细胞中加入烟酸(终浓度为1 000 mg/L),将休止细胞置于30 ℃,120 r/min震荡反应,定期取样1 mL,利用安捷伦Cary60分光光度计进行全波长扫描,检测底物转化情况,并将部分样品利用HPLC进行进一步检测。

表1 本研究使用的引物序列
1.5 RT-qPCR
为了确定naaB基因簇中基因与烟酸降解的关系,菌株P156在以烟酸或者柠檬酸钠/NH4Cl为唯一碳氮源的MSM培养基中进行培养。在菌株生长至对数末期的时候收集菌体,利用培养细胞/细菌总RNA提取试剂盒(天根生化科技(北京)有限公司)提取总RNA,并利用反转录试剂盒(TaKaRa公司)进行反转录生成cDNA。以cDNA作为模板,进行荧光定量PCR反应,以16S rRNA基因的表达作为对照。反应体系按照诺唯赞公司的ChamQ Universal SYBR qPCR Master Mix说明书进行配置,反应体系为20 μL,反应在Applied Biosystems QuantStudio 5 (ThermalFisher)荧光定量PCR仪上进行。分别利用引物naaBL1-q-F/R、naaBL2-q-F/R和16S-q-F/R扩增naaBL1、naaBL2和16S rRNA基因,具体引物序列见表1。naaBL1和naaBL2基因的表达量根据16S rRNA基因的表达量进行标准化,采用的方法为2-ΔΔCT方法。
1.6 菌株P156降解烟酸的代谢中间化合物检测
利用Agilent 1100 HPLC检测底物,检测器为PDA,色谱柱为C18反相柱(Elite SinoChrom ODS-AP C18, 4.6 mm × 250 mm, 5 μm),柱温30 ℃,进样量为5 μL。流动相A为0.1% (w/v)甲酸,流动相B为甲醇溶液,A∶B = 85∶15 (v/v),流速为1.0 mL/min。向休止细胞反应的样品中加入3倍体积的甲醇,4 ℃静置10 min,10 000 r/min离心2 min,取上清液用0.22 μm滤膜过滤后上机检测。
2 结果与分析
2.1 naaB基因的表达
在之前的研究中本文作者在菌株P156的基因组中发现了一个naa基因簇(见图1(b)),naa基因簇上面有从烟酸降解到富马酸的大部分基因[26]。在naaE基因的前面有3个基因,分别命名为naaBL1、naaBS和naaBL2。其中naaBL1和naaBL2编码的蛋白均含有钼辅因子结合结构域,根据烟酰胺的代谢途径(见图1(a))和已报道的文献[19-21,25],推测这3个基因很有可能负责催化由烟酸到6-羟基烟酸的反应。
为了进一步研究naaB基因与烟酸降解的关系,本文作者对菌株P156在烟酸存在和不存在两种情况下的naaB基因的表达进行了检测。荧光定量PCR结果表明,在烟酸存在的情况下naaBL1和naaBL2的表达量都显著高于没有烟酸存在情况下的表达量,分别提高了~2.1倍和~7.1倍(见图2)。这表明了naaB基因可能参与了烟酸的降解,并且烟酸就是其最适底物。
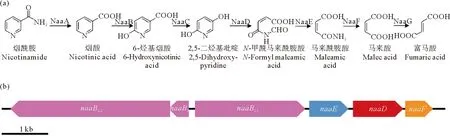
((a)菌株P156降解烟酰胺的途径;(b)菌株P156降解烟酰胺的相关基因。箭头指示转录的位置、方向和大小。标尺代表基因长度为1 kb。(a) Nicotinamide degradation pathway in strain P156; (b) Genes involved in nicotinamide degradation in strain P156. The arrows indicates the location, direction and size of the transcription of the ORFs. Bar, 1 kb.)
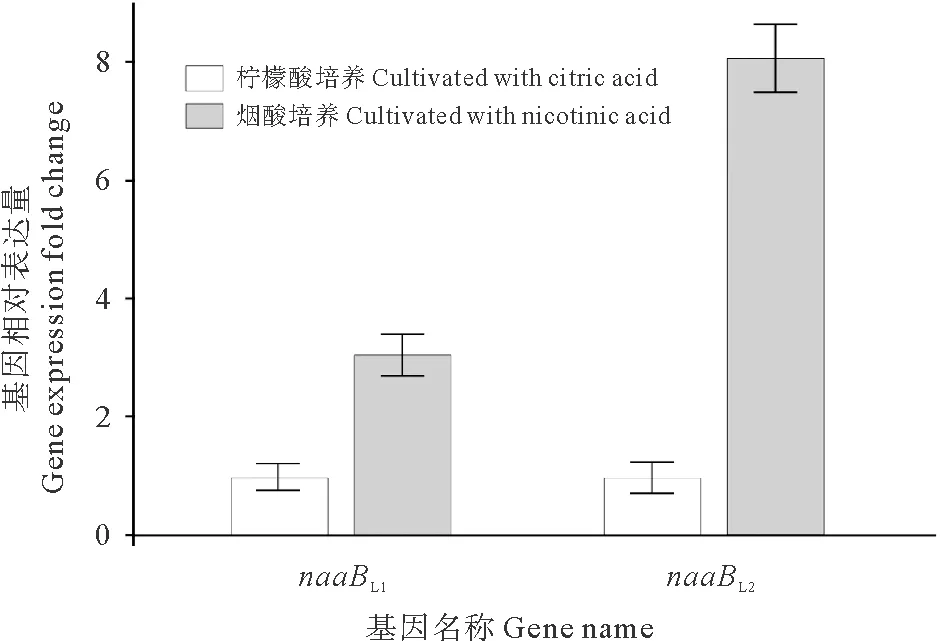
(数据根据16S rRNA基因进行标准化。每个值是三个平行重复结果的平均值±标准差。The data were normalized to the 16S rRNA gene. Each value is the mean±SD of the results of three parallel replicates.)
大部分的钼结合蛋白只有一个钼辅因子结合大亚基,但是naaB基因簇上面有两个钼辅因子结合大亚基,因此为了确定究竟哪个亚基起到了催化作用,分别将三个片段,即含有两个大亚基的naaBL1SL2片段、含有一个钼辅因子结合大亚基的naaBL1S和naaBSL2片段克隆到了广宿主质粒pME6032中(见图3(a))。并将含有naaB基因片段的重组质粒转化到了一株不能转化烟酸的无色杆菌SJY1中进行功能验证。通过休止细胞反应发现,仅含有一个钼辅因子结合大亚基的基因片段不能转化烟酸。只有同时含有两个钼辅因子结合大亚基的重组质粒才具备转化烟酸的能力。通过图3(b)可以看出,休止细胞反应2 h后就可以将烟酸完全转化成为另一种化合物,该化合物的全波长扫描图谱与6-羟基烟酸完全一致,并且该化合物不能被进一步转化。
通过HPLC分析可以发现,休止细胞反应2 h后,代表烟酸的吸收峰消失了,在3.95 min处出现了一个新的吸收峰,吸收峰的保留时间和全波长扫描图谱与6-羟基烟酸标准图谱完全一致(见图4(a)、(b))。将该化合物进行了LC-MS检测,可以发现反应后的产物中出现了一个分子量为138.019 9的化合物(见图4(c)),根据荷质比可以推测该化合物的分子式为C6H5NO3。通过RT-qPCR的实验结果,并结合全波长扫描、HPLC和LC-MS的结果可以确定,NaaB转化烟酸后生成了6-羟基烟酸,NaaB即为烟酸羟化酶,负责P156中烟酸生成6-羟基烟酸的催化反应。
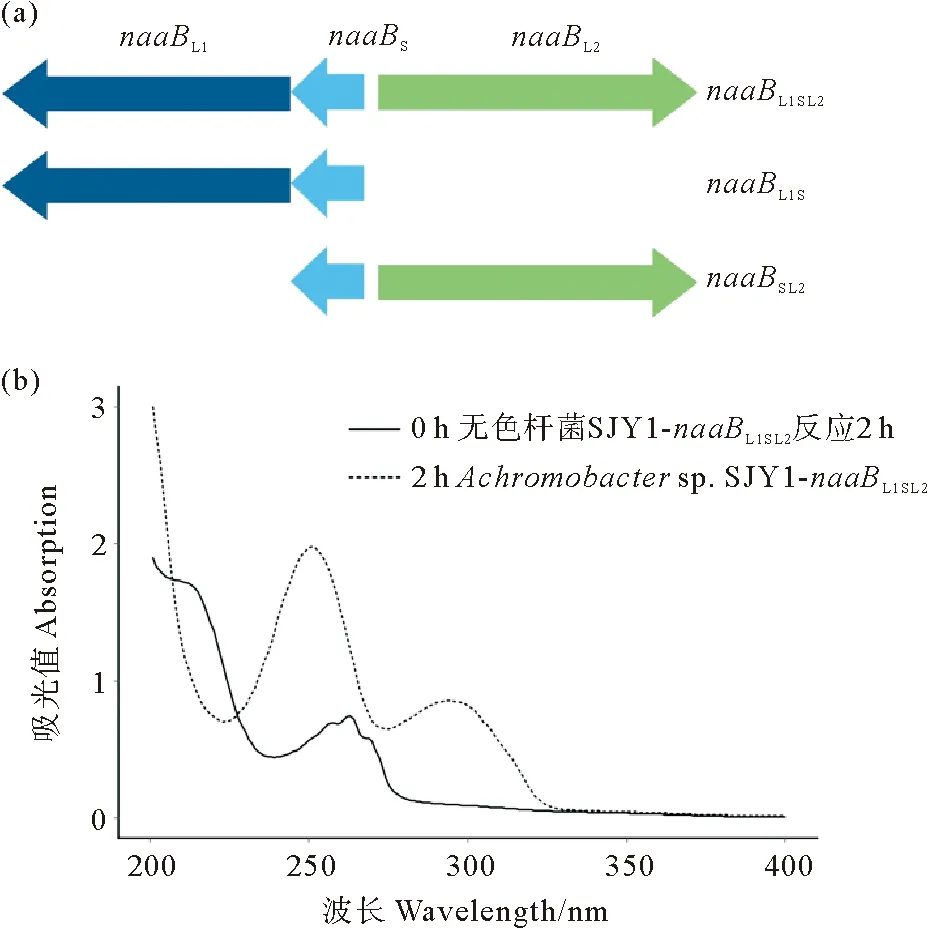
((a)分别克隆naaBL1SL2、naaBSL2和naaBL1S基因片段,并克隆到pME6032载体上。(b)将pME6032-naaBL1SL2重组质粒导入无色杆菌SJY1中进行休止细胞反应,分别取0和2 h的样品进行全波长扫描。(a) Genes naaBL1SL2, naaBSL2 and naaBL1S were amplified and inserted into pME6032 vector. (b) The recombinant plasmid pME6032-naaBL1SL2 was transformed into Achromobacter sp. SJY1 for resting cells reaction. The samples of 0 and 2 h were detected by UV spectrophotometry.)
目前报道的烟酸羟化酶均不能用大肠杆菌作为宿主细胞进行表达和功能验证。本研究进一步将pME6032-naaBL1SL2重组质粒转化到大肠杆菌Trans1-T1中,进行休止细胞反应转化烟酸。结果表明,含有重组质粒的大肠杆菌Trans1-T1-naaBL1SL2能够将烟酸转化为6-羟基烟酸(见图5),这说明了NaaB在大肠杆菌中也具备功能,这与其他报道的在大肠杆菌中验证的功能都不一样。为了确认其他烟酸羟化酶基因不能够在大肠杆菌中进行烟酸的转化,将恶臭假单胞菌KT2440中的烟酸羟化酶也克隆了出来,结果证明KT2440中的烟酸羟化酶在无色杆菌SJY1中能够转化烟酸,但是在大肠杆菌Trans1-T1中不能够转化烟酸。此外还在其他的假单胞菌中验证了NaaB的功能,结果表明NaaB在假单胞菌中也具备转化烟酸的功能。这一点再次证明了产碱杆菌P156中的烟酸羟化酶在催化机理上面存在独特的地方。
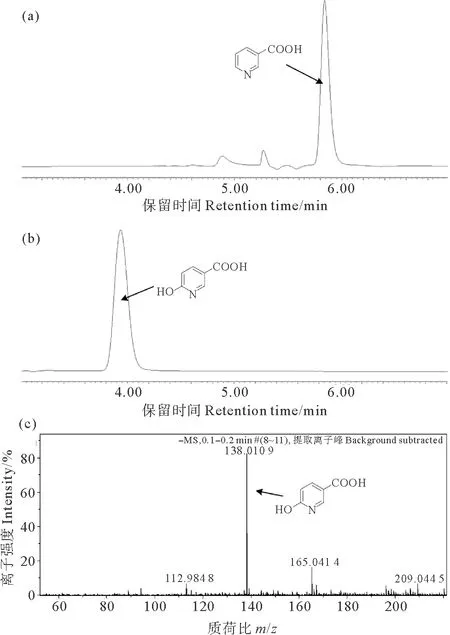
((a、b)利用含有pME6032-naaBL1SL2重组质粒的无色杆菌SJY1-naaBL1SL2休止细胞转化烟酸,分别取0 h(a)和2 h(b)的样品进行HPLC检测。(c)将休止细胞反应2 h的样品进行LC-MS检测。(a, b) HPLC analysis of the reaction samples at 0 h and 2 h for the transformation of nicotinic acid by resting cells of strain SJY1-naaBL1SL2. (c) LC-MS analysis of the reaction samples at 2 h for the transformation of nicotinic acid by resting cells of strain SJY1-naaBL1SL2.)

(分别利用含有pME6032-naaBL1SL2重组质粒的无色杆菌SJY1和大肠杆菌Trans1-T1的休止细胞转化烟酸。Nicotinic acid was transformed by resting cells of Achromobacter sp. SJY1 and Escherichia coli Trans1-T1 containing pME6032-naaBL1SL2, respectively.)
3 讨论
产碱杆菌P156是从辽河口油田污染的土壤中分离的一株能够以烟酰胺作为唯一碳氮源和能源进行生长的菌株。前期本文作者对烟酰胺的代谢途径和降解的分子机理进行了研究,克隆了编码烟酰胺脱氨酶和从6-羟基烟酸到富马酸的基因,并对这些基因的功能进行了验证,但是负责烟酸到6-羟基烟酸的催化反应的基因并不清楚。在本次研究中,对naa基因簇上面编码烟酸羟化酶(NaaB)的基因进行了克隆和功能验证。NaaB由3个基因编码,分别是naaBL1、naaBS和naaBL2。其中naaBL1和naaBL2分别编码了2个含有钼辅因子结合结构的大亚基,而naaBS基因编码了一个含有[2Fe-2S]簇的小亚基。将目前已经报道的烟酸羟化酶基因与NaaB的编码基因进行了比较[4-5,19-20](见图6),发现NaaB的编码基因的排列顺序与目前报道的烟酸羟化酶基因存在较大差异。从图6中可以看出,大部分的烟酸羟化酶基因都只含有1个钼辅因子结合的大亚基,只有NaaB和Nah同时含有2个钼辅因子结合的大亚基。NaaB与Nah的基因排列顺序也存在差异,这表明了NaaB与其他的烟酸羟化酶在很早就脱离并独自进化。

(NaaBL1SL2来自产碱杆菌P156,NicAB来自恶臭假单胞菌KT2440,NaDHSLM来自睾丸酮丛毛单胞菌JA1,NahAB1B2来自极小单胞菌T2,NdhFSLM来自巴氏真杆菌(Eubacterium barkeri)。蛋白质下面的字母表示相应蛋白质的亚单位名称。NaaBL1SL2 from Alcaligenes sp. P156, NicAB from Pseudomonas putida KT2440, NaDHSLM from Comamonas testosteroni JA1, NahAB1B2 from Pusillimonas sp. T2, NdhFSLM from Eubacterium barkeri. The letters depicted below the proteins indicate the subunit names of the corresponding proteins.)
NaaB不仅在基因结构上与已经报道的烟酸羟化酶存在差异,而且在功能上面也存在差异。恶臭假单胞菌KT2440中的烟酸羟化酶不能够在大肠杆菌中表达出活力[4],但是NaaB可以在大肠杆菌Trans1-T1中表达并具备转化烟酸的功能。目前报道的大部分的吡啶环ɑ位羟化酶都不能够在大肠杆菌中表达,例如之前报道的无色杆菌SJY1中的尼古丁脱氢酶[28]。造成这一现象的主要原因是大肠杆菌和恶臭假单胞菌中的钼辅因子的类型不同。在合成钼辅因子的过程中,GMP或者CMP会结合到钼蝶呤的磷酸基团上,形成具有功能的钼辅因子[29]。在大肠杆菌中只能够合成钼双-MTP-鸟嘌呤二核苷酸(MGD)类型的钼辅因子,不能够合成硫化钼蝶呤胞嘧啶二核苷酸(MCD)类型的钼辅因子[29]。但是大部分的吡啶ɑ位羟化酶基因所需要的钼辅因子都是MCD的而不是MGD[4,30],因此不能够用大肠杆菌来表达吡啶环ɑ位羟化酶。
为了解释NaaB在大肠杆菌中具备转化烟酸的功能,本文作者对已经报道的烟酸羟化酶的催化结构域进行了详细分析。通过图6可以看出,所有的烟酸羟化酶均具备钼辅因子结合结构域和[2Fe-2S]簇结构域,有研究表明[2Fe-2S]簇决定了底物的类型,尽管这一结论尚无进一步的验证,但是这些结果均说明[2Fe-2S]簇对于维持钼结合羟化酶的活力是必须的。
此外,绝大部分已报道功能的吡啶环ɑ位羟化酶除钼辅因子结合结构域和[2Fe-2S]簇结构域外还含有第3种结构域,该结构域通常是FAD结合结构域或者细胞色素c结构域,这个结构域可能负责了催化过程中的电子传递过程。在NaaB的三个亚基分别包含了钼辅因子结合结构域,[2Fe-2S]簇结构域和一个细胞色素c结构域。更进一步的分析可以发现,钼辅因子结合结构域实际上包含了三个亚结构域,分别是MPT1、MPT2和MPT3,目前报道的所有的钼结合吡啶环ɑ位羟化酶均同时具备了这三个亚结构域。这就解释了为什么NaaB必须同时具备三个亚基才能够具备转化烟酸的功能,因为NaaBL1亚基缺少了细胞色素c这个电子传递的结构域,而NaaBL2缺少了MPT1亚结构域,因此钼辅因子结构域是不完整的。在NaaB中存在了2个钼辅因子结合的大亚基,这两个大亚基可能分别能够与MCD和MGD进行结合,催化烟酸的转化反应,这就解释了为什么NaaB能够同时在无色杆菌、产碱杆菌、大肠杆菌和假单胞菌中具备功能。
本研究结果加深了对吡啶ɑ位羟化酶不同亚基以及不同结构域在钼辅因子类型选择方面的理解。但是,仍然有很多问题需要解决,例如究竟哪个亚基决定了底物的特异性,不同烟酸羟化酶的亚基之间的功能是否可以互补,NaaB中哪些小结构域是关键的,哪些可以去除,这些都需要进一步的深入研究。总之,本研究的结果为吡啶类化合物转化的分子机理研究提供了参考。

