基于αCaMKⅡ-CREB-BDNF 信号通路研究调心方对APP/PS1 双转基因AD 小鼠学习记忆和突触可塑性的影响
王晓雯 ,钱 红 ,沈春娟 ,李燕军 ,袁海新 *,王 健
1 上海市第五康复医院,上海 201699;2 上海中医药大学康复医学院,上海201203
阿尔茨海默病(Alzheimer's disease,AD)是一种不可逆转的中枢神经系统退行性疾病。 目前,全世界范围内有超过5 000 万AD 患者,到2050 年,预计将有 15 000 万 AD 患者[1]。 AD 的主要发病人群为60 岁以上的老年人,其患病率随人口老龄化日益增加。在我国60 岁以上人群的患病率为0.53%~5.67%,85 岁以上为 20%~50%[2]。 AD 的临床特征是隐匿起病,早期主要出现近期记忆力减退,随着病情的发展,视空间、计算力、语言、运动神经系统功能均可出现障碍,在后期甚至出现妄想、错觉、焦虑、抑郁等精神症状,不仅对老年人的日常生活能力造成了严重的影响,也给照料者和社会带来了沉重的负担[3]。 目前有许多研究进行 AD 治疗药物研发,据不完全统计正在研发/已研发的药物有200 多种,但其中99%药物因中期结果无效或副作用不能耐受等原因导致失败[4],仅有极少数药物被批准用于治疗AD,而这些药物只能控制症状,并无法改变疾病的进程。 如多奈哌齐就是临床上治疗轻中度AD 的常用药物[5],它是一种可逆性的乙酰胆碱酶抑制剂,能有效改善认知功能。
近年来,随着中医学对AD 防治的深入研究,发现中医药在AD 的防治方面有着明显的优势。 林水淼教授[6]结合多年临床经验提出轻中度AD 患者以心气虚证为主,治疗宜从心入手,研究发现调心方能有效改善氧化损伤型类AD 大鼠空间记忆能力和神经元钙稳态[7]。本课题组前期研究发现,经过调心方治疗后,APP/PS1 双转基因小鼠的学习获取能力和空间记忆保持能力均明显提高[8]。 但有关于其具体的作用机制还未明确。 APP/PS1 双转基因小鼠能够模仿AD 的病理变化,常被用于AD 和神经退行性病变的神经生物学研究[9]。 αCaMKⅡ-CREBBDNF 信号通路是形成及维持空间学习记忆能力和长时程增强(long-term potentiation,LTP)的重要信号通路之一[10]。 本研究基于 αCaMKⅡ-CREB-BDNF 信号通路探讨调心方改善AD 学习记忆和突触可塑性的具体作用机制,选择采用3 月龄APP/PS1双转基因小鼠为AD 病理模型,通过电生理技术诱导小鼠海马CA1 区LTP,实时荧光定量聚合酶链反应 (real-time quantitative polymerase chain reaction,RT-qPCR)法检测小鼠海马区α 钙/钙调素依赖激Ⅱ(alpha calcium /calmodulin-dependent protein kinaseⅡ,αCaMKⅡ)、环磷酸腺苷反应元件结合蛋白(cyclic AMP response element binding protein,CREB)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、突触后致密物 95(postsynaptic density protein-95,PSD-95)mRNA 表达;采用 Western blot 法检测 p-αCaMKⅡ、p-CREB、BDNF、PSD-95 蛋白表达。
1 实验材料
1.1 实验动物
选取 SPF 级 3 月龄 APP/PS1 双转基因雄性小鼠 54 只,体质量(25.22±1.71)g,按照随机数字表法将APP/PS1 雄性小鼠分为模型组、多奈哌齐组、调心方组。另设同月龄同品系同月龄C57/BL6 雄性野生型小鼠 18 只为正常组,体质量(30.49±1.59)g。以上实验动物均由南京大学模式动物研究所提供,品系编号为 D00268,许可证号:SCXK(苏)2015-0001。 动物实验在上海中医药大学动物实验中心进行,实验过程中动物饲养和操作严格遵循实验动物伦理学准则。
1.2 主要仪器与试剂
超薄切片机(德国Leica 公司);全波长酶标仪、梯度PCR 仪(美国Thermo 公司);伯乐电泳仪、伯乐宽式水平电泳槽、转印电泳槽(美国BIO RAD 公司);水浴锅、隔水式恒温培养箱(上海精密实验设备公司);化学发光成像仪(上海天能公司)。 Trizol、随机引物(美国 Invitrogen 公司);RIPA、PMSF、BCA试剂盒、PBS、SDS-PAGE 凝胶配制试剂盒、5Xloadingbuffer、SDS-PAGE 电泳液、Western 转膜液(上海碧云天生物技术公司);BDNF 抗体、p-CREB(S133)抗体、p-αCaMKⅡ(T286)抗体、GAPDH 抗体、PSD95抗体(英国 Abcam 公司);αCaMKⅡ-α、CREB、辣根过氧化物酶标记山羊抗兔IgG(H+L)(美国CST 公司)。
1.3 主要药物
调心方颗粒(江苏江阴天江药业有限公司),其成分主要包括党参、石菖蒲、桂枝、甘草、白芍、龙骨、远志等;盐酸多奈哌齐(江苏豪森药业股份有限公司,生产批号:H20030472)。
2 实验方法
2.1 干预方法
参照药理试验中动物与人体间的等效剂量换算标准进行折算,多奈哌齐组和调心方组均按照人的等效剂量(体质量:60 kg)折算出药物剂量。 正常组和模型组给予等量生理盐水 10 mL/(kg·d);多奈哌齐组给予盐酸多奈哌齐灌胃,剂量为 0.05 mg/(kg·d);调心方组给予调心方颗粒灌胃,剂量为0.057 g/(kg·d)[11];4 组小鼠于 3 月龄时进行灌胃给药处理,1 次 /d,连续灌胃 3 个月。
2.2 取材
2.2.1 脑片制备 4 组各随机选取5 只小鼠,于小鼠腹腔注射20%的水合氯醛,待小鼠麻醉后,快速断头,取出脑组织移至95%O2+5%CO2混合气饱和的人工脑脊液(artificial cerebrospinal fluid,ACSF)中,ACSF 溶液温度为 0 ℃,放置 1 min。 去除前脑和小脑,用胶水将剩余脑组织块粘在切片台上。 用振动切片机冠状切取海马脑片,海马脑片大小为400 μm,放入34 ℃的孵育槽中孵育0.5 h,然后放在(25±1) ℃持续通入 95%O2+5%CO2混合气饱和的 ACSF溶液中2~8 h。
2.2.2 脑组织样本制备 4 组各随机选取7 只小鼠,将小鼠腹腔注射20%的水合氯醛,待小鼠麻醉后,快速断头,取出脑组织移置-20 ℃的冰盒上,迅速剥离左右两侧海马置于EP 管中,储存于-80 ℃冰箱内,以待RT-qPCR 和Western blot 检测备用。
2.3 指标检测
2.3.1 离体海马CA1 区LTP 诱导 待脑片孵育结束后,在显微镜下将脑片移进记录槽中,使用32~34 ℃的 95%O2+5%CO2混合气饱和的 ACSF 溶液持续灌流,速度为3 mL/min,在海马CA1 区记录兴奋性突触后电位。 具体步骤如下:①确定海马CA1区:显微镜下确定海马的CA1 区。②准备刺激电极、记录电极:选择1 个单级钨丝的微电极刺激作为刺激电极,尖端直径1~2 μm,尖端暴露长度为15~40 μm;记录电极为玻璃管记录电极,ACSF 溶液充满玻璃管,电阻1~5 MΩ,将其放在CA1 区的同一层。③ 刺激海马CA1 区:将刺激电极放在海马CA1区 stratum radium 层,刺激 Shaffer collateral 纤维,以0.033 Hz 频率,100 μs 波宽,每隔 30 s 给 1 个刺激,刺激强度为0.1~0.7 mA。 ④ 记录场兴奋性突触后电位:每给1 个刺激记录1 个场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP),以 30%fEPSP 最大刺激强度为基线,记录30 min;在前30 min 基础 fEPSP 曲线保持稳定后,LTP 应用100 Hz 高频刺激(high frequency stimulation,HFS)诱导1 s,LTP 诱发成功后持续记录 60 min,选择其中的第50~60 min 的fEPSP 平均斜率观察LTP 水平。LTP 是在强直剌激下诱发的突触传递功能长时间增强现象,反映了突触传递效能的持久变化[12]。⑤绘制刺激强度-反应曲线:以刺激强度为横坐标,fEPSP斜率为纵坐标,绘制刺激强度-反应曲线(input-output curve,I/O),I/O 曲线能够反映神经环路的基本突触传递特性。 ⑥观察短时程突触可塑性:在海马Schaffer 侧枝CA1 区的突触通路上,从20~250 ms 双脉冲刺激间隔的双脉冲易化(paired pulse facilitation,PPF)即短时程的突触可塑性。 在 30%fEPSP 最大刺激强度的刺激下,一般会产生前后2 个突触后兴奋电位,后1 个fEPSP 斜率/前1 个fEPSP斜率就是PPF 值。 它可通过观察突触后的反应来推测突触前神经递质的释放情况。 以上数据采用Clampfit 软件进行分析。
2.3.2 海马 CA1 区 αCaMKⅡ、CREB、BDNF 和 PSD-95mRNA 含量检测 采用RT-qPCR 法检测海马αCaMKⅡ、CREB、BDNF 和 PSD-95mRNA 的含量。4 组小鼠各随机选取4 个海马组织,采用Trizol 法提取总 RNA, 使用酶标仪检测总RNA 的浓度和纯度,光密度(optical density,OD)比值可以判断RNA纯度,OD260/OD280在 1.8~2.0 之间,表示 RNA 纯度较好。 RNA 纯度测定后,利用 cDNA 合成试剂盒将2 μg RNA 逆转录为 cDNA。PCR 扩增条件:95 ℃预变性 2 min,需执行 1 个循环。 先 95 ℃变性 5 s,后60 ℃退火10 s,需执行45 个循环。循环结束后缓慢升温,生成各基因的熔解曲线。 采用GAPDH 作为内参基因,利用荧光定量 PCR 仪对目的基因αCaMKⅡ、BDNF、CREB、PSD-95 进行定量检测。 使用 PCR系统软件,观察熔解和扩增曲线,记录各组目的基因的 Ct 值,相对定量采用 2-△△Ct法。 引物由 NCBI Primer-blast 设计,序列参照Gene Bank 数据库中的基因序列,由苏州金唯智公司合成。 序列为:①BDNF:上游 5’-GGTATCCAAAGGCCAACTGA-3’;下游 5’-CTTATGAATCGCCAGCCAAT-3’。 ② CREB:上游 5’-CAGACAACCAGCAGAGTGGA-3’,下游5’-GGGCTAATGTGGCAATCTGT-3’。 ③ GADPH:上游 5’-AGGTCGGTGTGAACGGATTTG-3’,下游5’-TGTAGACCATGTAGTTGAGGTCA-3’。 ④ PSD-95:上游 5’-CTATGAGACGGTGACGCAGA-3’,下游5’-CGGGAGGAGACAAAGTGGTA-3’。⑤αCaMKⅡ:上游 5’-CAGCCACTGTATCCAGCAGA-3’,下游5’-GAGGCCAGCAACAGATTCTC-3’。
2.3.3 海马 CA1 区 p-αCaMKⅡ、p-CREB、BDNF和PSD-95 蛋白含量检测 采用Western blot 法检测海马 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 的蛋白含量。 4 组随机选取3 个在-80 ℃冰箱中储存的海马组织,按蛋白提取试剂盒上操作要求提取蛋白,使用BCA 法测定各组蛋白浓度。 绘制标准曲线,计算出4 组样本的蛋白浓度,使用RIPA 裂解液将各组蛋白定容至等体积,浓度为1 μg/μL,在100 ℃水浴锅中煮沸10 min,置于-20 ℃冰箱中备用。 经过SDS-PAGE 凝胶配制、凝胶电泳、转膜、蛋白印迹后,进行图像分析。 所有条带均采用Al-Phaview SA 软件进行处理分析。
2.4 统计学分析
采用SPSS 21.0 统计软件进行数据分析。 计量资料用()表示,数据符合正态分布且方差齐时,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验;方差不齐用Wilcoxon 秩和检验。 重复测量数据用重复测量方差分析。 P<0.05 为差异有统计学意义。
3 结 果
3.1 4 组小鼠海马 CA1 区 LTP 比较
见图1。
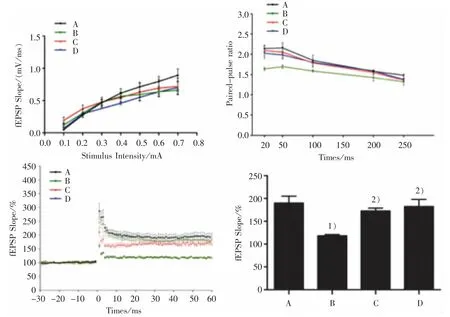
图 1 4 组海马 CA1 区 LTP 图Figure 1 LTP figure of hippocampal CA1 in four groups
3.2 4 组小鼠海马区 αCaMKⅡ、CREB、BDNF 和PSD-95 mRNA 表达比较
见表 1、图 2。
表 1 4 组海马 αCaMKⅡ、CREB、BDNF、PSD-95 mRNA 表达比较()Table 1 Comparison of αCaMKⅡ, CREB, BDNF, PSD-95 mRNA expression in the hippocampus in four groups ()
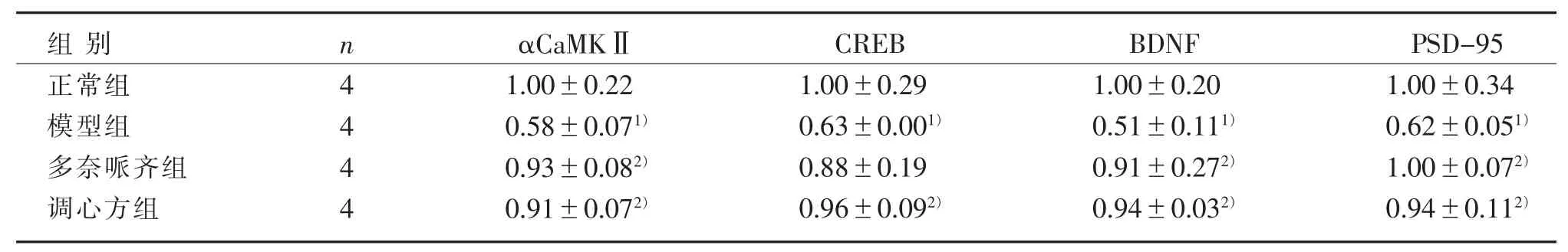
表 1 4 组海马 αCaMKⅡ、CREB、BDNF、PSD-95 mRNA 表达比较()Table 1 Comparison of αCaMKⅡ, CREB, BDNF, PSD-95 mRNA expression in the hippocampus in four groups ()
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the normal group, 1) P<0.05; Compared with the model group, 2) P<0.05.
PSD-95 1.00±0.34 0.62±0.051)1.00±0.072)0.94±0.112)组别正常组模型组多奈哌齐组调心方组n 4 4 4 4 αCaMKⅡ1.00±0.22 0.58±0.071)0.93±0.082)0.91±0.072)CREB 1.00±0.29 0.63±0.001)0.88±0.19 0.96±0.092)BDNF 1.00±0.20 0.51±0.111)0.91±0.272)0.94±0.032)
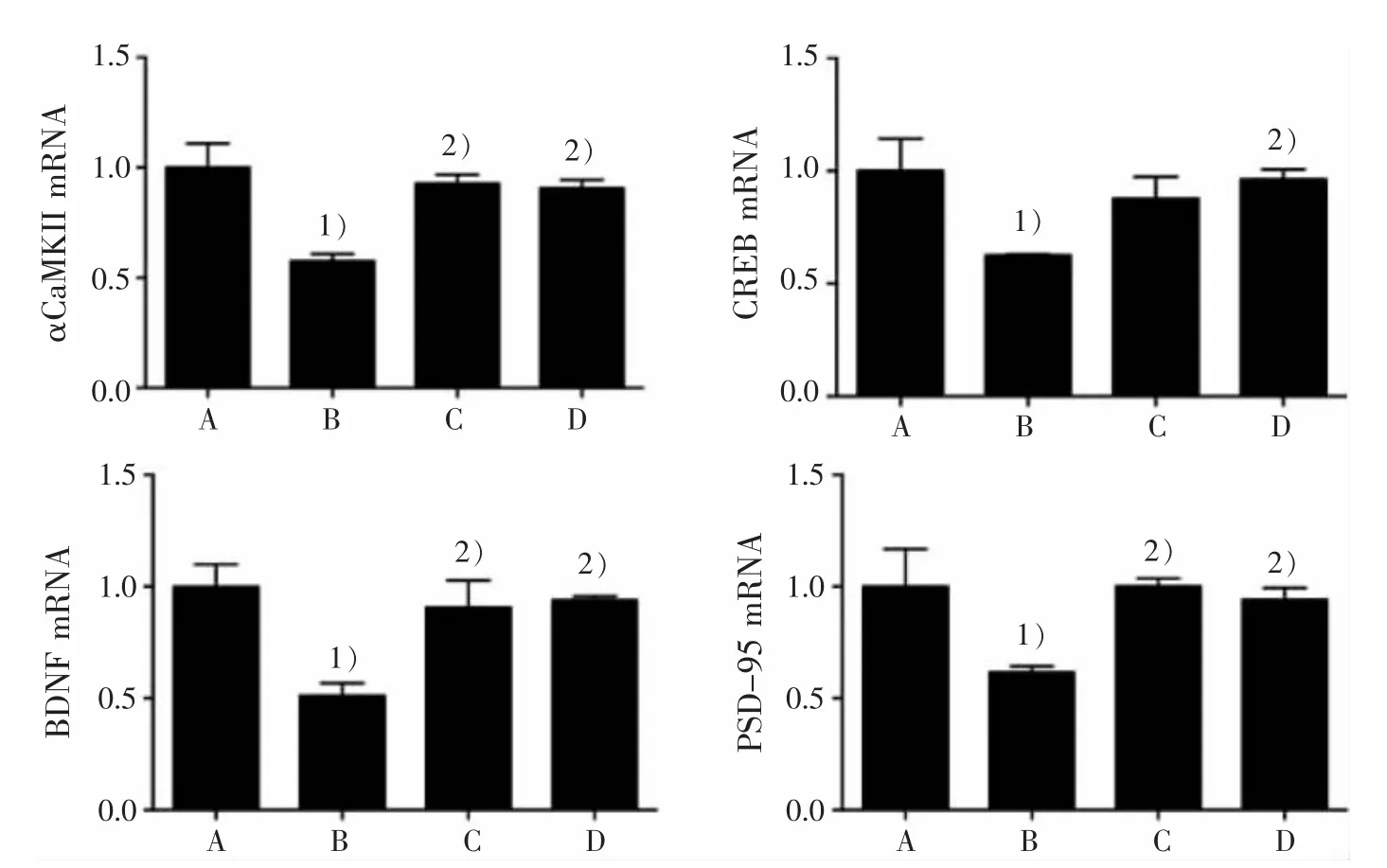
图 2 4 组小鼠海马区 αCaMKⅡ、CREB、BDNF 和 PSD-95 mRNA 表达比较Figure 2 Comparison of αCaMKⅡ,CREB,BDNF and PSD-95 mRNA expression in the hippocampus in four groups
3.3 4 组小鼠 海马 区 p-αCaMK Ⅱ、p-CREB、BDNF和PSD-95 的蛋白表达比较
见表 2、图 3、图 4。
表 2 4 组海马区 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 蛋白表达比较()Table 2 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression in the hippocampus in four groups ()
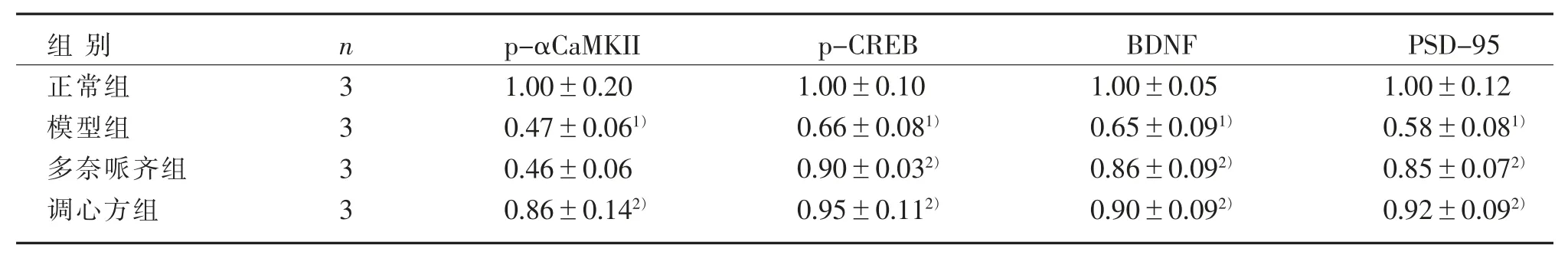
表 2 4 组海马区 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 蛋白表达比较()Table 2 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression in the hippocampus in four groups ()
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the normal group, 1) P<0.05; Compared with the model group, 2) P<0.05.
PSD-95 1.00±0.12 0.58±0.081)0.85±0.072)0.92±0.092)组别正常组模型组多奈哌齐组调心方组n 3 3 3 3 p-αCaMKII 1.00±0.20 0.47±0.061)0.46±0.06 0.86±0.142)p-CREB 1.00±0.10 0.66±0.081)0.90±0.032)0.95±0.112)BDNF 1.00±0.05 0.65±0.091)0.86±0.092)0.90±0.092)
4 讨 论
中医学将AD 归于“呆病”“郁证”“癫证”等范畴,对于AD 不同阶段的病机、治则、治法尚未达成共识。AD 主要临床表现为认知功能障碍,有研究发现AD 的基本病机为:心气虚衰,气不生神,为本虚;痰滞瘀阻,蒙蔽神窍为标实。 根据“缓则治其本”“治病必求于本”的原则,从“心”入手,调心气可以治疗AD。 调心方中党参功擅补心气,安神增智为君;桂枝温通血脉,振奋心阳为臣;石菖蒲安神益智,开窍为佐;远志通窍豁痰,增智为使。 诸药配伍具有益心气化痰开窍之功效[13]。 有临床研究显示,调心方能够改善轻、中、重度AD 患者的认知功能和日常生活能力,通过提高后扣带回与脑功能区的连接,从而达到改善脑功能的作用[14]。 有基础研究发现,调心方可以抑制神经细胞凋亡、乙酰胆碱的水解、胶质细胞激活、Tau 蛋白的过度磷酸化、Aβ 寡聚体的生成,减轻神经炎症反应、抗氧化应激等多个靶点和途径,从而达到改善AD 发生、发展的作用。 但有关于调心方是如何改善AD 患者学习记忆能力的具体作用机制还不够明确,因此本研究尝试基于αCaMKⅡ-CREB-BDNF 信号通路探讨调心方对APP/PS1 双转基因AD 小鼠学习记忆和突触可塑性的影响,以期为探讨调心方改善AD 患者学习记忆能力的具体作用机制提供依据。
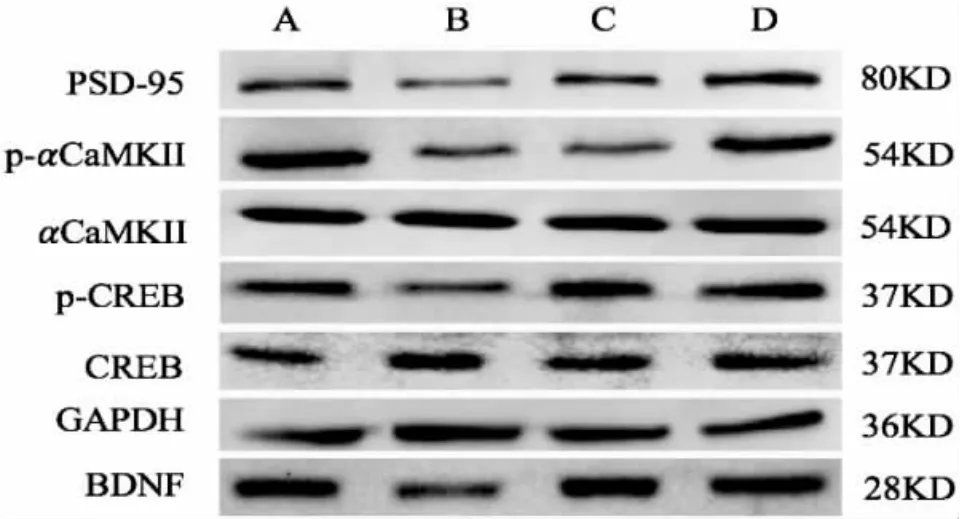
图 3 4 组海马区 p-αCaMKⅡ,p-CREB,BDNF 和PSD-95 的蛋白条带显影Figure 3 Protein band development on p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression of the hippocampus in four groups
4.1 调心方能够改善APP/PS1 双转基因AD 小鼠海马突触可塑性
LTP、PPF、I/O 是突触功能可塑性的 3 个重要电生理指标。本研究结果显示,4 组分组效应和刺激强度效应均无明显区别;分组和刺激时间因素无明显的交互作用;在0.1~0.7 mA 刺激强度下,4 组小鼠海马 I/O 曲线斜率无明显区别;在 50、100、200、250 ms的不同刺激间隔下,4 组PPF 易化无明显区别。 这说明APP/PS1 小鼠海马LTP 的损伤与基本突触传递和突触前神经递质释放无关,APP/PS1 双转基因小鼠的基本突触传递效能无发生障碍,这提示6 月龄的APP/PS1 小鼠海马LTP 的损伤与基本突触传递和突触前神经递质释放无关。 第50~60 min 的海马fEPSP 斜率组间比较结果显示,与正常组比较,模型组小鼠fEPSP 斜率明显降低,提示模型组小鼠海马LTP 受损。 与模型组比较,调心方组fEPSP 斜率均明显提高。这说明调心方可改善APP/PS1双转基因AD 小鼠LTP 的抑制,改善其突触传递效能,从而提高突触可塑性,改善学习记忆能力。 这与ROLLAND 等[15]发现突触可塑性与神经系统的发育、损伤、修复及学习记忆等密切相关的研究结果一致。
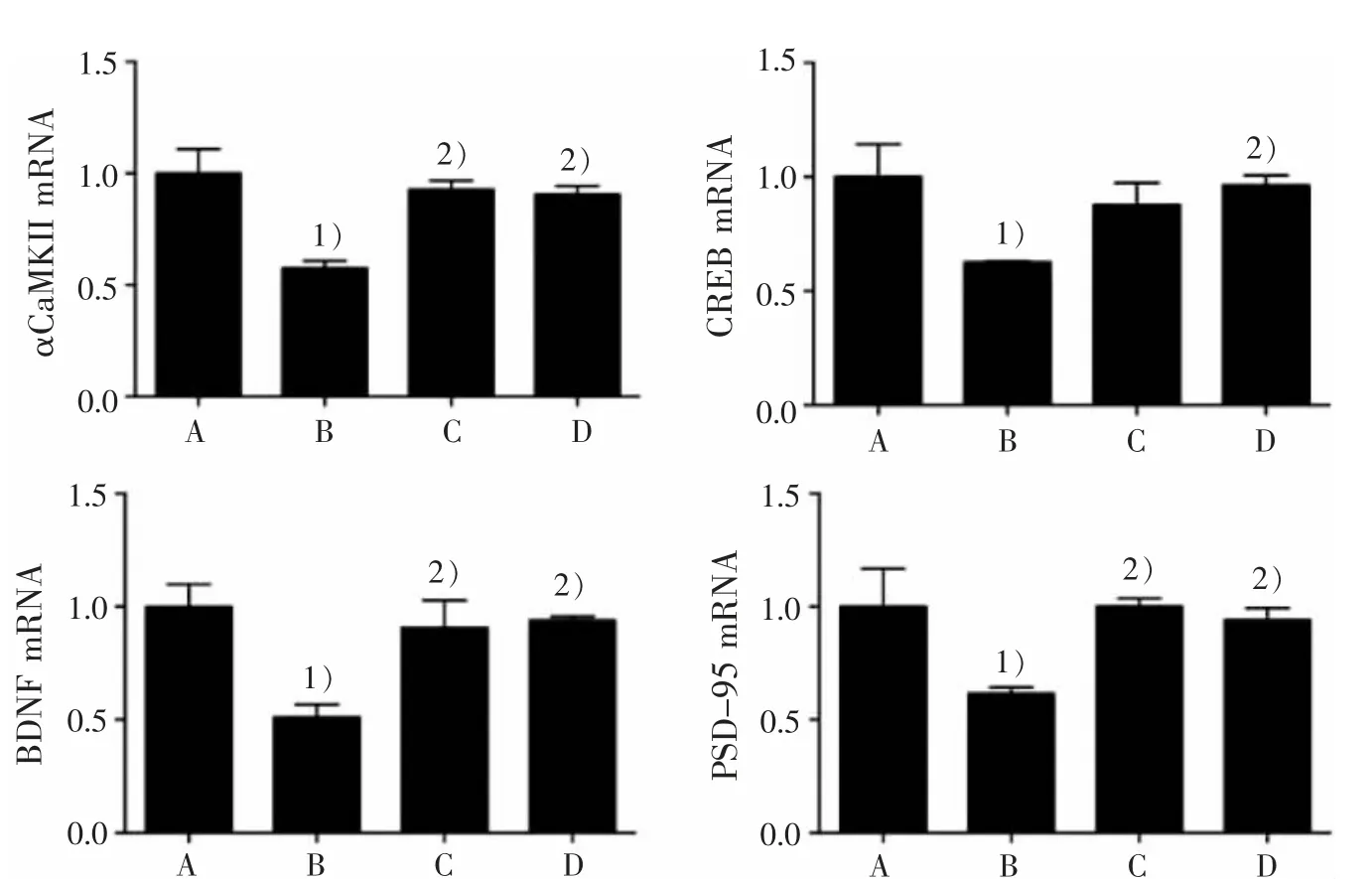
图 4 4 组海马区 p-αCaMKII,p-CREB,BDNF 和 PSD-95 的蛋白表达比较Figure 4 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression of the hippocampus in four groups
此外,本研究还发现,与正常组比较,6 月龄的APP/PS1 双转基因 AD 小鼠海马 PSD-95 蛋白和mRNA 表达明显降低;与模型组比较,调心方组小鼠海马区的PSD-95 mRNA 和蛋白表达明显提高。这说明APP/PS1 双转基因AD 小鼠脑内有突触可塑性受损的现象,LTP 受到抑制;经过调心方治疗后PSD-95 的蛋白活性和基因表达明显提高,LTP 抑制得到改善,突触可塑性提高,从而改善学习和记忆能力。 突触后致密物在突触可塑性中具有重要作用,PSD-95 蛋白通过与突触后致密区多种蛋白分子的相互作用,起到了调节突触可塑性的功能,它在LTP 的形成及维持过程、突触可塑性、学习记忆等方面具有关键性的作用[16]。APP /PS1 双转基因 AD小鼠海马PSD-95 蛋白活性明显降低,PSD-95 异常表达会导致LTP 受到抑制,进而诱发突触可塑性发生改变,使AD 小鼠出现依赖海马的学习记忆功能的缺陷,这与魏鹏[17]的研究结果一致。
4.2 调心方能够调节APP/PS1 双转基因AD 小鼠海马αCaMKⅡ-CREB-BDNF 信号通路水平
αCaMKⅡ通过Thr286 位点自身磷酸化成为活化状态,它的激活是其突触功能调节及学习记忆的结构基础[18],是 LTP 形成的重要介质,对实现信息的储存具有重要作用。 Ca2+进入细胞内与CaM 结合形成Ca2+-CaM,能够活化CaMKI,磷酸化后的αCaMKⅡ可以直接活化 CREB[19]。 CREB 是 LTP 产生的重要调节因子,CREB 缺失会导致LTP 出现明显损伤[20],它位于 133 位点的丝氨酸残基(Ser133)的磷酸化对多种与学习记忆相关的基因转录起着重要作用。BDNF 是CREB 的经典下游靶基因,其基因启动子区域含有CRE 序列,CREB 可与CRE 序列结合,引起 BDNF 的转录增加[21],BDNF 是 LTP 和突触传递重要的调节器之一,在突触可塑性、长时记忆的形成等方面起到重要作用。
本研究结果显示,与正常组比较,模型组海马p-αCaMKⅡ、p-CREB、BDNF 蛋白水平和 αCaMKⅡ、CREB 和BDNF mRNA 明显降低,这与模型组PSD-95 表达、LTP 受到抑制的结果相互印证;与模型组比较,调心方组海马 p-αCaMKⅡ、p-CREB、BDNF蛋白水平和 αCaMKⅡ、CREB 和 BDNF mRNA 表达明显提高。 这提示,调心方组能有效改善APP/PS1双转基因AD 小鼠海马αCaMKⅡ-CREB-BDNF 信号通路水平。 调心方可能通过激活αCaMKⅡ,上调了αCaMKⅡ的磷酸化蛋白水平及αCaMKⅡmRNA表达,进而激活其下游的CREB,使得CREB 磷酸化水平及CREB mRNA 表达增加,促进其下游BDNF的基因转录和蛋白合成,提高 BDNF mRNA 和BDNF 蛋白表达;BDNF 表达增加可在αCaMKⅡ的翻译过程中上调PSD-95 磷酸化水平,引起TrkB 对BDNF 的敏感性增加,从而激活 CREB-BDNF 信号通路,使突触可塑性发生改变,提高LTP,从而改善突触可塑性及学习记忆能力。 这与ESCOBAR 等[22-23]等研究结果一致。
5 小 结
调心方能够改善APP/PS1 双转基因AD 小鼠海马CA1 区 LTP、提高PSD-95 mRNA 和蛋白的表达,从而改善APP/PS1 双转基因AD 小鼠学习记忆功能和突触可塑性,其作用机制可能与其上调海马αCaMKⅡ-CREB-BDNF 信号通路水平有关。

