阳和汤对兔膝骨关节炎木瓜蛋白酶模型IL-1、TNF-α 的影响
洪振强,高弘建,何俊君,黄泽灵
福建中医药大学中医学院,福建 福州 350122
骨关节炎(Osteoarthritis,OA)是一种以关节疼痛、僵硬、功能受限甚至关节畸形、残废为主要表现的骨科常见病,目前中国已有超过 1 亿 OA 患者[1]。药物是治疗骨关节炎的主要手段之一,临床多采用非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)等为主的西药进行治疗,虽可暂时缓解关节疼痛、改善功能,但无法修复受损的关节软骨、阻止OA 进一步发展,长期服用此类药物还会出现胃溃疡、胃出血、肝肾损害等不良反应。 中医药可以修复损伤的软骨组织和细胞,从而保护关节软骨,防治骨关节炎具有疗效可靠、价格低廉、不良反应少的特色与优势[2]。阳和汤源自清代王洪绪《外科证治全生集》,原为治疗外科阴疽证的经典方剂,现在广泛应用于内科杂症,特别是痹证,为攻补兼备、刚柔相济之治痹良方。 有研究表明,阳和汤治疗膝骨关节炎的临床疗效明显,可有效缓解膝关节疼痛,改善膝关节功能[3-6]。 但是,有关阳和汤防治骨关节炎具体作用机制的研究还较少,也不够深入,值得进一步探讨。 因此,本研究通过建立兔膝骨关节炎木瓜蛋白酶模型并予阳和汤灌胃,以探讨阳和汤防治骨关节炎的作用及其作用机制。
1 实验材料
1.1 实验动物
选择健康新西兰兔32 只,4~6 月龄,体质量(2.25±0.25)kg,雌雄各半,由福建中医药大学实验动物中心代购并饲养[许可证号:SCXK(闽)2012-0001]。按照随机数字表法分为对照组、模型组、阳和汤组、筋骨痛消丸组,每组8 只。 动物处理参照中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》,并经福建中医药大学动物伦理委员会审核批准。
1.2 主要仪器、药品及试剂
生物组织包埋机(湖北省宏业医用仪器有限公司,BM-Ⅶ);石蜡切片机(美国 Thermo 公司,HM315);低温高速离心机(美国BECKMAN 公司,64R);酶联免疫检测仪(美国Biotek 公司,Elx808);光学显微镜(日本 Olympus 公司,BX40);酶标仪(美国 Biotek 公司,Elx808)。
阳和汤由福建中医药大学国医堂提供,采用清代王洪绪《外科证治全生集》原方(熟地黄30 g,鹿角胶 9 g,麻黄 2 g,白芥子 6 g,肉桂 3 g,姜炭 2 g,生甘草 3 g),煎煮后制成浓度 1 g/mL 的溶液,55 mL/剂;筋骨痛消丸(河南省洛正制药厂,生产批号:Z10970117),由丹参、桂枝、香附、地黄、白芍、牛膝、秦艽等药物组成,以蒸馏水配制成浓度1 g/mL的溶液,36 mL/盒;木瓜蛋白酶(美国 Sigma 公司,生产批号:107147);兔白细胞介素-1(interleukin-1,IL-1)酶联免疫检测试剂盒(上海西唐生物科技有限公司,生产批号:F20190);兔肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫检测试剂盒(上海西唐生物科技有限公司,生产批号:F2041);戊巴比妥钠(国药集团化学试剂有限公司,生产批号:WS20060401);0.9%NaCl 注射液(北京天坛生物制品股份有限公司);4%多聚甲醛、EDTA 脱钙液(上海国药集团)。
2 实验方法
2.1 动物模型制备
新西兰兔适应性饲养2 周后,除对照组外,其余各组膝关节腔注入木瓜蛋白酶造模。 选兔双膝为手术部位,耳缘静脉麻醉(戊巴比妥钠,30 mg/kg)后仰卧固定,常规备皮、消毒、铺巾。 轻度弯曲兔膝关节,从关节的正中间或者关节的两侧进针,手下出现落空感则表示针头进入了关节腔,随后可往关节腔内注入0.5 mL 1.6 %木瓜蛋白酶生理盐水溶液,每隔3 d 注射1 次,共注射3 次。每日定时分2 次于空旷场地驱赶,共强迫兔活动30 min,连续驱赶4 周。
2.2 干预方法
造模成功4 周后,参照“人和动物体表面积折算的等效剂量比率表”进行换算。 筋骨痛消丸具有活血行气、温阳通经、消肿止痛的作用,阳和汤与筋骨痛消丸均可有效缓解膝骨关节炎患者局部疼痛肿胀,疏利关节,临床效果显著。 因此本研究选择筋骨消痛丸作为阳性对照。 阳和汤组按 6 g/(kg·d)的量给予阳和汤灌胃,筋骨痛消丸组按 6 g/(kg·d)的量给予筋骨痛消丸灌胃,以上2 组均给药1 次/d,连续用药5 周。 对照组、模型组常规饲养,无其他特殊处理。 停药1 周后,经腹腔麻醉后取材,耳缘静脉空气栓塞处死全部动物。
2.3 取材
2.3.1 取材前准备 取材前12 h 动物禁食不禁水,麻醉后取材。
2.3.2 血清采集 采用腹主动脉采血法。 打开兔腹腔,分离腹主动脉,一次性采血针取血5 mL,待血液静置分层后,低温高速离心机(4 ℃,3 000 r/min)离心20 min,取血清,-80 ℃冰箱保存。
2.3.3 关节液采集 兔髌骨内缘行纵行切口,由皮肤向下逐层分离至关节囊,反复屈伸关节将关节液挤压至髌上囊内侧,轻轻划开关节囊,注入1.5 mL生理盐水反复抽吸后将关节液尽量抽出,低温高速离心机(4 ℃,15 000 r/min)离心 15 min,取上清液,-80 ℃冰箱保存。
2.3.4 软骨组织采集 切开兔膝关节囊,分离软组织后快速切取股骨内髁,粗修后于4%多聚甲醛中固定24 h,10% EDTA 脱钙完全后修切,常规石蜡包埋后切片。
2.4 指标及检测方法
2.4.1 软骨组织形态学观察 取上述的软骨组织石蜡切片,常规脱蜡后,分别进行苏木素-伊红染色:苏木素染液20 min,10%盐酸酒精分色3 s,自来水返蓝20 min,0.5%伊红染液5 s。 染色完成后均采用95%乙醇、无水乙醇脱水,二甲苯透明,光学树脂固封。 光镜下对组织结构进行观察及图像采集。
2.4.2 软骨损伤程度评价 采用 Mankin's 评分标准[7-8]评价软骨的损伤程度。 见表 1。
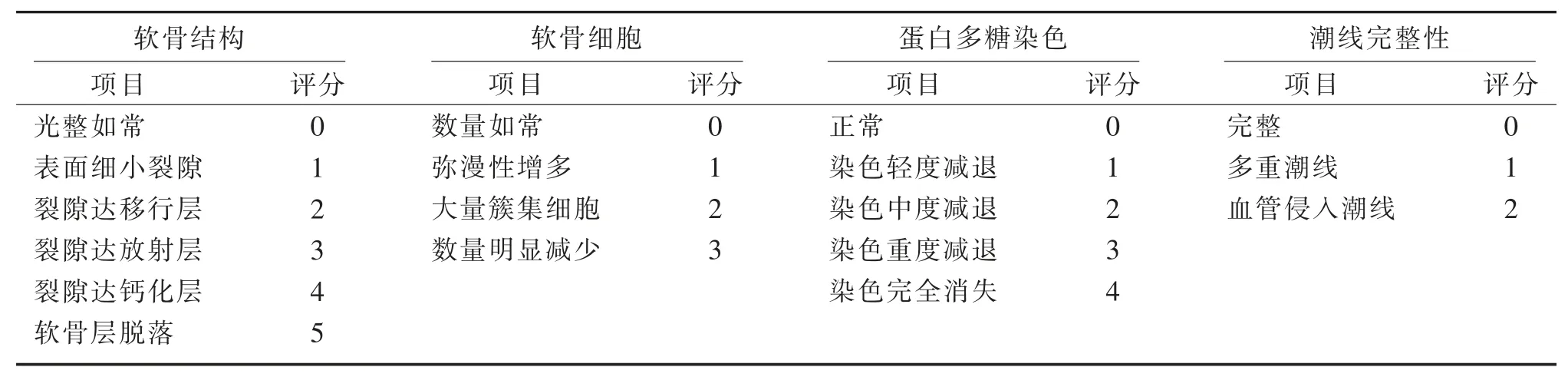
表1 Mankin's 评分标准Table 1 Mankin's score
2.4.3 血清及关节液中白细胞介素-1、肿瘤坏死因子-α 含量检测 运用酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)检测血清及关节液中 IL-1、TNF-α 含量。 方法及步骤如下:按照ELISA 试剂盒的操作步骤依次操作,以酶标仪(波长450 nm)读取A 值,绘制标准曲线并计算各样品的 IL-1、TNF-α 浓度。
2.5 统计学方法
3 结 果
3.1 4 组实验情况
实验期间各给药组新西兰兔精神状态好,排便、体温和皮毛等未见异常,其体质量、进食量与对照组基本一致。 实验过程动物无死亡。
3.2 4 组软骨组织形态学比较
3.2.1 4 组软骨组织肉眼观察 ① 对照组:股骨内侧髁关节软骨色泽鲜红,表面光滑,无软骨破坏和骨赘形成。②模型组:股骨内侧髁软骨无光泽,局部凹凸不平,可见软骨缺损及骨赘形成。③阳和汤组:股骨内侧髁软骨表面欠光滑,可见轻微软骨缺损和骨赘形成,其程度明显较模型组轻。 ④筋骨痛消丸组:股骨内侧髁软骨表面欠光泽,缺损和骨赘较模型组轻。 见图1。
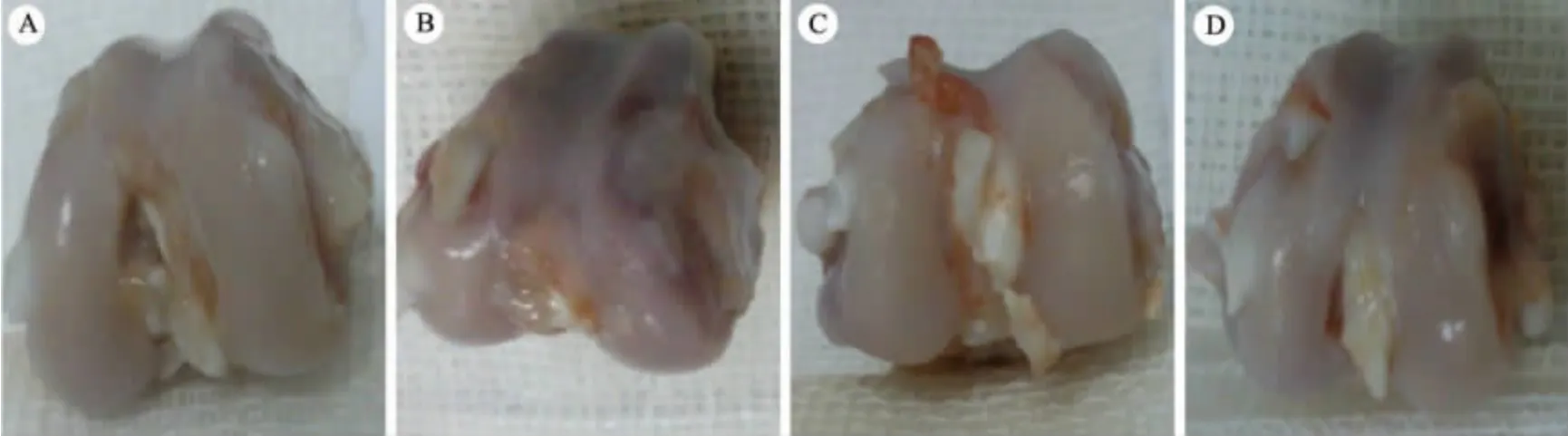
图1 肉眼观察关节软骨结构Figure 1 Observation of articular cartilage structure with naked eyes
3.2.2 4 组软骨组织光镜观察 ① 对照组:软骨表面光滑、完整,软骨组织的4 层结构(表浅层、移行层、辐射层、钙化层)分层清晰,软骨细胞成柱状排列,分布均匀,潮线清晰完整。 ② 模型组:软骨表面不光滑,出现多个裂隙及缺损,软骨结构分层不清,且细胞数量减少、分布不均匀,可见细胞簇集,潮线紊乱消失。③阳和汤组:软骨表面较光滑,软骨细胞比模型组排列整齐,软骨细胞增多,可见少量软骨细胞簇集现象,潮线较模型组清晰、完整。④筋骨痛消丸组:软骨表面光滑,细胞排列尚整齐,可见软骨细胞簇集现象,潮线清晰、完整程度较模型组好。
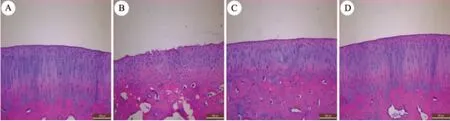
图2 光镜观察关节软骨病理显微结构(石蜡切片-HE 染色)(×100)Figure 2 Observation of pathological microstructure of articular cartilage by light microscopy(Paraffin-HE staining)(×100)
3.3 4 组关节软骨形态学改变Mankin’s 评分比较
见表2。
3.4 4 组血清及关节液中IL-1、TNF-α比较
见表3。
4 讨 论
4.1 阳和汤能有效修复骨关节炎的软骨损伤
骨关节炎以关节疼痛、肿胀、活动受限甚至关节畸形为临床症状,以关节软骨退变和继发性骨质增生为病理特点。 木瓜蛋白酶关节内注射动物模型与人类骨关节炎类似[9],呈现出早期骨关节炎的病理改变。 本研究运用木瓜蛋白酶关节内注射法建立兔骨关节炎模型,采用苏木素-伊红染色方法在光镜下观察软骨组织,软骨形态学及Mankin's 评分结果显示,模型组的软骨表面出现多个裂隙及缺损,软骨结构分层不清,且细胞数量减少、分布不均匀,可见细胞簇集,潮线紊乱消失,与对照组比较Mankin's评分明显升高。 而经过阳和汤干预后,兔膝关节软骨形态及Mankin's 评分均明显改善,这表明阳和汤能有效修复骨关节炎的软骨损伤。
表2 4 组关节软骨形态学改变Mankin's 评分比较()Table 2 Comparison of Mankin's score in morphological change of articular cartilage in four groups ()
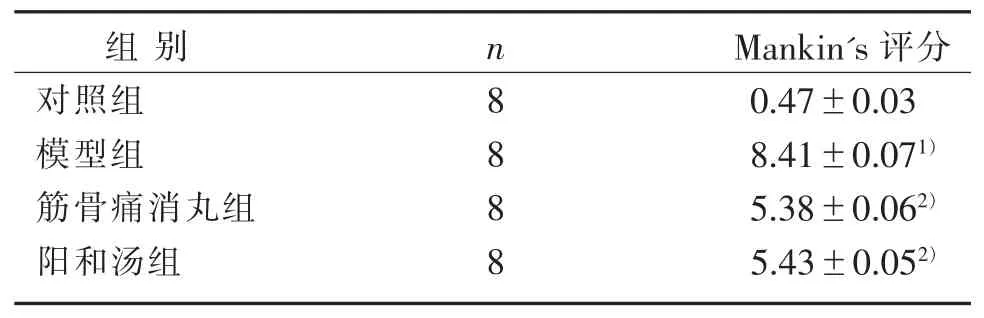
表2 4 组关节软骨形态学改变Mankin's 评分比较()Table 2 Comparison of Mankin's score in morphological change of articular cartilage in four groups ()
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the control group, 1) P<0.05; Compared with the model group, 2) P<0.05.
Mankin's 评分0.47±0.03 8.41±0.071)5.38±0.062)5.43±0.052)组别对照组模型组筋骨痛消丸组阳和汤组n 8 8 8 8
表 3 4 组血清及关节液中 IL-1、TNF-α 比较()Table 3 Comparison of IL-1 and TNF-α in serum and articular fluid in four groups()
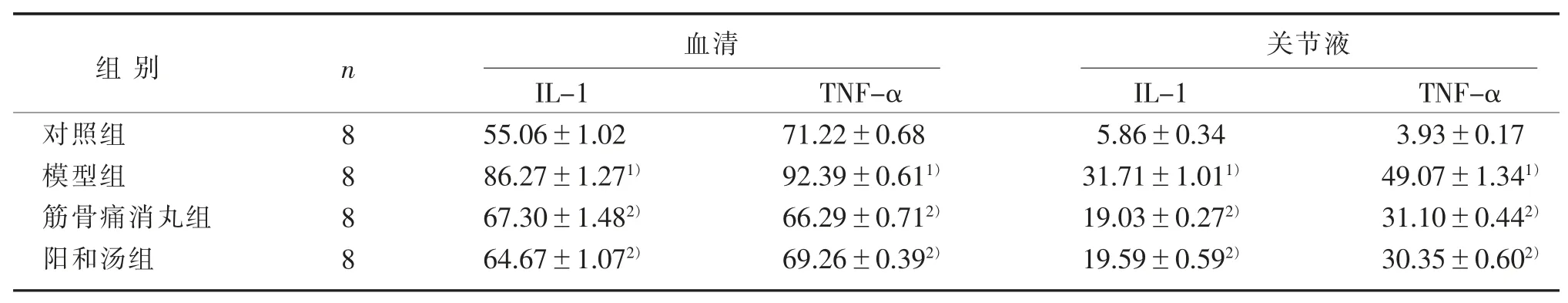
表 3 4 组血清及关节液中 IL-1、TNF-α 比较()Table 3 Comparison of IL-1 and TNF-α in serum and articular fluid in four groups()
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the control group, 1) P<0.05; Compared with the model group, 2) P<0.05.
血清 关节液IL-1 55.06±1.02 86.27±1.271)67.30±1.482)64.67±1.072)组别对照组模型组筋骨痛消丸组阳和汤组n 8 8 8 8 TNF-α 71.22±0.68 92.39±0.611)66.29±0.712)69.26±0.392)IL-1 5.86±0.34 31.71±1.011)19.03±0.272)19.59±0.592)TNF-α 3.93±0.17 49.07±1.341)31.10±0.442)30.35±0.602)
中医学认为,骨关节炎属于“骨痹”范畴,“本”乃肝肾亏虚、正气不足,“标”乃风、寒、湿邪、血虚寒凝[10]。 因此,骨关节炎的治疗应遵循“急则治痹痛,缓则补肝肾、益气血”的原则,并随风寒湿痰随证加减[11]。 阳和汤方中熟地黄温补营血,鹿角胶温阳、益精血,二药合用,温阳补血;姜炭、肉桂药性辛热,共奏温阳散寒、温通血脉之功;白芥子辛温,可达皮里膜外,温化寒痰,通络散结;麻黄辛温达卫,宣通毛窍,开腠理,散寒凝;甘草解毒而调和诸药。 可见,阳和汤堪为攻补兼备、刚柔相济之治痹良方。
4.2 阳和汤能有效调控IL-1、TNF-α等炎性因子
骨关节炎以关节软骨破坏和骨重建为特征,其发病机制尚不明确,研究发现涉及多因素、多机制、多环节。其中,有研究显示IL-1、TNF-α 与骨关节炎关系密切[12-13],这些炎性因子在骨关节炎患者中明显升高[14-15],与骨关节炎的严重程度呈正相关[16-17],是骨关节炎重要的致病因素,可多方位介导关节软骨退变,导致关节软骨破坏[18-19]。
本研究运用ELISA 法检测血清及关节液中IL-1、TNF-α 含量,结果表明模型组血清及关节液中IL-1、TNF-α 的表达与对照组比较明显升高,而阳和汤组血清及关节液中IL-1、TNF-α 的表达较模型组比较明显降低,这提示阳和汤能够调控IL-1、TNF-α 等炎性因子,促进骨关节炎患者损伤的软骨组织修复。
5 小 结
阳和汤可促进关节软骨修复,延缓关节软骨退变,其作用机制可能与抑制IL-1、TNF-α 这些炎性因子的表达有关。

