APP/PS1 小鼠不同时期灰质体积变化与Aβ 沉积和学习记忆功能的相关性分析
张宇豪 ,金 昊 ,张秀峰 ,梁胜祥 ,柳维林 ,陶 静 ,2,陈立典 ,2,3,4*
1 福建中医药大学康复医学院,福建 福州 350122;2 福建省康复技术协同创新中心,福建 福州350122;3 康复医疗技术国家地方联合工程研究中心,福建 福州350122;4 国家中医药管理局中医康复研究中心,福建 福州350122
阿尔茨海默病(Alzheimer's disease,AD)作为痴呆类疾病中发病率最高的疾病[1-2],其临床表现主要为学习记忆功能逐渐受损以及一般认知损伤症状,病理变化特征包括大脑体积萎缩、β-淀粉样蛋白(amyloid β-protein,Aβ)沉积、神经纤维缠结以及神经元凋亡等[3]。 据统计,2015年全球痴呆症患者约4 680 万,每年新增 1 000 万病例,2017 年仅美国就有 550 万成年人患有 AD[4]。 因此,探究 AD 的发病机制,将有可能为临床防治AD 提供可靠的理论依据。
大脑皮层灰质是人类思维活动的物质基础,是大脑神经元聚集部位,调控机体各种活动的最高中枢。 有研究指出,内嗅皮质(entorhinal cortex,EC)和海马(hippocampus,HP)是大脑参与学习记忆的关键结构[5-6]。 AD 患者大脑核磁共振成像结果显示,其灰质体积只有正常受试者的70%~80%,萎缩明显[7]。 AD 患者大脑内 Aβ 的产生会导致老年斑的形成、神经纤维的缠绕及神经元的死亡,并随着时间的推移导致痴呆[8]。 APP /PS1 转基因小鼠动物模型是探究AD 病变机制常用的双转基因模型之一,目前关于APP/PS1 灰质体积变化与学习记忆功能的下降以及其Aβ 沉积的关系仍缺少较为完善的证据,因此本研究通过小动物磁共振扫描观察APP/PS1 小鼠灰质体积变化特征,并采用Th-s 荧光染色检测其Aβ 沉积,探讨APP/PS1 小鼠灰质体积变化与学习记忆功能和Aβ 沉积之间的相关性,为该AD动物模型的病理特征及干预性实验研究提供可靠的行为学和影像学依据。
1 材料与方法
1.1 实验动物
本实验共纳入野生组(wild type,WT)和 APP/PS1 组 2 组小鼠,每组 36 只。 WT 组小鼠选用 C57-BL/6 小鼠,APP/PS1 组选用 APP/PS1 双转基因小鼠,2 组均分别由 2、6、12 不同月龄小鼠组成, 每组每个月龄小鼠12 只。 分批购买于南京大学南京生物医药研究院[批号:SCXK(苏)2015-0001]。 实验前,通过聚合酶链式反应(polymerase chain reaction,PCR)鉴定每组不同月龄小鼠DNA 基因型,然后在福建中医药大学实验动物中心SPF 级实验室饲养。所有动物实验程序均按国家标准进行并经学校动物实验伦理委员会批准。
1.2 主要实验试剂和设备
Th-s 抗荧光衰减封片剂(中国索莱宝有限公司,S2110);免疫荧光检测试剂盒(上海一基实业有限公司,YJ1012576);异氟烷(中国 RWD 生命科技有限公司,1602801);多聚甲醛(中国 Biosharp 生物科技有限公司,BL539A);Morris 水迷宫(中国上海市欣软信息科技有限公司,XR-XM101);7.0T 小动物磁共振仪(德国布鲁克科技有限公司,70/20 USR);徕卡荧光显微镜(德国LEICA 公司,DFC425C)。
1.3 实验方法
1.3.1 Morris 水迷宫测试 Morris 水迷宫为直径120 cm 的圆形水池,共分为4 个象限,其中东南角为象限1,顺时针以此类推。 迷宫水深30 cm 左右,逃生平台放置在3 象限, 为一直径5 cm 的透明原型平台,保持其在水面下2 cm 左右。 水迷宫上方正中配置1 个摄像头,记录小鼠游泳轨迹,为方便镜头精确捕捉小鼠影像,在迷宫水面铺洒1 层白色塑料颗粒使水面与实验灰黑色小鼠形成颜色对比。 实验开始后,拉上水迷宫四周围帘,以免外界光线干扰摄像机记录小鼠游泳画面。 Morris 水迷宫分别通过前4 d 的定位航行实验和第5 天的空间探索实验检测2 组小鼠以空间为参考的学习记忆功能。
Morris 水迷宫定位航行实验共进行4 d,通过小鼠寻找到逃生平台的时间,检测2 组小鼠的空间记忆学习能力。 第1 天,将小鼠从水迷宫第1 象限内侧壁放入水中,测试90 s,其找到逃生平台的时间即为此次逃避潜伏期,若90 s 内仍未找到,则逃避潜伏期记为90 s,并引导其找到逃生平台,休息,适应学习平台所在位置15 s,然后从第2 象限放入,4个象限依次进行定位航行测试。 第2 天从第2 象限放入,以此类推共进行4 d。 第5 天进行空间探索实验测试,实验开始前,去掉第3 象限的逃生平台。 每只小鼠均从第1 象限放入,测试90 s,通过记录比较其穿越原逃生平台所在位置的次数,检测其空间学习记忆的提取能力。
1.3.2 磁共振T2 加权成像扫描 采用7.0T 磁共振(magnetic resonance imaging,MRI)进行 T2 加权成像(T2-weighted imaging)扫描。扫描前,用 1.5%的异氟烷对小鼠进行麻醉,同时监测呼吸情况,体感线圈为激发线圈,表面线圈为接收线圈。 检测结束,用ITK-SNAP 软件分析对应灰质体积。
1.3.3 Th-s 荧光染色检测 使用3.0%异氟烷混合纯氧将小鼠麻醉,从腹部向上打开胸腔,然后用止血钳轻微夹住心脏,灌注针刺破左心室,依次灌注生理盐水和4%多聚甲醛,待小鼠全身抽搐、僵硬后断头取出完整脑组织放入多聚甲醛中,24 h 后进行石蜡包埋切片。用0.125%的 Thioflavine-s 溶液避光浸泡8 min。 磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗 3 次,5 min/次,然后用封片剂封片,最后在显微镜下拍摄。 分析2 组不同月龄小鼠大脑双侧内嗅皮质和海马内的Aβ 沉积情况。
1.4 统计学方法
2 结 果
2.1 2 组小鼠学习记忆功能Morris 水迷宫检测结果比较
见图 1、表 1 和图 2、表 2。
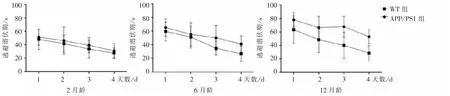
图1 2 组小鼠逃避潜伏期Figure 1 Escape labency periods between two groups
表1 2 组小鼠逃避潜伏期比较() 秒Table 1 Comparison of escape latency between two groups ()s
注:与 WT 组同月龄小鼠比较,1) P<0.05。Note: Compared with WT group at the same month, 1) P<0.05.
组别WT 组APP /PS1 组月龄2 6 12 2 6 12 n 12 12 12 12 12 12第1 天48.41±15.13 59.76±13.81 63.70±20.78 51.52±11.86 65.41±12.63 78.36±11.01第2 天41.93±12.73 51.41±16.03 48.68±19.07 46.35±20.21 55.42±17.12 66.70±16.711)第3 天33.89±13.29 35.13±10.16 40.29±19.54 39.48±11.04 50.38±18.201)68.10±15.381)第4 天27.87±7.55 26.87±11.38 28.71±11.19 31.19±10.99 41.25±11.971)53.12±10.771)
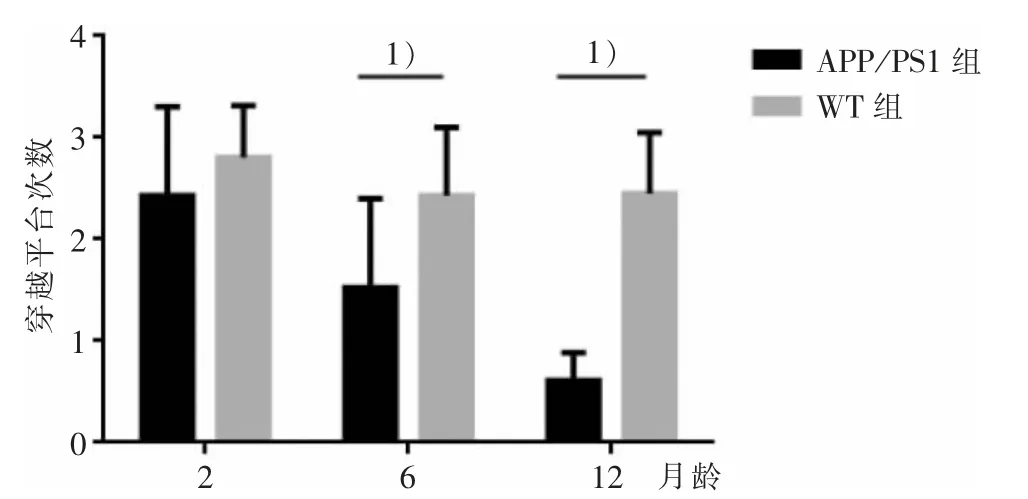
图2 2 组穿越平台次数Figure 2 Times of crossing the platform between two groups
表 2 2 组穿越平台次数比较() 次Table 2 Comparison of times of crossing the platform between two groups ()times
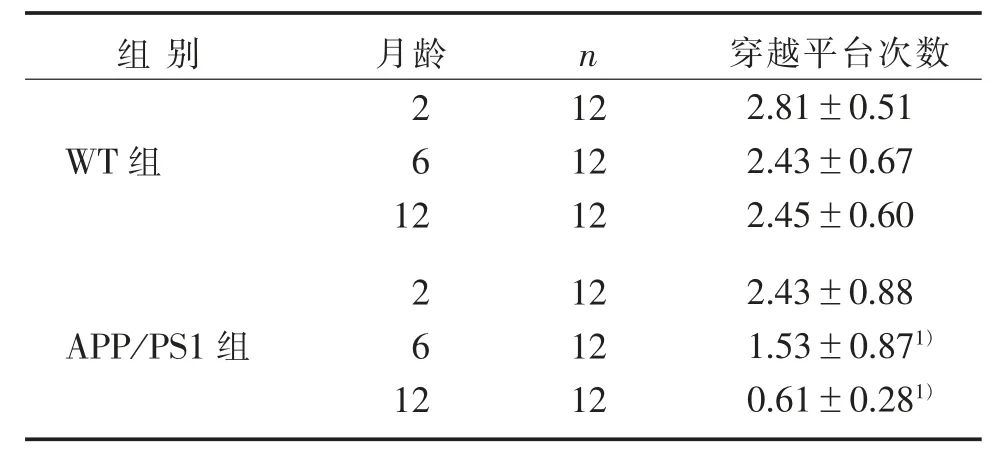
表 2 2 组穿越平台次数比较() 次Table 2 Comparison of times of crossing the platform between two groups ()times
注:与 WT 组同月龄小鼠比较,1) P<0.05。Note:Compared with WT group at the same month,1)P<0.05.
组别 月龄n WT 组2 6 12 APP /PS1 组2 6 12 12 12 12 12 12 12穿越平台次数2.81±0.51 2.43±0.67 2.45±0.60 2.43±0.88 1.53±0.871)0.61±0.281)
2.2 2 组小鼠灰质体积T2W1 扫描检测结果比较
见表3。
表 3 2 组小鼠灰质体积比较()Table 3 Comparison of gray matter volume between two groups ()mm3
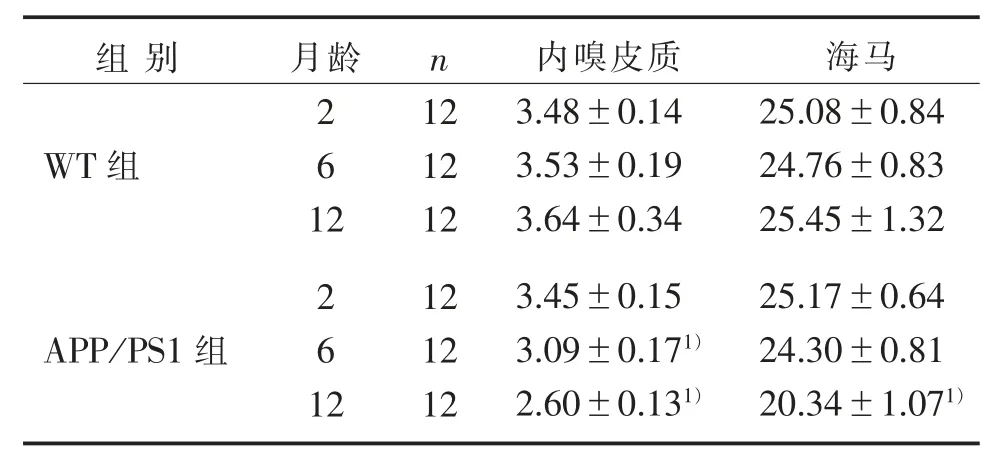
表 3 2 组小鼠灰质体积比较()Table 3 Comparison of gray matter volume between two groups ()mm3
注:与 WT 组同月龄小鼠比较,1) P<0.05。Note:Compared with WT group at the same month,1)P<0.05.
组别 月龄n WT 组2 6 1 APP /PS1 组2 2 6 1 2 12 12 12 12 12 12内嗅皮质3.48±0.14 3.53±0.19 3.64±0.34 3.45±0.15 3.09±0.171)2.60±0.131)海马25.08±0.84 24.76±0.83 25.45±1.32 25.17±0.64 24.30±0.81 20.34±1.071)
2.3 2 组小鼠Aβ 沉积结果比较
对2 组小鼠大脑切片进行Th-s 荧光染色后,Aβ 沉积呈白色高密度荧光斑块,见图 3。 其中,2 组小鼠2 月龄时脑内均未检测出 Aβ 沉积;APP/PS1组小鼠6 月龄内嗅皮质和海马即可检测到少量 Aβ沉积,而到12 月龄则可检测出大量致密Aβ 斑块。此病理性斑块仅集中于海马和内嗅皮质,其他脑区分布较少。 统计分析斑块数量,结果见表4、图4。
2.4 APP/PS1 小鼠灰质体积变化与学习记忆能力的相关性分析结果
相关性分析结果显示,APP/PS1 小鼠的灰质体积萎缩与其对应的逃避潜伏期和穿越平台次数分别呈负相关和正相关关系,见图5、图6。
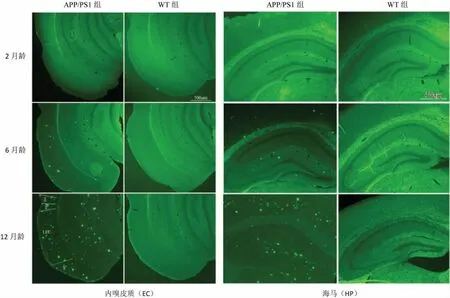
图3 2 组小鼠脑区Aβ 沉积情况Figure 3 Aβ deposition in brain area of mice between two groups
表 4 APP/PS1 小鼠 6 月龄和 12 月龄 Aβ 斑块结果比较()Table 4 Comparison of Aβ plaque of APP/PS1 group at 6 and 12-month-old ()

表 4 APP/PS1 小鼠 6 月龄和 12 月龄 Aβ 斑块结果比较()Table 4 Comparison of Aβ plaque of APP/PS1 group at 6 and 12-month-old ()
注:与 6 月龄 APP/PS1 组小鼠比较,1) P<0.05。Note: Compared with APP/PS1 group at the 6th month,1) P<0.05.
海马区12.42±1.96 28.26±3.641)月龄6 月龄12 月龄n 12 12内嗅皮质区13.25±2.01 33.86±3.611)
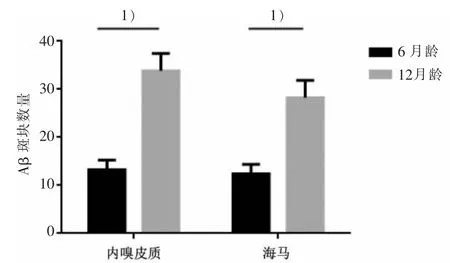
图 4 APP/PS1 小鼠 6、12 月龄 Aβ 斑块结果比较Figure 4 Comparison of Aβ plaque of APP/PS1 group at 6 and 12-month-old
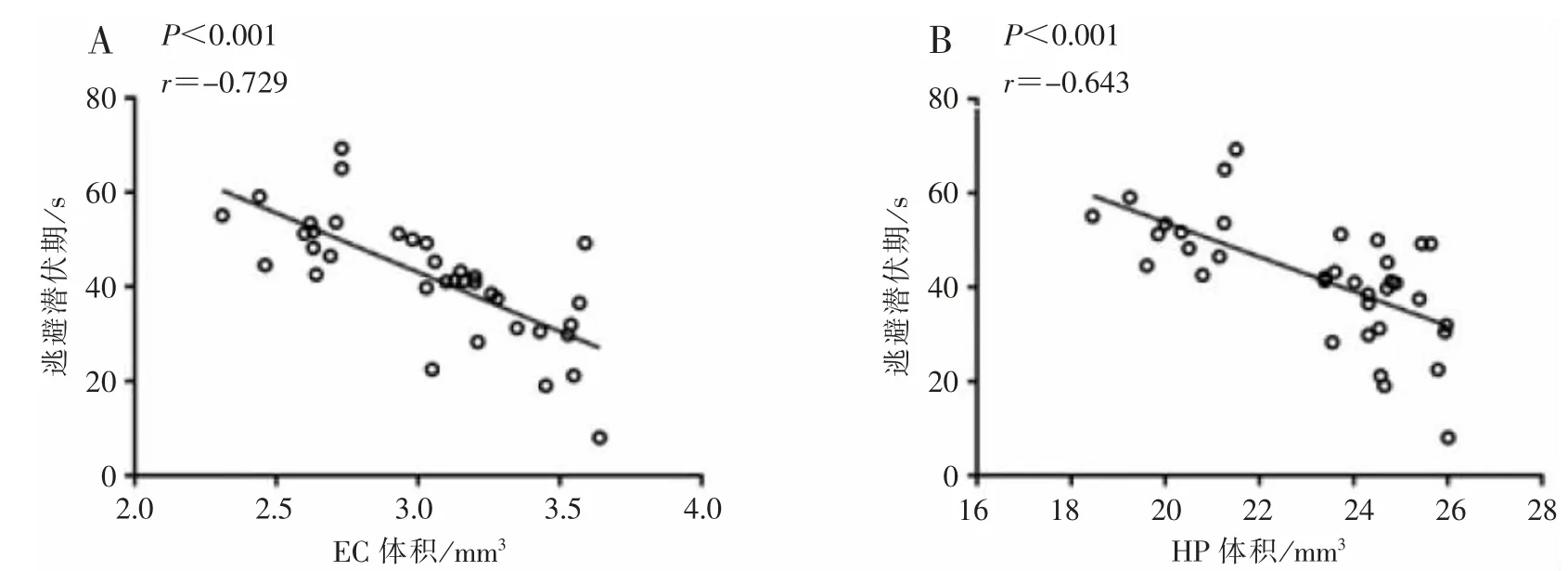
图5 APP/PS1 小鼠灰质体积变化与逃避潜伏期的相关性分析Figure 5 Correlation analysis between changes in gray matter volume and escape latency in APP/PS1 group
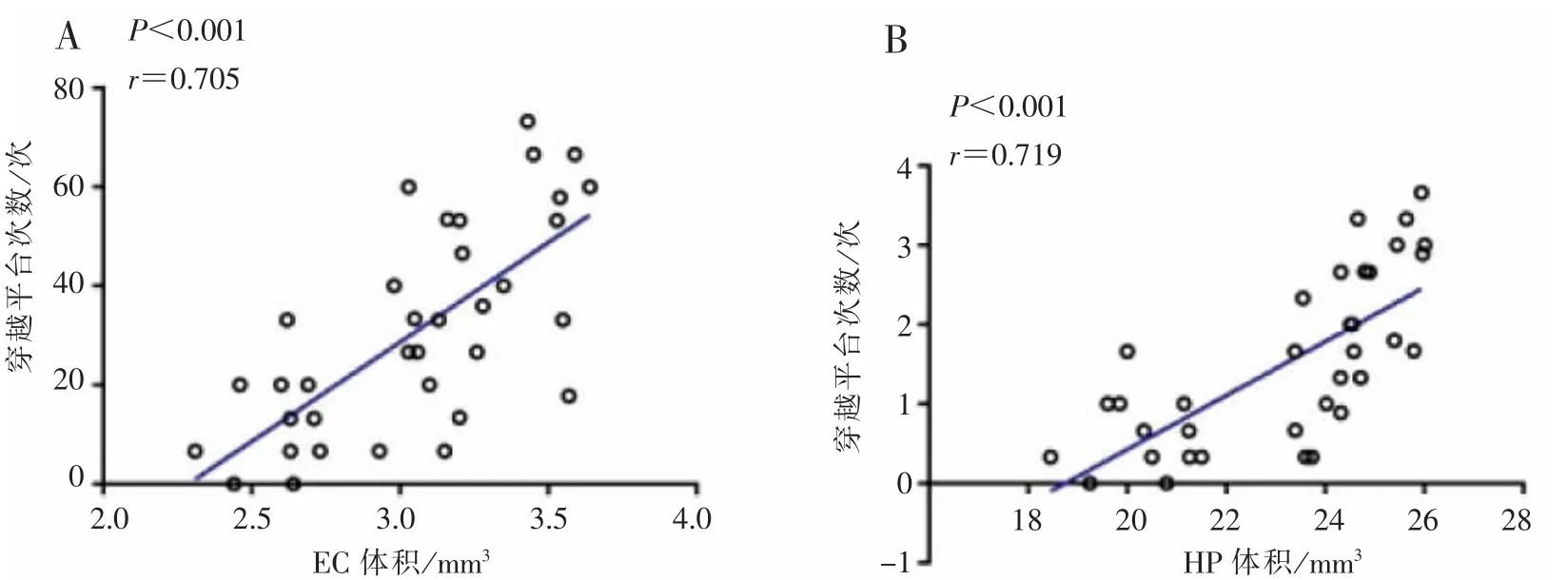
图6 APP/PS1 小鼠灰质体积变化与穿越平台次数的相关性分析Figure 6 Correlation analysis betweer changes in gray matter volume and the number of crossing platforms in APP/PS1 group
2.5 APP/PS1 小鼠灰质体积变化与Aβ 沉积相关性分析
见图7。
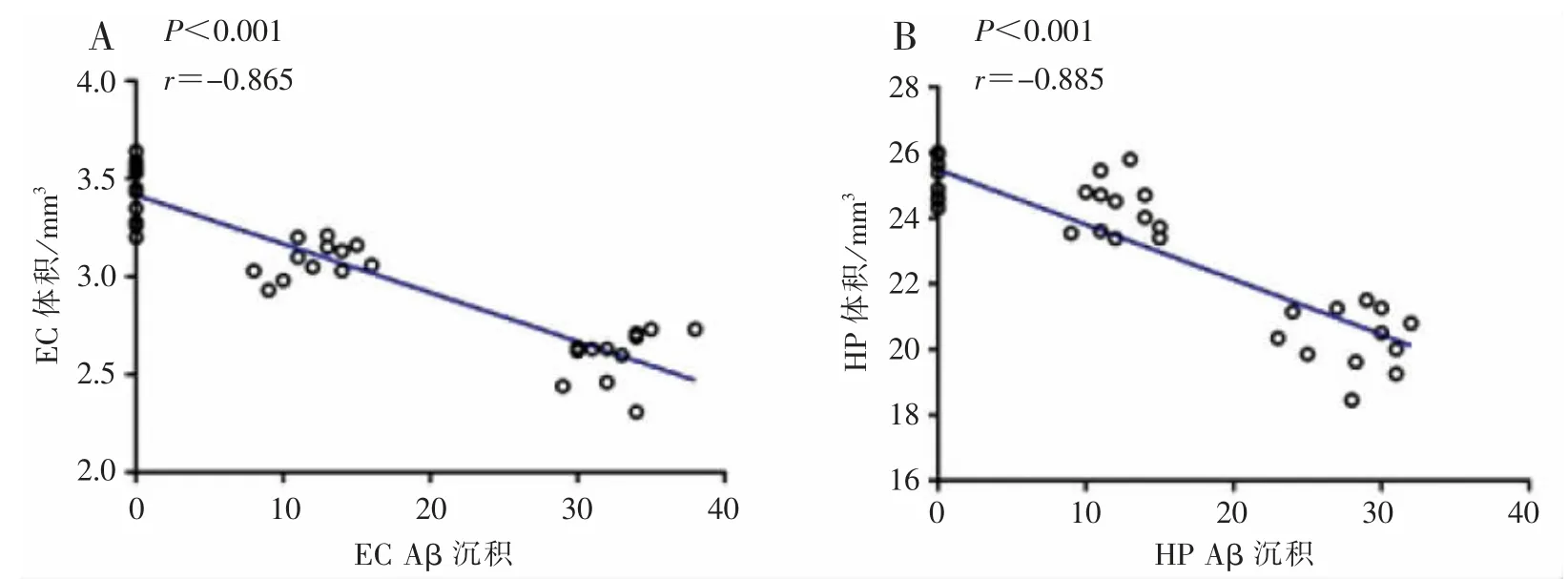
图 7 APP/PS1 小鼠内嗅皮质、海马体积与其 Aβ 沉积的相关性分析Figure 7 Correlation analysis between the entorhinal cortex and hippocampus volume and Aβ deposition in APP/PS1 group
3 讨 论
本研究采用APP/PS1 双转基因模型小鼠作为AD 模型组,APP/PS1 双转基因小鼠携带与早发AD相关的人类淀粉样前体蛋白瑞典型突变基因(APPSW)和外显子 9 缺失的 PS1 基因(PS1 dE9),同WT 组实验小鼠一致,均具有C57-BL/6 背景。C57BL/6 小鼠的生命周期大致可分为幼年期、成年期、中年期和老年期,分别对应1~3 月龄、3~6 月龄、10~15 月龄和 18~24 月龄[9-10]。 多数研究证实,APP/PS1 小鼠在6 月龄即会表现出学习记忆功能障碍,并出现神经退行性改变[11-12],为探究 APP/PS1小鼠发病特征及其早期病变表现,本实验分别选取2 月龄、6 月龄和12 月龄即小鼠幼年期、成年期与中年期进行实验。
3.1 APP/PS1 转基因小鼠学习记忆功能障碍可能发生于6 月龄
Mirros 水迷宫实验结果显示,与WT 组比较,APP/PS1 组2 月龄小鼠的行为学检测结果无明显区别,提示APP/PS1 小鼠早期无学习记忆功能障碍的表现。 与 WT 组同月龄比较,APP/PS1 组小鼠 6月龄时逃避潜伏期明显增高,穿越平台次数明显降低,且APP/PS1 组12 月龄时这种差异表现得更加显著,表明APP/PS1 小鼠的空间学习记忆功能障碍可能发生于6 月龄,且12 月龄时出现加重的情况,这与 TASDEMIR 等[13-14]研究结果一致。 这提示,对于该AD 模型的干预性实验研究可以选择在更早的时间采取干预措施以预防AD 的进展。
3.2 大脑灰质进行性萎缩可能导致AD 小鼠学习记忆功能障碍
本研究T2WI 序列扫描结果显示,与WT 组比较,APP/PS1 组6 月龄小鼠内嗅皮质体积明显缩小,12月龄小鼠内嗅皮质和海马体积也均明显萎缩,提示APP/PS1 小鼠大脑灰质具有时间进行性萎缩的病理表现。 这与AD 患者早期阶段常出现的包括内嗅皮质和海马在内的脑实质萎缩,且内嗅皮质和海马的损伤程度常最为严重的研究结果一致[15-16]。 内嗅皮质和海马是保证空间学习记忆功能正常的2 个重要脑区,内嗅皮质和海马体积萎缩,导致空间学习记忆的定位与导航功能失常,引起AD 患者早期出现情景记忆损伤的情况[17-21]。 AD 患者脑区病理性变化最早出现的是内嗅皮质,而后逐渐累及海马和大脑新皮质[22-24]。 内嗅皮质、海马和海马旁回在内的内侧颞叶萎缩,被认为是AD患者灰质体积变化的主要特征[25]。 本研究结果显示,APP /PS1 组6 月龄小鼠海马体积未发生明显变化,这与REDWINE 等[26]研究发现 PDAPP 小鼠在 3~4 月龄时即出现海马体积减少的结果不一致,这可能是由于核磁扫描序列参数、AD 模型小鼠的遗传背景以及海马体积的检测方法不同所导致的。
此外,APP/PS1 组小鼠大脑灰质体积萎缩与其相应月龄的学习记忆功能相关性分析结果显示:学习记忆功能与其灰质体积的进行性萎缩呈显著负相关关系,大脑灰质体积萎缩越厉害,AD 学习记忆功能障碍越严重,这提示,AD 学习记忆功能障碍可能是由大脑灰质萎缩所导致。 这与有研究显示AD患者内嗅皮质[27]、海马体积[28]的萎缩程度与其认知功能具有一定相关性的研究结果一致。
3.3 Aβ 过度沉积可能导致AD 大脑灰质萎缩
本研究通过免疫荧光检测2 组不同月龄小鼠Aβ 沉积情况,研究结果显示,与 WT 组比较,APP/PS1 组6 月龄小鼠大脑内开始出现Aβ 沉积,到12月龄时AD 小鼠Aβ 沉积进一步增加,这表明,随着月龄的增加AD 小鼠脑组织中Aβ 沉积逐渐增多。这提示,脑组织中Aβ 沉积是AD 患者的主要病理表现之一,它可能是导致AD 患者出现进行性记忆功能障碍的最初诱因,这与HAASS 等[29-30]研究结果一致。
相关性分析结果显示,AD 小鼠灰质体积与其相应脑区的Aβ 沉积程度呈负相关关系,即灰质体积越小,Aβ 沉积越多。 这表明高水平的 Aβ 沉积和加剧的脑萎缩是AD 小鼠神经退行性的主要表现,这提示Aβ 沉积、灰质体积萎缩是认知功能障碍的主要原因之一。 这与 JACK 等[31-35]研究显示脑组织内出现Aβ 沉积,其大脑海马和皮质的萎缩程度也更高的结果一致。 有研究显示,AD 模型小鼠大脑内的Aβ 沉积可能与神经元丢失和突触减少有关,其可能诱导大脑灰质体积萎缩性及营养不良性神经元[36-37],但有关于其具体作用机制的研究还较少,还有待于包括大脑神经功能连接以及分子生物学水平等方面在内更深入的研究。
4 小 结
本研究证实APP/PS1 小鼠存在时间依赖性的学习记忆功能障碍,且随时间呈渐进性加重,这可能与大脑灰质进行性萎缩有关;AD 大脑灰质体积萎缩与Aβ 沉积有明确的相关性,Aβ 过度沉积可能是AD 大脑灰质体积萎缩的主要因素之一,但其具体机制尚未明确,今后还需进一步深入研究,探明具体作用机制为临床防治AD 提供依据。

