长链非编码RNA XIST海绵miR-34通过Wnt/β-catenin信号通路促进结肠癌进展的机制
洪 森,李世权,刘 涛,康振华
(吉林大学第一医院 结直肠肛门外科,吉林 长春130021)
结肠癌是癌细胞在结肠组织中形成的最常见的恶性肿瘤之一。作为世界第三大最常见的癌症和第二大癌症相关死亡原因[1],结肠癌的发病率和死亡率在中国逐渐增加,2015年新增病例376,300例,死亡191,000例[2]。目前,结肠癌患者的标准治疗方法包括手术、放疗和化疗或联合治疗[3]。尽管在治疗技术方面取得了巨大进步,但由于复发和转移,结肠癌的5年生存率仍然低于40%[4]。阐明结肠癌的侵袭机制,探索结肠癌治疗的潜在新靶点势在必行。作为一类非编码RNAs,长非编码RNAs(lncRNAs)被定义为长度大于200个核苷酸,在多种细胞过程中发挥重要作用,如调节基因表达、翻译后加工和肿瘤发生[5]。LncRNAs X-inactive 特异性转录体(XIST),来自XIST基因,是哺乳动物X染色体转录沉默的主要调控者[6]。先前的研究已经证实XIST在多种癌症中起到了肿瘤调节剂的作用,如胶质母细胞瘤[7]、乳腺癌[8]、卵巢癌[9]、肝细胞性肝癌[10]。尽管如此,XIST 在结肠癌中的作用仍然不清楚。
MicroRNAs是一种短的内源性非编码分子(大约19-23个核苷酸长度),通过与靶基因的3’-未翻译的区域(3’-UTRs)结合来调节基因表达,在维持稳态方面起着重要作用[11]。目前,人们普遍认为 miRNAs在肿瘤发育过程中可能充当癌基因或抑制基因[12]。对miR-34a 的功能性研究已经证明它可以抑制结肠癌的增殖和转移[13]。竞争性内源性RNA(ceRNA)假说证明,lncRNAs作为miRNA海绵来调节miRNA靶基因的表达,从而参与癌症的进展。然而,XIST能否与 miR-34a 相互作用调节结肠癌的发生发展还有待于进一步阐明。
因此,本研究的目的是调查XIST在结肠癌进展中的表达水平,并探讨其可能的机制。
1 材料与方法
1.1 一般资料
本研究的对象为人类结肠癌组织和相应的非肿瘤组织。
1.2 实验方法
1.2.1病人和组织样本 所有患者均获得知情同意,本研究经吉林大学第一医院医学伦理委员会批准。在2017年3月至2019年2月期间进行初次手术切除的患者中,获得了人类结肠癌组织和相应的非肿瘤组织(n=120)。手术后,标本立即冷冻在-80℃以备进一步使用。参与研究的患者的特征见表1。

表1 结肠癌患者XIST表达与临床参数的相关性
1.2.2细胞培养和转染 人结肠癌细胞系(SW480,Lovo,HCT116 与 HT29)和正常结肠上皮细胞系NCM460均购自中国科学院细胞库(上海,中国)。所有细胞均在含有10% 胎牛血清((FBS公司,美国)和1% 青霉素/链霉素的Dulbecco’s Modified Eagle’sMedium 中(DMEM,Gibco,USA))培养基,在湿润、含5% CO2的37℃培养箱中培养。将SW480和HCT116细胞接种于平板,按照生产厂家的规定,使用 Lipofectamine 2000试剂(Invitrogen,Carlsbad,MA,USA)转染 si-XIST,miR-34a 抑制剂或其阴性对照(NCs)。
1.2.3细胞活力测定 细胞(3×103)培养于96孔板中,培养24 h,用0.5 mg/mLMTT染色24 h。去除上清液,加入200 μl二甲基亚砜(DMSO)溶解沉淀。用酶联免疫吸附测定仪在490 nm 处测定每个孔的光密度(OD值)。
1.2.4菌落形成试验 在集落形成实验中,将细胞种植到密度为5×103的6孔板中。然后,细胞在37℃培养,加入5%CO2,培养2周。最后用4% 多聚甲醛固定菌落,用0.1% 结晶紫染色30 min。然后,用光学显微镜计算菌落数。
1.2.5细胞迁移试验 将密度为1×105的细胞分别接种于含1% FBS的培养基上腔。下腔室用10% FBS培养基充填。培养24 h后,上表面粘附的细胞被去除,迁移至下室的细胞用0.1% 结晶紫染色。
1.2.6实时定量PCR分析 根据制造商的说明书,用trizol 试剂(中国上海)从细胞中提取总RNA。利用反转录试剂盒(takara biotechnology,中国大连)合成了互补DNA(cDNA)。用定量PCR方法测定cDNA的相对数量,用2-ΔΔCt方法计算GAPDH基因的相对表达水平。
1.2.7荧光素酶报告分析 将含 miR-34a结合位点的XIST和WNT1的3’-UTR分别扩增并克隆到pGL3-基本荧光素酶载体(Promega,美国)中。细胞接种于培养皿中,并根据制造商的规定,将相关的寡核苷酸(XIST和WNT1野生型或突变型报告载体miR-34a 模拟或阴性对照)与脂质体2000试剂混合,用双荧光素酶报告系统(Promega,Madison,美国)转染24 h后检测荧光素酶活性。用Renilla 荧光素酶作为内参照物。
1.2.8Western blotting分析 培养细胞用冰冷的PBS洗涤,在添加蛋白酶抑制剂的RIPA缓冲器中溶解。蛋白样品经电泳后,与从Abcam Campany购买的一抗(anti-WNT1,anti-β-catenin,anti-MMP7,anti-cyclinD1,anti-cMyc,1∶1000稀释)孵育。样品与辣根过氧化物酶结合的次级抗体孵育。用Imagej 软件量化。
1.2.9动物实验 5周龄雄性BALB/C裸鼠(体重18±2 g),日/夜循环22-24℃,日/夜循环12 h。皮下异种移植实验方法:将感染 si-NC或 si-XIST的SW480细胞(5×105)皮下注射于小鼠右侧(n=6只/组)。每5天检查一次肿瘤体积,计算公式为:体积=0.5×长×宽×高。注射后25天,安乐死处死动物,测量肿瘤重量。动物实验获得吉大一院动物伦理委员会批准。
1.3 数据处理

2 结果
2.1 XIST 在结肠癌组织中表达上调,与预后不良有关
为了研究XIST在结肠癌进展中的作用,我们使用qRT-PCR检测了XIST在结肠癌组织和癌旁正常组织中的表达显示XIST在结肠癌组织中的表达高于癌旁组织(图1A)。图1B显示每例患者XIST表达水平(结肠癌组织标本)的倍数变化。我们将120名患者分为高表达组(n=68)和低表达组(n=52)(表1)。结果显示XIST上调与晚期TNM分期、淋巴管及远处转移呈正相关(图1C、表1)。但XIST升高与患者性别、年龄、肿瘤大小及分化程度无相关性(表1)。Kaplan-Meier 总生存率曲线和对数秩检验表明,XIST水平高的患者总生存率低于XIST水平低的患者(图1D)。总之,XIST在结肠组织中表达上调,与预后不良相关,提示XIST在结肠癌中的致癌作用。

图1 结肠癌组织中 xist 表达上调,与预后不良相关
2.2 XIST 基因敲除对结肠癌细胞增殖和侵袭的抑制作用
我们发现4株结肠癌细胞系的XIST表达水平与正常细胞系相比上调(表2)。为了验证XIST基因在结肠癌发生发展中的作用,通过siRNA转染SW480和HCT116细胞,建立了稳定的XIST基因沉默体系(表3)。MTT测定XIST基因沉默对两种细胞株的增殖均有抑制作用(表4)。集落形成实验表明,XIST沉积可以诱导两个细胞系形成集落少于对照细胞。转录抑制实验表明,XIST沉默抑制了细胞的入侵能力。

表2 不同细胞系中XIST相对表达量
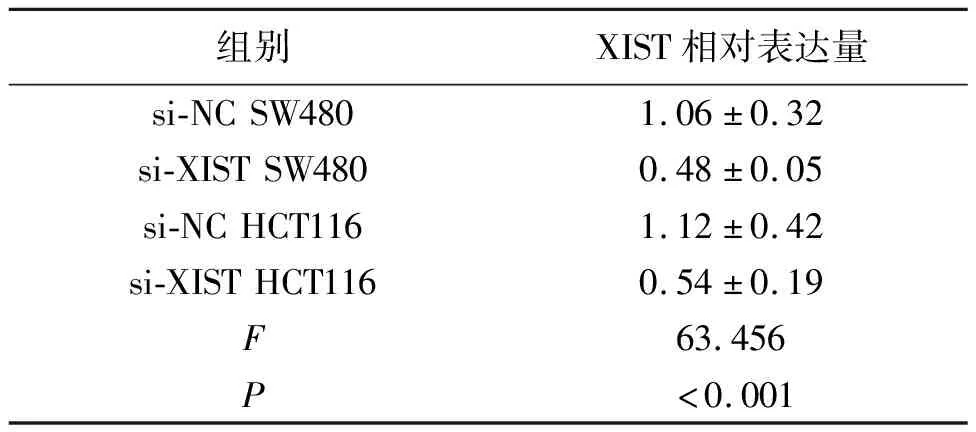
表3 体外转染SW480和HCT116细胞系的siRNA建立了XIST沉默表达结果
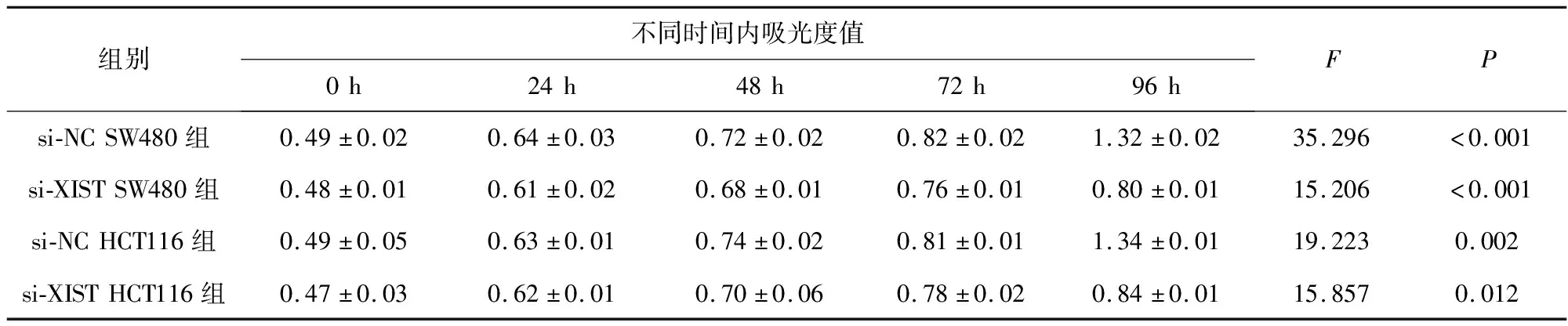
表4 在两个细胞系中si-XIST转染细胞的生长速度
2.3 XIST作为miR-34的分子海绵
越来越多的证据表明,lncRNA可以像海绵一样与特定的miRNA结合。利用生物信息学分析方法预测了小分子与XIST结合的候选靶点发现XIST的3’UTR与miR-34a 结合的程度非常保守。与邻近正常组织样本相比,结肠癌组织中miR-34a水平降低。与正常细胞相比,4株结肠癌细胞株miR-34a的表达水平降低。荧光素转运体实验证实了在 miR-34模拟物和XIST野生型中荧光强度降低的结合。荧光素酶报告分析证实了miR-34a抑制剂和XIST野生型的荧光增强结合。此外,si-XIST 转染细胞后,miR-34a表达上调,而 miR-34a抑制剂可逆转这一过程。MTT实验表明,miR-34a抑制剂能够缓解si-XIST对细胞增殖的抑制作用。细胞集落形成实验和transwell实验表明,miR-34a抑制剂能够缓解si-XIST对两个细胞集落数和迁移数的抑制作用。
2.4 miR-34a 直接以WNT1的3’-UTR为目标
我们使用生物信息学分析检测了miR-34a的计算预测目标。结果显示WNT1的3’端高度保守,与miR-34a 结合。WNT1水平在结肠癌组织中高于相邻正常组织。WNT1表达水平在4株结肠癌细胞系中高于正常细胞系。荧光素酶报告基因测定表明,转染miR-34a可抑制细胞的相对荧光素酶活性,提示miR-34a 对 WNT1表达与WNT1的3’-UTR相互作用具有抑制作用。如图2,表5所示,在 mRNA和蛋白水平上,在SW480细胞中miR-34a水平的过度表达下调WNT1表达。总的来说,miR-34a通过与3’-UTR结合,抑制WNT1的表达。

表5 WNT1灰度值测定结果

图2 WNT1 mRNA及蛋白表达结果
2.5 XIST沉默抑制Wnt/β-catenin 信号通路
转染组与对照组相比,48 h WNT1和β-catenin 表达有统计学差异,si-XIST抑制WNT1和β-catenin的表达,miR-34a抑制剂可逆转WNT1和β-catenin的表达。c-Myc、cyclinD1和MMP-7的表达在PCR和western blot检测中有统计学差异,它们是β-catenin 的靶基因。si-XIST能抑制c-Myc、cyclinD1和MMP-7的表达,这些表达都是由miR-34a抑制剂调节的。
2.6 XIST基因敲除抑制结肠癌生长的实验研究
为了进一步确定XIST在体内是否影响肿瘤发生,我们将si-NC或si-XIST转染的SW480细胞注射到裸鼠体内。与si-NC组相比,si-XIST组显示肿瘤体积、肿瘤大小和重量减少(肿瘤体积变化如表6所示),表明XIST抑制肿瘤在体内的生长,提示XIST过表达促进了结肠癌的进展。

表6 肿瘤体积变化(mm3)
3 讨论
结肠癌是东西方国家最常见的癌症,每年影响超过一百万人[14]。虽然近年来癌症诊断和治疗的进展改善了临床结果,但结肠癌患者的预后仍然令人沮丧。许多非编码RNAs(ncRNAs)与结肠癌的发生密切相关[15]。作为ncRNAs的一个重要成员,lncRNAs已被报道在结肠癌的发展和进展中发挥了关键作用[16]。Lncrnaxist 是重要的沉默一个X染色体在女性的发展[17]。许多研究表明XIST基因的异常表达会导致人类癌症[18]。然而,XIST在结肠癌中的作用和机制尚不清楚。本研究发现,XIST在结肠癌组织中的表达高于癌旁组织,且XIST上调与晚期TNM分期、淋巴管及远处转移呈正相关。但XIST升高与患者性别、年龄、肿瘤大小及分化程度无相关性。Kaplan-Meier 总生存率曲线和对数秩检验表明,XIST水平高的患者总生存率低于XIST水平低的患者。总之,XIST在结肠组织中表达上调,与预后不良相关,提示XIST在结肠癌中的致癌作用。
LncRNAs对常见的miRNAs起着海绵的作用,并消除了这些miRNAs对其靶向转录本的内源性抑制作用[19]。利用生物信息学预测程序,我们发现XIST基因3’UTR与miR-34a结合高度保守。si-XIST转染细胞后,miR-34a表达上调。而miR-34a 抑制剂可以缓解si-XIST对结肠癌细胞增殖的抑制作用,这些数据表明,它可以通过靶向miR-34a来调节结肠癌细胞的增殖。
WNT/β-catenin信号途径的异常表达可能与结肠癌的发病有关[20]。作为信号通路的中枢效应器,β-catenin向细胞核的转位导致生长和侵袭相关基因的表达,如 cyclinD1和 c-Myc[21]。生物信息学分析表明miR-34a与WNT1的3’-UTR密切相关。此外,miR-34a的过度表达可降低WNT1 mRNA及相关蛋白的表达。si-XIST抑制了WNT1和β-catenin 的表达,miR-34a抑制剂逆转了这两种表达。c-Myc、cyclinD1和 MMP-7的表达在PCR和western blot检测中存在统计学差异,它们是β-catenin的靶基因。si-XIST对miR-34a抑制剂挽救的c-Myc、cyclinD1和MMP-7表达有抑制作用,这表明XIST通过激活WNT/β-catenin 信号通路调节结肠癌细胞的增殖和侵袭。
综上所述:XIST通过WNT/β-catenin信号通路在miR-34a 靶向的结肠癌进展中起重要作用,为结肠癌的发病机制和潜在治疗靶点提供了新的认识。

