缺血性脑卒中患者抵抗阿司匹林干预与GP1BA基因多态性关系的探讨
杨秀峰,刘 净,乔 馨,赵 敏,杨冬梅
(大庆油田总医院,黑龙江 大庆163000)
随着人口老龄化脑卒中发生率逐年上升,脑卒中已成为我国目前导致人类死亡的第二位原因。缺血性卒中(IS)发病率占脑卒中60%-80%[1],并具有高发病率、高复发率、高致残率以及高死亡率等临床特征。对于IS的抗血小板聚集治疗,已经被写进多个国家的脑卒中防治指南。在心脑血管病一级和二级预防中已经开始广泛使用阿司匹林作为抗血小板药物[2],但5%-45%[3]的患者存在阿司匹林抵抗(AR)[4]。阿司匹林的主要作用是阻断血栓素A2生成,而对于血小板活性没有完全抑制效应[5]。另外,由于长期应用阿司匹林可以对部分个体带来不良反应,进一步降低了阿司匹林的临床治疗作用。为了进一步提高阿司匹林个体精准治疗效果,人们试图寻找与阿司匹林治疗相关的基因位点进行疾病治疗效果预测,指导临床治疗。而血小板糖蛋白受体(GP1BA)与血小板功能有关,其编码基因又具有功能多态性,因此,为了探讨阿司匹林抵抗的分子生物学机制,以及为IS患者个体化抗血小板治疗提供新思路,我们对126例IS患者的GP1BA基因多态性及治疗后的血小板抑制率进行了检测,探讨其与IS患者阿司匹林抵抗的关系。
1 资料与方法
1.1 研究对象
选取2018年1月-2018年12月在黑龙江省大庆油田总医院住院的缺血性脑卒中患者126例。所有患者均详细记录相关资料——性别、年龄、吸烟史、既往史(BMI)以及合并症等。纳入标准:①年龄≥18岁;②性别不限;③具有急性缺血性脑卒中体征,且经颅脑CT或MRI影像学检查证实,该诊断标准与《中国缺血性脑卒中诊疗指南2014》符合;④口服阿司匹林(100 mg/1次/天,拜耳公司100 mg/片)抗血小板治疗作为脑卒中二级预防。排除标准:①年龄<18岁;②心源性脑梗死;③出血性脑梗死;④接受免疫抑制剂或低分子肝素抗凝药物治疗的患者,服用影响血小板功能类药物,阿司匹林过敏,出血倾向,血液疾病,消化性溃疡病史;⑤急慢性感染性疾病以及严重心、肝、肾等多脏器功能障碍或衰竭;⑥恶性肿瘤、癫痫等神经系统疾病。纳入患者对本研究均知情同意,符合医学伦理程序。
1.2 研究方法
1.2.1GP1BA基因多态性检测 应用荧光原位杂交技术,使用济南广音医疗科技有限公司实时荧光PCR仪,检测入选患者GP1BA基因多态性。EDTA抗凝管采集静脉血2 ml,2-8℃保存,72 h内使用。检测方法按照试剂盒说明书标注的操作方法进行。根据检测结果GP1BA存在3种基因亚型CC、CT、TT。据报道,在亚洲人群中CC、CT、TT基因型的频率分别为71.8%、25.9%、2.30%[6],CC基因型患者对阿司匹林的应答相对较弱。CT和TT基因型患者对阿司匹林的应答相对较强,故按照CC基因型以及CT+TT基因型将患者分为两组。
1.2.2血小板抑制率测定 应用血栓弹力图(TEG)对两组基因型患者于连续给药7 d后晨起采集血样标本均予AA途径测定其血小板抑制率。使用BD FACSCantoⅡ流式细胞仪(美国BD公司),分别于枸橼酸钠抗凝管静脉采血3 ml、肝素抗凝管静脉血5 ml,于2 h内测试。主要检测血小板在凝血酶诱导激活形成的血凝块强度(MAth),缺少凝血酶对照组和血小板激活组的纤维蛋白网强度(MAfib),以及血小板被激活剂激活的血凝块强度(MAADP),然后采用血小板抑制率公式进行计算抑制率:血小板抑制率=(MAADP-MAfib)/(MAth-MAfib)×100%。依据我院血栓弹力图(血小板图AA)试剂(凝固法)使用说明书制定评定标准。
1.2.3观察指标 通过检测二组患者(CC基因亚型组及CT+TT基因亚型组)的血小板抑制率,分析缺血性脑卒中患者阿司匹林抵抗与不同GP1BA基因亚型的相关性。
1.3 统计学方法

2 结果
2.1 患者一般资料
本研究共纳入126例患者其中男性78例,女性48例年龄范围65-80岁。其中合并高血压病73例(57.9%),糖尿病38例(14.6%),高血脂49例(38.9%),吸烟65例(51.6%)。根据GP1BA基因型检测结果CC基因亚型组78例(61.9%),CT及TT基因亚型组48例(38.1%)。表1显示两组患者的一般临床资料(性别、年龄、吸烟、BMI)以及合并疾病(高脂血症、高血压、糖尿病),统计学分析两组患者间各指标无明显差异(P>0.05)。
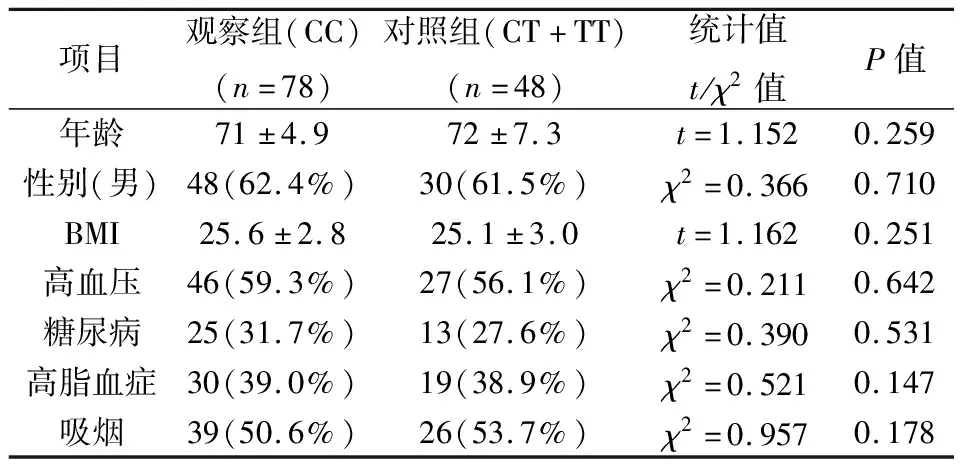
表1 两组患者一般资料比较
2.2 GP1BA基因多态性与血小板抑制率
依据我院血栓弹力图(血小板图AA)试剂(凝固法)测定血小板抑制率结果,判定抗血小板聚集疗效,同时提出临床建议(表2)。对本研究所纳入的126例患者治疗后血小板抑制率与GP1BA基因多态性进行比较分析,结果显示CC基因型组血小板抑制率低于CT+TT基因型组(表3),两组间具有统计学差异(P<0.05)。

表2 血小板抑制率、药效及临床建议
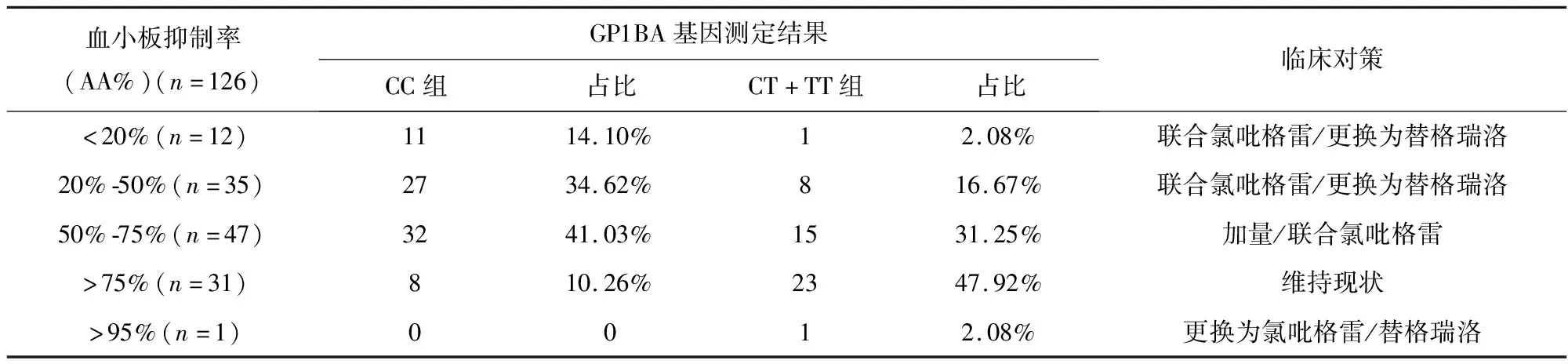
表3 血小板抑制率与GP1BA基因多态性
3 讨论
AIS是神经系统的常见疾病之一,也是一种需要长期管理的疾病,给患者家庭乃至整个社会带来巨大的疾病与经济负担。AIS复发率高致残风险大,因此预防卒中复发显得极为重要。缺血性脑卒中的二级预防药物以抗血小板药物最为基础,而且也是至今为止应用最广泛、研究也最多的一类药物,临床上应用的抗血小板药物有替格瑞洛、氯吡格雷以及阿司匹林等。其中阿司匹林的预防应用最多,但在临床实践中阿司匹林抵抗(AR)为治疗提出了挑战。AR发生机制复杂,发生的确切原因还不明确。因此,考虑其形成原因可能是多因素综合作用,其机制可能与阿司匹林使用剂量;患者对药物的依从性;是否同时应用非甾体消炎药或质子泵抑制剂等导致阿司匹林的远期疗效抵[7-9],以及基因多态性、血小管旁路激活等多素因素具有相关性。基因多态性表现为药物代谢酶转运蛋白和作用靶点具有多态性,是药物抵抗的一个重要因素。有研究表明,花生四烯酸相关代谢途径(AA)可更易诱导血小板聚集故血小板聚集事件发生增加[10]。
GP1BA基因是阿司匹林的靶点基因之一。GP1BA基因编码血小板表面膜糖蛋白(GPIb),是由二硫键连接的α和β亚基组成的异二聚体。GpIb作为血管性血友病因子(VWF)的受体,其α和β亚基可与血小板糖蛋白Ⅸ、血小板糖蛋白V非共价结合形成完整的受体复合物。GPIb-IX-V,GPIb-IX-V复合物与VWF结合促进血管损伤后初始血小板与血管内皮下膜的粘附,并且还启动血小板内信号传导,增强血小板活化、止血或形成血栓。研究显示,GP1BA(5792 C>T)T等位基因携带者可增加对阿司匹林的应答[11]。本研究结果,126例患者CC基因亚型组78例(61.9%),CT及TT基因亚型组48例(38.1%)。CC组血小板抑制率低于CT+TT组,提示GP1BA基因的多态性考虑与阿司匹林抵抗存在相关性。临床可参考上述相关性,给予患者更加个体化、精确化抗血小板治疗。
本研究的局限性在于纳入研究样本有限,还需同时充分考虑基因与基因、基因与临床资料的差异等相互作用的影响,从而更好阐明抗血小板药物抵抗的发病机制。希望随着基因水平技术的飞速发展,通过对与AR相关基因多态性详细和充分的分析,以制订个体化最佳的药物治疗方案。

