石墨烯对人牙槽骨骨髓间充质干细胞增殖分化的影响
王 熙 ,张淑悦 ,黄呈森,王美艳 ,周宏伟 ,李 健
(1.承德护理职业学院,河北 承德 067000;2.唐山市人民医院,河北 唐山 063000;3.厦门大学附属翔安医院,福建 厦门 361000)
牙槽骨缺损一直都是口腔临床医学研究的热点问题。目前自体骨移植依然是解决这一问题的主要方式,然而诸如二次创伤给病人带来的心理生理痛苦、并发症的出现、自体骨供给量的局限性等弊端也日益明显[1]。随着组织工程学的飞速发展,利用诱导成骨转录因子、调控miRNA结合支架材料来促进成骨,是重建缺损牙槽骨的理想修复方法。牙槽骨骨髓间充质干细胞(AB-BMSCs)是目前最新发现的成体干细胞类型,来源于上下颌的牙槽骨中,其具有取材方便、量大、无二次创伤等优点[2]。作为优良的种子细胞,运用组织工程技术将牙槽骨骨髓间充质干细胞应用于颌面部骨缺损修复,将成为骨修复的新方法。在组织工程领域,支架材料是必不可少的要素之一。支架材料中石墨烯是人工合成的一种二维纳米晶体,人们常见的石墨烯是由一层层以蜂窝状有序排列的平面碳原子堆叠而形成的;三维结构的石墨烯由碳纳米管支柱支撑平面碳原子,这可以产生独特的强度、韧性和延展性的混合结构。在生物医学领域,石墨烯的纳米载药、生物检验及肿瘤的光热疗法逐步应用于临床;在组织工程领域,国外学者Nayak、Lee等[3-4]均通过在石墨烯膜上接种附着不同材质的骨髓间充质干细胞证实附着介质不同,细胞增殖分化效果也不一致。本文通过AB-BMSCs的分离培养与鉴定、CCK-8检测、Real-Time PCR 等实验研究石墨烯对 ABBMSCs增殖及成骨分化的影响,探索石墨烯在骨重建中的应用。
1 材料与方法
1.1 细胞来源
排除疾病、激素等其他全身因素及局部因素对于细胞生长的干扰,经唐山市人民医院伦理委员会审批,具体纳入情况如下:在45名自愿捐献牙槽骨骨屑者中,排除了具有全身疾病因素的17名病人,包括合并高血压(3名)、糖尿病(5名)、其他系统性疾病(9名);局部因素的8名病人,包括龋齿(2名)和智齿冠周炎(6名)。实验入选者为自愿捐赠牙槽骨骨屑的20位男性病人,年龄在 17~30 岁之间,平均年龄(23.5±5.24)岁,拔除牙齿原因包括正畸要求拔牙(6名)、下颌阻生齿拔除(7名)及种植病人(7名)。
1.2 主要试剂和仪器
α-MEM细胞培养基、FBS溶液(美国Gibco公司),PBS缓冲液(美国 Hyclone公司),6、24、96孔培养板(比利时 Orange Scientific公司),4%多聚甲醛溶液(北京鼎国生物技术有限责任公司),TritonX-100(上海索莱宝科技有限公司),Rb Anti-CD34、Rb Anti-CD44、Rb Anti-CD90(天津赛尔生物技术有限公司),DAPI溶液(北京索莱宝科技有限公司),石墨烯(北京航空航天大学实验室),dNTP溶液(10 mmol/L)、RNasin溶液、M-MLV 逆转录酶、SYBR Premix Ex Taq试剂盒(日本Takara公司),Ethidium Bromide(EB)(北京鼎国生物技术有限责任公司),正常熔点琼脂糖凝胶、低熔点的琼脂糖凝胶(美国GIBCO公司),CCK-8检测试剂盒(东仁化学科技上海有限公司),BMP2、RUNX2、COL-1(苏州吉玛生物科技有限公司),iQ5 Real-Time PCR扩增仪(美国Applied Biosystems公司),5415D型离心机(德国Eppendorf公司),CO2恒温培养箱(美国Thermo Forma公司),超净工作台(苏州净化设备有限公司),倒置显微镜(日本OLYMPUS公司),荧光显微镜(日本SONY公司)。
1.3 实验方法
1.3.1 原代人牙槽骨骨髓间充质干细胞的分离、培养与鉴定常规消毒、拔牙后,咬骨钳或刮匙刮取骨屑,或种植逐级备洞时器械上存留的骨屑,将骨屑置入含1%双抗的PBS液中,对骨屑进行反复吹打冲洗,3次洗涤后放到离心机内离心2次,每次5 min,弃上清液,沉淀骨屑移到小培养皿内(直径6 cm),置于恒温37℃、体积5%CO2培养箱之中15 min,将骨屑贴于小皿内壁,轻轻加20%α-MEM培养基2 ml,放入培养箱进行细胞培养,期间间隔5天换1次液,当细胞生长达到底面积的80%左右时,观察细胞生长状况及形态变化。选用干细胞表面表达标记物CD34、CD44、CD90对培养的原代细胞进行免疫荧光鉴定。将实验中经过分离、培养、鉴定的原代BMSCs作为种子细胞,用含0.02%EDTA的0.25%胰蛋白酶消化,传代培养。取第四代细胞用于实验研究。
1.3.2 氧化石墨烯水溶胶培养皿制备 用去离子水把氧化石墨烯粉溶解之后,利用超声波清洗器对溶液进行清洗处理,待氧化石墨的片层被剥离形成淡黄色生成物(氧化石墨悬浮液)后,将悬浮液放置到离心机内,离心10 min(13 000 rpm)后分为两层,上层清液为氧化石墨烯悬浮液(留取),下层沉淀物是无法剥离的氧化石墨(去除),获取的氧化石墨烯悬浮液因为含有丰富的含氧功能团,在功能团辅助下,不同的氧化石墨片层之间产生了静电排斥效果,使氧化石墨烯层被良好分散出来。将石墨烯材料剪成与不同规格玻璃片同等大小,超纯水清洗3次,75%医用酒精中浸泡清洗5 min,紫外灭菌后按规格不同分别放入6孔板及24孔板中。
1.3.3 实验分组 取第四代细胞,将其分为3组,即空白组(细胞培养的接种材料为普通塑料性细胞培养皿)、对照组(所用接种材料为塑料培养皿+玻璃片)、实验组(所用接种材料是塑料培养皿+石墨烯水溶胶)。
1.3.4 CCK-8检测细胞增殖活性 取第四代细胞进行分组,以密度为5×104个/孔将各组细胞分别加入24孔板中,每组均同时设两个细胞复孔。37℃、5%CO2培养箱体外分别培养1天、2天、3天、4天,弃去旧培养基,每孔更换新培养基300 μL和CCK-8试剂30 μL。将24孔板再次移到培养箱中培养2 h终止反应,将各孔内溶液混匀后分别移到96孔板(100 μL/孔)中待检测,检测前轻轻晃动96孔板,混匀孔内的培养基,用酶标仪检测450 nm波长条件下各孔的吸光值,并记录结果,实验取3个样本,重复3次。
1.3.5 Real-Time PCR 检测 BMP2、RUNX2、COL-1 miRNA水平 取第四代细胞,按前述实验分组进行处理。将细胞移入6孔板(2×105个/孔),置于37℃、5%CO2的细胞培养箱中培养48 h,分别收集3组的细胞于1.5 ml EP管保留,加入Trizol试剂(日本Takara公司),按试剂盒说明书提取人牙槽骨骨髓干细胞的RNA。取3.0 μL样本RNA按照M-MLV反转录试剂盒的说明来逆转录合成cDNA。Real-Time PCR扩增BMP2、RUNX2、COL-1,并将β-actin作为内参照。反应体系如下:采用SYBR Premix Ex Taq 试剂盒,master mix 10.0 μL,上下游引物各 1.0 μL,cDNA 1.0 μL,DDW 2.2 μL 共计 20 μL。反应条件:94 ℃下 270 s、56℃下30 s、72℃下30 s,在完成40个上述循环后,再行数据处理和柱状图绘制。成骨相关目的基因的引物由天津赛尔生物技术有限公司合成,引物序列见表1。
1.4 统计学分析
采用SPSS.17.0软件分析实验数据,计量资料在经过方差分析后,符合正态分布者以(±s)表示,计数资料则用百分率表示,3组间的细胞增殖情况、基因表达结果比较使用单因素方差分析,3组间数据的两两比较使用LSD进行多重比较,P<0.05为差异有统计学意义。
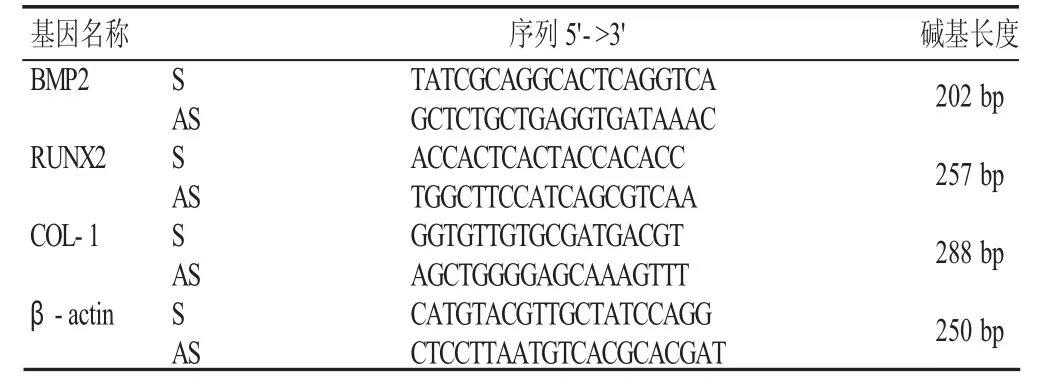
表1 BMP2、RUNX2、COL-1 和 β-actin 引物设计
2 结果
2.1 原代人牙槽骨骨髓间充质干细胞培养结果
细胞形态学结果发现:第7 d显微镜下观察,有少量细胞从骨屑边缘溢出,细胞形状有长梭形、圆形、多角形等多种不同表现,此阶段细胞多、较短小;培养第10 d时,镜下观察发现星形、纺锤形细胞体积明显增加,相邻细胞间有连接,且细胞呈现出明显长梭形和(或)纺锤形态。上述实验培养细胞形态与已知的BMSCs贴壁形态基本符合。
2.2 免疫荧光结果
BMSCs细胞表面抗原特点为 CD34(-)、CD44(+)、CD90(+),本实验中在对样本进行3次独立免疫荧光检测后发现,3次检测结果均一致,无论是20倍光镜下还是40倍的荧光显微镜下观察,结果均为:对照组未加入细胞表面抗体,只见细胞核蓝色荧光表达;加入CD34表面抗体组,胞质荧光染色强度极弱,呈CD34(-);加入CD44和CD90表面抗体组染色强度较强,即CD44(+)、CD90(+)。可见本实验体外培养、分离提取细胞的表面抗原表达结果与骨髓来源BMSCs具有高度一致性,因此,可以认为本实验所分离培养的细胞类型为BMSCs。
2.3 CCK-8检测结果
随机选取样本,各组样本数均为5个。结果显示(见图1),3组细胞均有增殖,其中第4天实验组细胞增殖显著高于空白组及对照组(P<0.01),第 1、2、3 天实验组与空白组、对照组细胞增殖情况未见差异(P>0.05)。第4天对照组与空白组无统计学差异(P>0.05)。结果提示石墨烯促进细胞增殖。

图1 CCK-8检测细胞增殖测定结果
2.4 qRT-PCR检测结果
利用 qRT-PCR 法对各组 BMP2、RUNX2、COL-1 基因表达情况进行定量分析,通过对3组BMP2、RUNX2、COL-1分别进行组间两两比较发现,各组BMP2、RUNX2、COL-1基因表达水平存在显著性差异(P<0.01)。BMP2基因表达结果如下:实验组BMP2基因阳性表达效果显著高于空白组、对照组(P<0.01),而对照组 BMP2 基因表达同样显著高于空白组(P<0.01);RUNX2基因表达结果:实验组RUNX2基因水平显著高于空白组与对照组(P<0.01),对照组的 RUNX2基因水平也显著高于空白组(P<0.01);COL-1 基因表达水平多重比较结果:实验组的 COL-1 基因表达显著高于空白组与对照组(P<0.01),对照组 COL-1基因表达与空白组比较接近(P>0.05)。见图2。
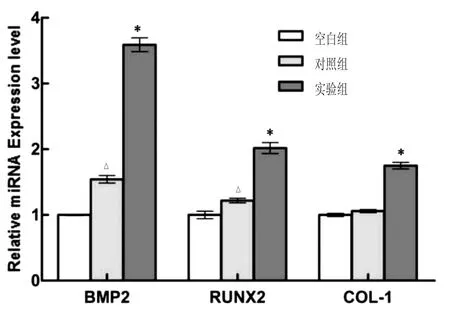
图2 各组BMP2、RUNX2、COL-1基因表达结果比较
3 讨论
3.1 原代人牙槽骨骨髓间充质干细胞的分离、培养与鉴定
自体AB-BMSCs作为牙源性干细胞,不仅排斥反应少,移植安全性高,且分离、扩增方便。在实验中,已证实AB-BMSCs与人原代BMSCs特性一致,具有极强的细胞增殖分化能力[5-6]。目前BMSCs分离获取方法主要包括密度梯度离心法、组织块法、流式细胞仪筛选法及免疫磁珠法[7]。本实验选择组织块法进行AB-BMSCs的分离培养,主要考虑该方法不仅操作简单而且实验费用低廉、可重复性强,并且能利用BMSCs贴壁的特点将细胞不断纯化,更利于成功获取高纯度AB-BMSCs细胞。
鉴定BMSCs生物学特征方法主要是通过对比细胞形态学表现[8]和检测细胞表面标记物[9-11]CD34(-)、CD44(+)、CD90(+),说明实验获取的为BMSCs。此实验与上述研究成果一致,所获取的细胞是AB-BMSCs,AB-BMSCs的分离、纯化、培养成功。
3.2 石墨烯促进骨髓间充质干细胞增殖
Kalbacova M等[11]发现使用石墨烯、氧化硅分别对人成骨细胞、间质干细胞进行培养,结果石墨烯上接种的细胞在经过体外培养之后,细胞的增殖效果(增殖率)具有明显优势。李中华[12]的研究同样证实了石墨烯环境诱导下BMSCs在第3天增殖率开始迅速升高。本实验中,在体外培养获得AB-BMSCs之后,将AB-BMSCs接种到不同种类的培养皿中,结果发现,在接种密度相同的情况下,石墨烯干预后的第4天AB-BMSCs增殖率最高,增殖率显著高于空白组和对照组(P<0.01),说明石墨烯能促进AB-BMSCs增殖,此结果与前人研究的结果一致。作为口腔骨组织修复体,其能很好地与自体骨结合,达到骨重建的目的。
3.3 石墨烯对人牙槽骨骨髓间充质干细胞成骨分化的影响
La W G等[13]在实验中用石墨烯修饰高分子聚合物,用氧化石墨烯对钛种植体进行表面修饰,修饰后成骨分化的速度显著提升,说明石墨烯能够改善细胞生存环境,对细胞生存、分化提供有力的保障环境。
本实验中选取了成骨分化相关基因的表达情况作为观察指标,旨在初步研究石墨烯通过调控成骨相关基因,进一步促进 AB-BMSCs成骨分化。BMP2[14-15]、RUNX2[16-19]、COL-1[20-22]均为促进成骨分化基因,本实验结果为:实验组在BMP2、RUNX2、COL-1基因表达明显高于空白组与对照组(P<0.01)。研究表明,石墨烯促进细胞成骨分化,与以上实验结果具有一致性。说明石墨烯不仅能够作为骨支架材料应用于骨重建,它还可以促进骨形成,更好地应用于临床。
4 结语
人牙槽骨来源的骨屑能够培养出的细胞为骨髓间充质干细胞,具有成骨分化能力。石墨烯作为新型材料,能够对人牙槽骨来源骨髓间充质干细胞增殖及成骨分化产生促进作用,其作用机制可能与石墨烯能够上调BMP2、RUNX2、COL-1等促成骨分化基因表达水平有关。

