NGF过表达质粒修饰BMSCs移植促进大鼠急性脊髓损伤修复
石勇,霞晓燕
(绵阳市人民医院神经外科,四川 绵阳 621000)
急性脊髓损伤(spinal cord injury,SCI)多由直接暴力引起,包括交通事故伤、高处跌落伤等,具有创伤大、预后差的特点[1-2]。既往文献报道,急性SCI往往导致神经细胞的坏死和凋亡,而干细胞移植是一种有效的治疗方案[3-4]。但是,也有研究表明,干细胞移植具有分化程度低、易老化的特点[5]。因此,寻找一种有效的干细胞促分化方案,有效抑制干细胞的老化具有重要的意义。神经生长因子(nerve growth factor,NGF)是一种常见的神经营养因子,具有保护神经元、促进神经元的分化和神经纤维的定向生长的作用[6-7]。本研究利用Cas-9基因编辑技术,构建NGF的基因过表达载体,通过慢病毒转染的方法,转染骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)。并且通过构建大鼠的脊髓损伤(spinal cord injury,SCI)动物模型,注射处理后的BMSCs,利用反转录聚合酶链反应(reverse transcriotion-polymerase chain reaction,RT-PCR)、Western blot、免疫荧光等方法检测NGF的表达和神经的修复,以期为临床上急性脊髓损伤的治疗提供新的思路和方法。
1 材料与方法
1.1 实验材料 胎牛血清购自以色列BI公司;改良Eagle培养基(dulbecco's modification of eagle's medium,DMEM)及0.25%胰酶Trypsin购自美国Invitrogen公司;TRIZOL购自美国Invitrogen公司;氯仿、酒精及逆转录试剂盒购自日本TAKARA公司;电泳仪、Real-time荧光定量PCR仪购自美国bio-rad公司。无特定病原体(specefic pathogen free,SPF)级SD大鼠购自济南齐鲁实验动物中心[SCXK(鲁)2018-2892]。月龄6~7个月,体重398~412 g。
1.2 实验方法
1.2.1 人BMSCs的分离和培养 选取10名健康志愿者,男性6例,女性4例;年龄19~25岁,平均(22.13±3.23)岁。实验方案获得了本院伦理委员会的批准,所有志愿者均签署知情同意书。骨髓穿刺针提取志愿者的新鲜骨髓,按照1︰3体积比加入含0.01 mol/L的胎牛血清、100 U/mL青霉素的DMEM细胞培养液,充分混匀后,移入25 cm2Hank培养瓶中。差速培养法培养,3 d后去掉培养瓶中的油脂等杂质,之后每3天更换1次细胞培养液。BMSCs细胞融合率达70%~80%后进行传代培养。
1.2.2 BMSCs的鉴定 采用流式细胞仪检测BMSCs的表面蛋白,CD 29、CD 44、CD 71、CD 90和CD 106等表面蛋白的表达可以为BMSCs的鉴定提供依据。另外,采用倒置光学显微镜也可以观察BMSCs的细胞形态。
1.2.3 慢病毒NGF过表达载体的构建 利用Pubmed基因库数据平台,筛选人源性NGF的基因序列,基因序列为NC_000001.11,基因ID:4803,选择pHBLV-U6-ZsGreen-PGK-Puro作为质粒的克隆载体。NGF过表达载体的克隆切入点是XhoI/BamHI,编号为ENST00000005188。
1.2.4 SD大鼠急性SCI动物模型构建 利用钳夹法[8]构建大鼠SCI模型,SD大鼠采取腹腔注射水合氯醛麻醉,麻醉满意后取俯卧位,常规消毒,备皮。取后背正中切口,逐层分离皮肤、筋膜和肌肉,直达棘突,尽量咬除T9~11棘突和椎弓板,暴露T10脊髓,将动脉瘤夹放置在脊髓上,宽度为脊髓的一半,突然释放夹子使脊髓受到暴击,30 s后取下动脉瘤夹,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,逐层缝合(见图1)。
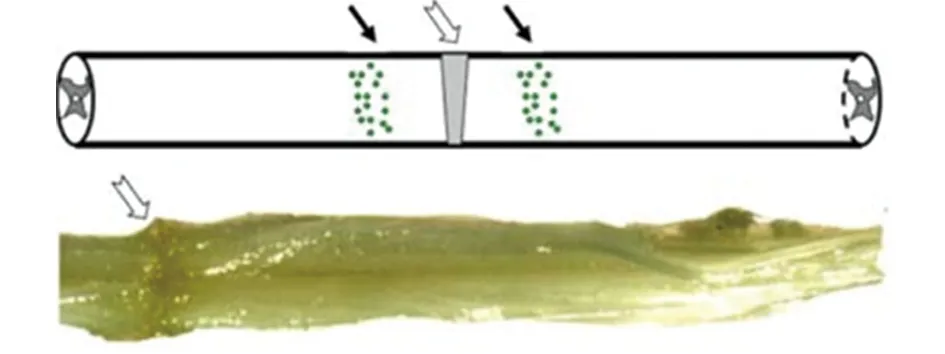
图1 脊髓损伤模式图和大体图片
1.2.5 实验动物分组 根据转染的BMSCs类型,将实验动物分成三组,每组5只SD大鼠。模型组:SD大鼠均未做任何处理;BMSCs组:SD大鼠SCI模型构建后,注射无慢病毒转染的BMSCs;过表达质粒组:SD大鼠SCI模型构建后,注射NGF过表达质粒慢病毒转染的BMSCs。
1.3 观察指标
1.3.1 行为学观察 三组SD大鼠均在损伤前和处理后12 h进行后肢功能恢复的行为学检测,以运动功能(basso-beattie-bresnahan,BBB)评分作为指标,观察指标为小鼠后肢踝关节活动度、脚掌脚背着地情况、躯干稳定性及尾巴的位置。
1.3.2 RT-PCR检测NGF和凋亡标志因子Caspase-3的表达 各组大鼠干预2周后均按照动物伦理的要求无痛苦处死,取1 g修复的脊髓组织,加入1 mL Trizol试剂,充分研磨,抽提总RNA,然后根据逆转录试剂盒的要求将RNA逆转录为cDNA,根据TaKaRa荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒说明书的要求,采用20 μL的反应体系,加入各样品,进行荧光定量PCR的检测。内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和NGF、Caspase-3引物由上海生工公司生产(见表1)。采用2-ΔΔCT的方法计算目的基因的相对表达量。
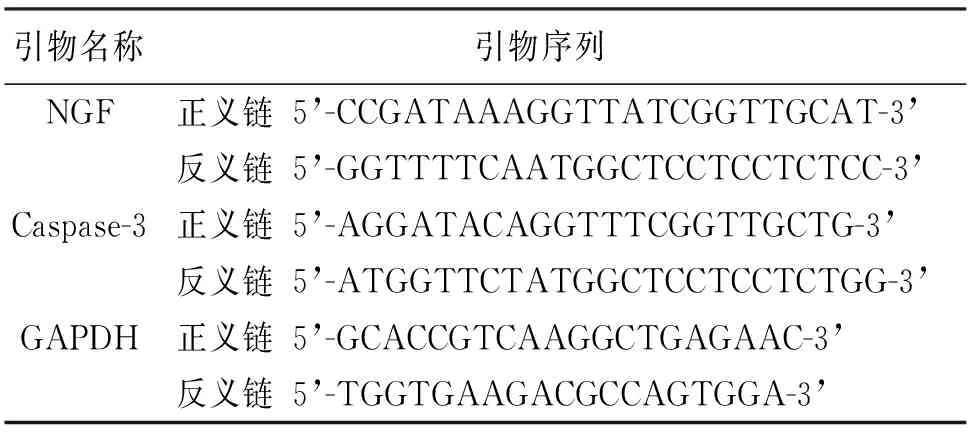
表1 目的基因的引物序列
1.3.3 Western blot检测NGF和凋亡标志因子Caspase-3的表达 各组大鼠干预2周后均按照动物伦理的要求无痛苦处死,取1g修复的脊髓组织,加入1 mL放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer,RIPA)裂解液,冰上裂解30 min,收集入1.5 mL的离心管中,在预冷4℃的离心机中离心,预设:5 000 r/min,5 min后提取上清,经95℃煮沸后收集蛋白备用。按照说明书制备浓缩胶10 mL,分离胶20 mL。上样后电泳分离,转膜后在4℃冰箱避光孵育过夜(>12 h)。NGF和Caspase-3一抗经一抗稀释液1︰10 000稀释后加入样本离子膜。第2天用含吐温20的磷酸盐缓冲液(phosphate buffered solution tween,PBST)稀释液洗膜,重复3次,加用山羊抗小鼠1 g G二抗经二抗稀释液1︰1 000稀释后孵育二抗1.5 h,用PBST稀释液洗膜,重复3次,而后用二氨基联苯胺(diaminobenzidine,DAB)显影液处理样本。Image J软件可以用来分析蛋白条带。
1.3.4 免疫荧光染色检测NGF的定位表达 各组大鼠干预2周后均按照动物伦理的要求无痛苦处死,取1 g修复的脊髓组织,制备石腊组织,冰冻切片,二甲苯梯度处理,PBS溶液清洗后柠檬酸溶液浸润20 min,PBS溶液清洗3次,BSA孵育30 min,避光孵育神经纤维标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和神经元标志物神经元细胞核(neuronal nuclei,NeuN)蛋白一抗,4℃避光孵育过夜。PBS溶液清洗3次,辣根过氧化物酶(horseradish peroxidase,HRP)二抗避光孵育30 min,PBS溶液清洗3次,倒置光学显微镜下观察。
2 结 果
2.1 人BMSCs的培养和鉴定 原代BMSCs细胞成梭形或者多角形;培养至第2代后,呈旋涡状或者辐射状生长;流式细胞仪检测第2代BMSCs的表面蛋白,CD 44和CD 29的表达为60.2%和58.3%;CD 34和CD 45的表达为3.4%和2.6%(见图2)。
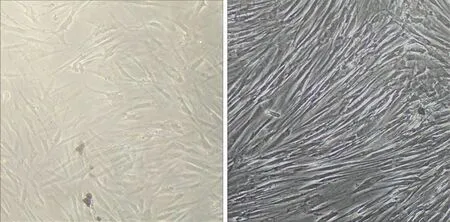
a 原代BMSCs b 第2代BMSCs
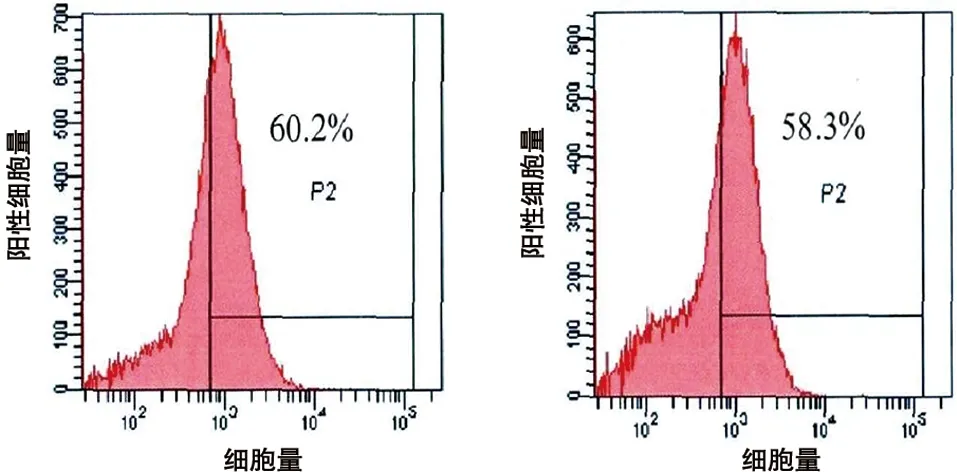
c 表面蛋白CD44的表达 d 表面蛋白CD29的表达
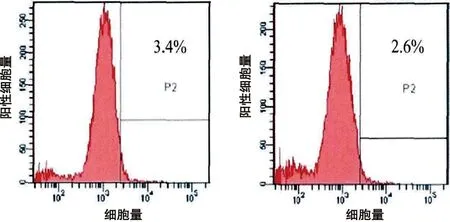
e 表面蛋白CD34的表达 f 表面蛋白CD45的表达
2.2 NGF过表达载体转染效率 转染效率=荧光视野下细胞数/白光视野下细胞数。结果显示,慢病毒转染效率为90%以上,转染效率较高(见图3)。
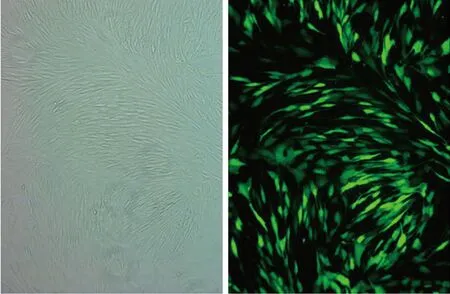
a 白光下视野 b 莹光下视野
2.3 行为学检测 术前SD大鼠BBB评分(21.91±4.7)分,分,模型组术后1 d的BBB评分降至最低,而BMSCs组要高于模型组(F=9.898,P<0.05),过表达质粒组高于模型组和BMSCs组(q值分别为2.198和2.004,P<0.05)。术后3 d的BBB评分明显回升,术后12 d与术后14 d较平缓,比较差异无统计学意义(P>0.05,见图4a)。
后肢踏空率的比较中,BMSCs组要明显高于模型组(F=9.077,P<0.05),过表达质粒组要明显高于模型组和BMSCs组(q值分别为2.129和2.099,P<0.05,见图4b)。
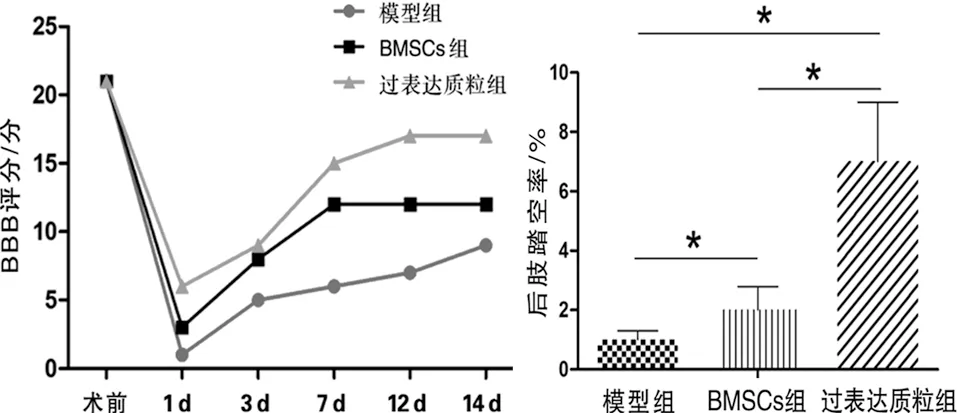
a 三组小鼠的BBB评分 b 三组小鼠的后肢踏空率
2.4 NGF和凋亡信号分子Caspase-3的表达量 RT-PCR结果显示,BMSCs组NGF mRNA的相对表达水平要明显高于模型组(F=8.997,P<0.05),过表达质粒组NGF mRNA的相对表达水平要明显高于模型组和BMSCs组(q值分别为2.971和1.2.099,P<0.05)。Western blot的结果与RT-PCR结果相同(见图5)。
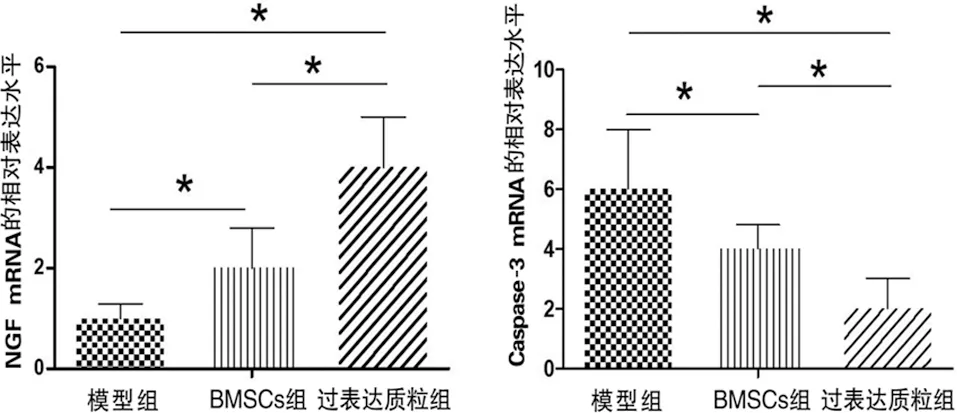
a NGF mRNA的相对表达水平 b Caspase-3 mRNA的相对表达水平
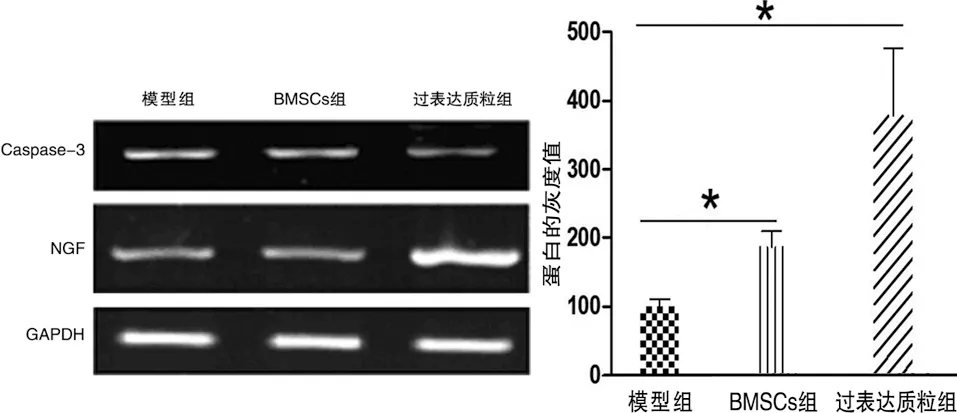
c Western blot检测结果 d 蛋白的灰度值
2.5 免疫荧光染色结果 结果显示,过表达质粒组脊髓修复程度要优于BMSCs组和模型组。可见断裂间距明显缩小,断端修复较好(见图6~7)。
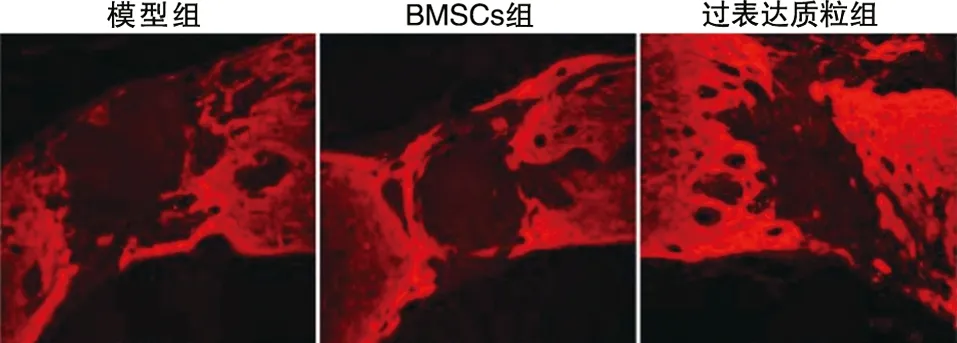
图6 脊髓标本的GFAP染色结果(免疫荧光染色,×800)
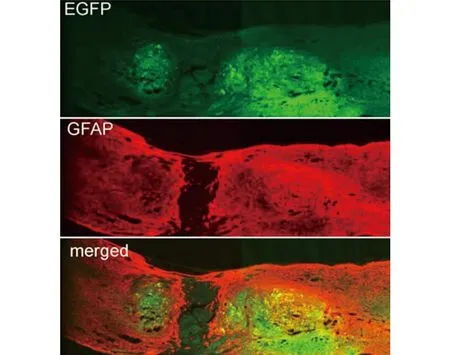
图7 增强绿色荧光蛋白EGFP和GFAP共染结果(免疫荧光染色,×600)
2.6 NGF与神经元标志物NeuN共染结果 过表达质粒组NGF可与NeuN共染,神经元细胞量增多(见图8)。
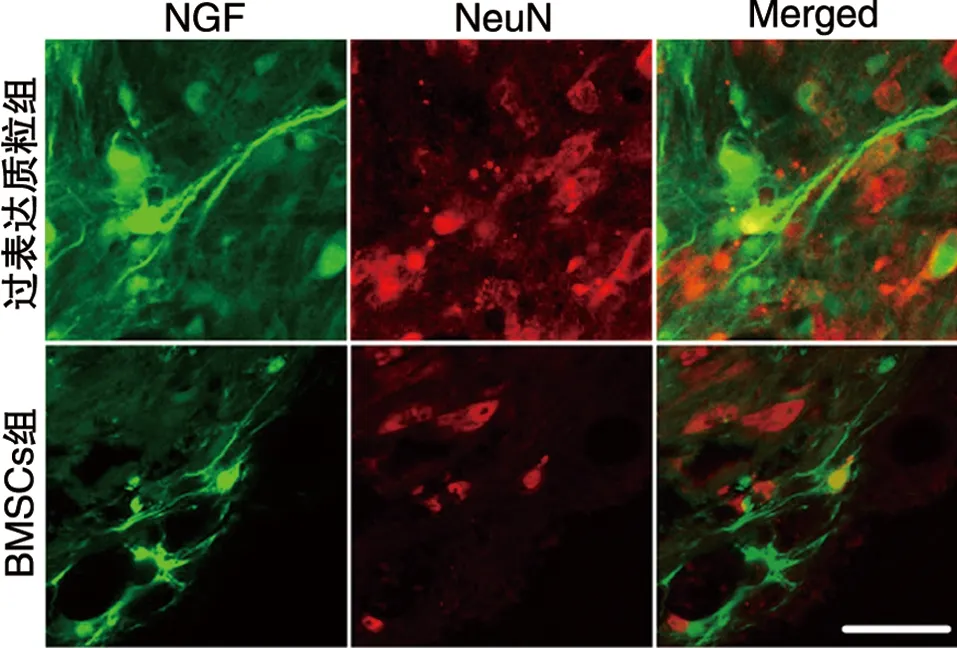
图8 NGF与神经元标志物NeuN共染结果(免疫荧光染色,×600)
3 讨 论
本研究通过构建NGF的过表达载体,通过慢病毒转染技术转染人BMSCs。并且利用钳夹法构建SD大鼠的脊髓损伤动物模型,接种NGF过表达载体修饰后的BMSCs,利用RT-PCR和Western blot进行定量检测,表明过表达载体组脊髓组织中可见NGF的过表达和凋亡标志因子Caspase-3的低表达。说明NGF基因过表达载体可以抑制脊髓组织神经元细胞的凋亡。另外,通过免疫荧光定位检测,可见NGF蛋白可以与神经元细胞标志蛋白NeuN共染,与神经胶质纤维标志蛋白GFAP不共染。说明NGF过表达载体可以促进神经细胞元的增殖,进一步促进脊髓的修复。而且,我们也通过行为学检测,利用BBB评分和后肢踏空率对动物的行为进行评估,结果表明,NGF过表达载体组小鼠的行为较另外两组明显改善。利用干细胞的多分化潜能对急性SCI进行治疗一直是骨科研究的重点和难点问题[9-10]。Zhao等[11]将BMSCs细胞接种于急性SCI损伤动物模型中,得到良好的治疗效果,但是也存在一些问题,比如干细胞的不定性分化和易老化等。这些问题限制的干细胞在脊髓修复领域的进一步应用。陈乃耀等[12]利用人源脐血间充质干细胞治疗创伤性脑损伤(traumatic brain injury,TBI)大鼠模型,结果证明,人源脐血间充质干细胞可以促进TBI大鼠模型的神经损伤程度的改善,有利于损伤脑组织的修复。从而说明,可以利用人源性干细胞治疗大鼠模型,具有良好的兼容性和有效性。既往文献报道,NGF可以促进神经细胞的增殖和分化,并且抑制神经元细胞的凋亡[11]。本研究在前人的基础上,采用Cas-9技术,筛选NGF的基因,通过扩增基因序列,促进NGF的蛋白表达,借助慢病毒转染技术,将NGF过表达质粒转染人源BMSCs,可以促进干细胞的定向分化,抑制凋亡。通过RT-PCR和Western blot等方法检测NGF和凋亡标记因子Caspase-3的表达,结果表明,NGF转染后可以抑制凋亡。原因可能与NGF的过度表达有关。并且利用免疫荧光染色定位NGF与神经元标志物NeuN的共染,结果表明,NGF过表达质粒可以促进NeuN的表达,说明NGF可以促进BMSCs向神经元细胞分化。其原因可能与NGF的促神经元分化相关。而且,既往文献中也对空白质粒慢病毒转染对实验结果的影响进行了相应研究,他们的研究结果表明空白质粒对研究结果无影响,结果说明空白质粒不会影响研究结果[13-14]。本研究结果与前人研究结果相同,空白质粒慢病毒转染BMSCs,不会影响BMSCs的分化和增殖。
为了进一步评估NGF过表达质粒转染BMSCs后对SCI动物模型脊髓损伤的修复作用,本研究还利用免疫荧光染色共染神经胶质纤维标志蛋白GFAP,结果表明,过表达质粒组脊髓修复程度要优于BMSCs组和模型组。可见断裂间距明显缩小,断端修复较好。而且通过行为学检测,利用BBB评分和后肢踏空率对动物的行为进行评估,结果表明,NGF过表达载体组小鼠的行为较另外两组明显改善。其原因可能为神经元的增殖,促进神经胶质纤维的生成,从而对脊髓组织起到很好的修复效果,进一步影响SCI动物模型的行为。
综上所述,NGF过表达质粒转染后可以促进BMSCs向神经元细胞分化,促进SCI动物模型的功能恢复。
——一道江苏高考题的奥秘解读和拓展

