非诺贝特微球对高血脂模型大鼠降脂作用研究*
付 琳,苏 瑾,杨春荣,孙维彤,张向宇,孟祥祎,张 杰
(佳木斯大学药学院,黑龙江 佳木斯 154007)
非诺贝特缓控释是目前临床上常用的一种降高血脂症的药物[1]。目前市面常见的剂型均为口服缓控释制剂,口服缓控释制剂多具有明显的生物化学利用度相对较低、代谢缓慢和失活速度快的重要生理缺陷[2-4]。聚乳酸-羟基乙酸共聚物是一种高分子载体材料,具有良好的成囊性和生物相溶性,并能在体内降解为乳酸和α羟基乙酸[5-7]。因此,制备非诺贝特PLGA微球新药物有重要的临床意义。通过对非诺贝特缓释微球的研究[8-9],将非诺贝特制成安全、稳定、高效的注射缓释微球制剂,减少患者用药次数,使药物在体内缓慢释放,为非诺贝特新剂型的临床研究和应用提供理论依据。
1 材 料
1.1 仪 器
Guardcolumn C18色谱柱,日本岛津;Agilent1100高效液相色谱仪,美国安捷伦公司; ZSM-6360LV扫描电镜,南京大学仪器厂;SALD-2201激光粒度分布仪,苏州岛津仪器有限公司;UV765紫外-可见分光光度计,上海精科公司;HE3100红外光谱测定仪器,德国SPECTRO;JY92-2D超声波细胞破碎机,南京舜玛仪器设备有限公司。
1.2 药品与试剂
非诺贝特微球,佳木斯大学药剂实验室自制;非诺贝特(纯度99%),武汉宏信康精细化工有限公司;PLGA(PLA/PGA=50∶50,分子量10000),山东济南岱罡生物科技公司;非诺贝特对照品(纯度99.9%),中国食品药品检定研究所;磷酸盐缓冲溶液(PBS7.4),REBIO瑞楚生物;透析袋(36 mm,分子量8000~14000),美国Viskase Size5。
1.3 动 物
SPF级雄性SD大鼠60只,哈尔滨医科大学实验动物中心提供。合格证编号scxk(黑)2013001。
2 方 法
2.1 非诺贝特微球的形态学考察
通过光学显微镜观察载药微球形态特征,通过扫描电子显微镜观察微球形貌。
2.2 非诺贝特微球粒径及粒度分布
精密称取适量微球进行溶解,超声2 min使其分散均匀,激光粒度分布仪准确测定粒径及粒度分布情况。
2.3 非诺贝特微球的紫外光谱扫描
使用容量瓶精密配置非诺贝特标准品和空白辅料溶液浓度10 μg·mL-1。以甲醇溶液为空白对照进行扫描,范围200~400 nm。选择合适的高效液相色谱检测波长。
2.4 载药微球体外释放及稳定性研究
采用C18柱(250 mm×4.5 mm,5 μm);以85∶15的乙腈、磷酸溶液混合溶液作为流动相;流速1.0 mL·min-1;紫外分光光度法测得检测波长286 nm[10-11]。
精密配置10 μg·mL-1的非诺贝特对照品溶液,以甲醇为溶剂配置梯度浓度5、10、20、30、40、60、90 μg·mL-1在286 nm处进样,绘制标准曲线。
2.4.1 透析法体外药物释放试验
试验采用透析袋原理。将微球注入5 mL生理盐水的PBS 7.4介质中;在每个设定的取样时间取样量。释放样品的浓度用HPLC测定,代入体外释放标曲计算非诺贝特的累积释放量。
2.4.2 专属性试验
在不受其他杂质和辅料的干扰的条件下利用高效液相色谱检测样品特性。
2.4.3 精密度实验
分别配置五个梯度浓度的样品溶液,计算日内日间精密度。
2.4.4 稳定性检测
每日取样五次,测定样品浓度计算峰面积。回收率:取高中低三个浓度样品,每天测三次,连续测五天。
2.5 非诺贝特微球对高血脂模型大鼠降脂作用研究
2.5.1 动物分组与造模
分为正常组、高血脂疾病模型组、阳性对照组、非诺贝特微球高、中、低剂量组六组。造模期间正常组灌服等剂量的蒸馏水,其余5组灌服自制高脂乳剂。灌胃两周后抽样取血,测总胆固醇水平以证实高血脂疾病模型造模成功[12]。证实造模成功后大鼠开始药物治疗,非诺贝特缓释微球高中低剂量组分别给予18、9、4.5 mg·kg-1浓度药物。阳性对照组尾静脉注射等剂量藻酸双酯钠,连续6 d,非诺贝特组三天注射一次,持续15 d。
2.5.2 检查指标
大鼠给药结束禁食24 h,将各组大鼠麻醉固定于鼠板上,腹部刨开进行腹主动脉血取,取肝脏、附睾脂肪和肾周脂肪,分别称重记录。计算体脂比和Lee’s指数。使用酶标仪测定血清的TG、TC、HDL、LDL水平和肝脏TC,TG水平。
3 结 果
3.1 非诺贝特微球的表征结果
在光学显微镜下观察,载药微球整体形态规整,无粘连。扫描电子显微镜观察结果如图1(a)所示,微球分布均匀,外观呈完整球形,表面光整。激光粒度分布仪测定结果如图1(b)所示,粒径大小呈正态分布,平均粒径为(1.16±0.14)μm。
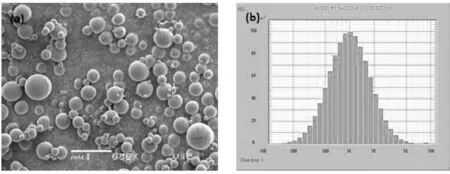
图1 微球SEM表面形貌(a);微球的粒度分布(b)
3.2 非诺贝特紫外吸收波长测定
非诺贝特在286 nm处出现最大吸收峰,且与辅料的吸收峰的位置有明显差异如图2所示,因此在高效液相测定时选择286 nm为检测波长。

图2 紫外吸收波长
3.3 非诺贝特PLGA微球体外释放及稳定性研究
3.3.1 标准曲线的绘制
以286 nm为检测波长,绘制标准曲线A=25.18C+26.75,r=0.9996,如图3所示在5~90 μg·mL-1线性关系良好。
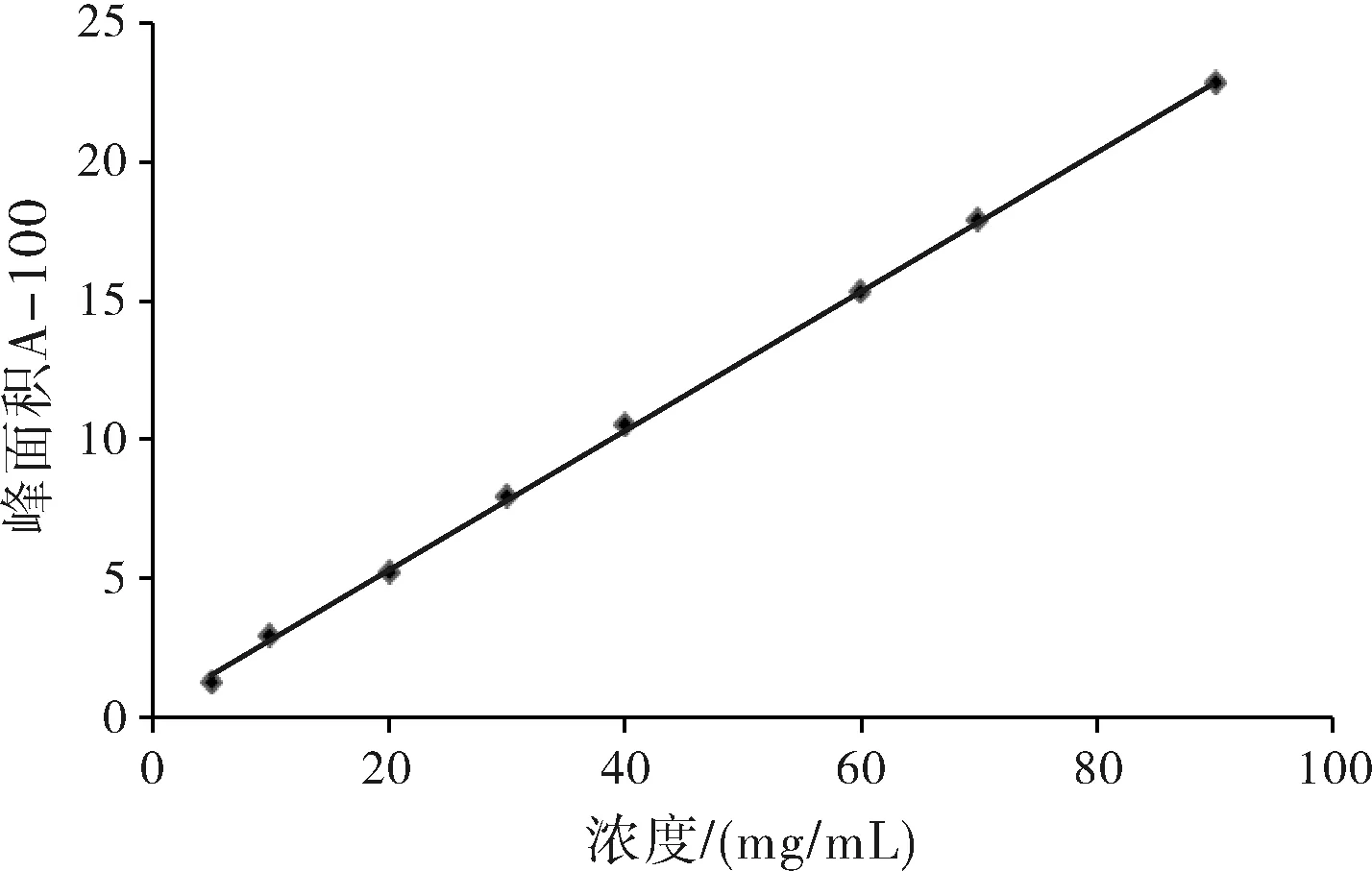
图3 非诺贝特标准曲线
3.3.2 体外释放考察
如图4所示,经高分子材料修饰的载药微球释放时间得到显著延长,非诺贝特微球达到了缓释的效果。

图4 非诺贝特微球释放曲线
3.3.3 专属性试验
非诺贝对照品、原料药、空白辅料和载药微球的专属性考察结果显示辅料对原料药出峰无影响。
3.3.4 精密度计算
平均日内精密度为RSD=1.601%,平均日间精密度RSD=1.348%,均小于2%,精密度结果良好,可以测定样品。
3.3.5 稳定性
分别于0、1、2、4、8、12、16、24 h测定同一样品浓度,计算峰面积分别为2018.56、2030.28、1985.42、2023.69、2039.6、2057.39、2069.45、2048.69 μg·mL-1。RSD为1.16%,小于2%,样品溶液24 h内稳定。
3.3.6 回收率
测30、60、90 μg·mL-1高中低三个浓度溶液的平均回收率分别为98.55%、97.64%、96.92%。其RSD值分别为1.94%、1.7%、1.79%均小于2%,该方法准确度良好。
3.4 非诺贝特微球对高血脂模型大鼠降脂作用研究
3.4.1 各组大鼠肾周、睾周脂肪和体脂比的变化
结果如图5所示,疾病模型组和各治疗组动物的肾周、睾周脂肪,体脂比较空白组具有明显区别。高血脂造模各组脂肪量均有增加,且给药大鼠未显示副作用。

图5 肾周脂肪、睾周脂肪和体脂比的变化
3.4.2 各组大鼠对血清指标水平的影响
各组大鼠血清指标变化如图6所示,模型组和空白组相比各水平指数均有显著提高,高血脂症造模成功。各治疗组与模型组相比各指标均有下降,说明药物可以对高血脂症产生一定程度的治疗作用,其中非诺贝特载药微球高剂量组的治疗效果最为显著。
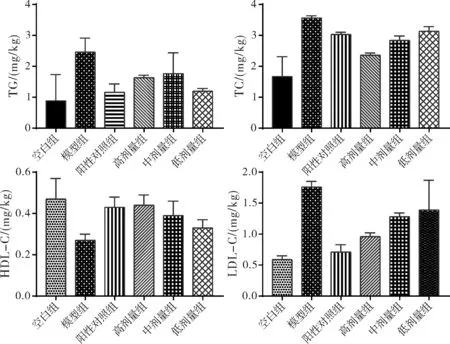
图6 各组动物对血清TG、TC、LDL-C、HDL-C的影响
降低TNF-α可减少动脉粥样硬化和血栓。如图7所示,与模型组相比各治疗组均可降低TNF-α水平,且具有统计学意义。各组大鼠对血清FIB的影响:降低FIB可促进血液中纤维蛋白原的溶解与释放,降低纤溶。如图7所示,阳性对照组和非诺贝特各剂量组均可降低血清FIB水平,且差异具有统计学意义。
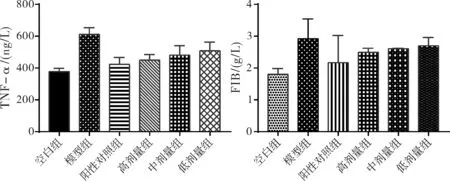
图7 各组动物对血清TNF-α和各组动物对血清FIB的影响
3.4.3 大鼠肝脏外观形态观察
各组大鼠肝脏形态如图8所示。非诺贝特微球高中剂量组肝脏状态较接近于正常组,表面呈红褐色坚挺且有光泽。模型组大鼠肝脏颜色暗淡,体积偏大质地柔软,肝缘顿且表面油腻。非诺贝特微球低剂量组与模型组十分相似,但低剂量组肝脏质地更硬。

图8 各组肝脏外观形态
4 结 论
高血脂症是常见的中老年疾病,并与血压血糖的异常息息相关,严重者还易导致动脉粥样硬化,冠心病等。目前市场上的口服制剂生物利用度低,将非诺贝特制成缓释微球制剂新药物可以有效的提高其生物利用度,减少给药次数。
实验室制备非诺贝特微球。通过扫描电镜、红外光谱分析、差示量热仪对载药微球进行质量评价。成功制备交联微球,表面光滑,形态均一完整,体外释放效果良好。高效液相色谱在5~90 μg·mL-1范围内测定载药微球的药物含量,线性关系良好。对大鼠进行体内的药效学实验,治疗组TG、TC、LDL-C、TNF-α、FIB水平下降,HDLC和肝指数升高。非诺贝特微球具有缓释的降脂作用,为非诺贝特新剂型开发提供了良好的理论依据。

