月腺大戟素A 干预CXCR4 表达对间充质干细胞向心肌梗死区迁移的影响
赵玥,王莹,赵亮,李兰英,王奕,牌铭欣,张贵振,王强利
1.上海中医药大学基础医学院,上海 201203;2.上海中医药大学中药学院,上海 201203;3.上海宝山区罗店医院,上海 201908;4.同济大学附属第四人民医院,上海 200081
目前,干细胞治疗是修复梗死心肌组织、抑制心室重构、增强心功能的有效手段。然而,极低的留存率严重限制了干细胞修复心肌组织的潜能[1]。CXC 趋化因子受体 4(CXCR4)是基质细胞衍生因子-1(SDF-1)重要受体之一,在心肌梗死后机体干细胞的动员和向受损心肌组织迁移中发挥关键作用[2]。上调CXCR4 表达水平能明显增强干细胞的迁移能力,并促使其在心肌梗死区定居,进而增加心室壁厚度和新生血管密度,提高心功能[3-5]。因此,促进干细胞表达CXCR4 是促进移植干细胞向心肌梗死区迁移,增强干细胞治疗心肌梗死作用的有效途径。有研究显示,中药制剂或中药有效成分能通过促进干细胞表达CXCR4,增强其治疗作用[6-7]。基于前期研究构建了293-CXCR4 细胞株并筛选出能增强CXCR4 启动子活性的月腺大戟素A(ebracteolatain A,EA),本研究进一步探索EA 促进间充质干细胞(MSCs)CXCR4表达的作用,并验证其在促进MSCs 迁移和向梗死心肌区归巢中的作用。
1 实验材料
1.1 动物
SPF 级SD 大鼠,雌性12 只,雄性1 只,体质量(200±20)g,上海中医药大学实验动物中心提供,动物许可证号SYXK(沪)2014-0008。饲养于上海中医药大学SPF 级实验动物中心,自由摄食饮水。
1.2 药物及细胞系
EA(纯度>98%)购于上海诗丹德标准技术服务有限公司,批号ST206201-7110。293-CXCR4 细胞系为本实验室建立[8]。
1.3 主要试剂与仪器
双荧光素酶报告基因检测试剂盒,Promega 公司;CCK-8 试剂盒,上海翊圣生物科技有限公司;细胞培养所需的DMEM 培养基、胎牛血清(FBS)、100×青-链霉素和0.25%胰酶(含0.02%EDTA),Bioind 公司;细胞培养瓶、培养板和8.0 μmol/L Transwell 小室,Corning 公司;兔抗大鼠多克隆抗体CXCR4,Novus公司;基质金属蛋白酶2(matrix metalloproteinase2,MMP2)、绿色荧光蛋白(green fluorescent protein,GFP),Cell Signaling Technology 公司;磷酸化Akt、GAPDH,Proteintech 公司;小鼠单克隆抗体Akt,SBI公司;HRP 标记的山羊抗兔、抗小鼠二抗,Proteintech公司;Alexa Fluor®488 AffiniPure 山羊抗兔荧光二抗,Jackson 公司;4',6-二脒基-2-苯基吲哚(DAPI),Sigma公 司; Lipofectamine MAX 和 Opti-MEM ,ThermoFisher 公司。酶标仪(Synergy 2,BioTek 公司),全自动化学发光成像分析系统(Tanon 5200,上海天能),倒置荧光显微镜(IX51,Olympus)。
2 实验方法
2.1 细胞培养
37 ℃恒温水浴复苏293-CXCR4 细胞,用含10%FBS 的DMEM 培养基培养于37 ℃、5%CO2培养箱,每3 d 传代1 次。
2.2 双荧光素酶报告基因检测
将293-CXCR4 细胞以1×105/mL 的密度铺于96孔板,待细胞汇合度约90%~95%后更换为无血清培养基,设为4 组,分别加入终浓度为0、5、10、20 μmol/L EA,每组6 个平行孔。孵育24 h 后,用双荧光素酶报告基因检测系统检测荧光素酶活性值。
2.3 间充质干细胞分离培养
应用差速贴壁法分离雄性大鼠骨髓中MSCs。脱颈处死大鼠,浸泡于75%乙醇中消毒8 min,取出双侧股骨和胫骨。剔除骨组织周围组织后,暴露骨髓腔,用注射器抽取10 mL PBS 冲洗骨髓腔,收集于15 mL离心管中,1000 r/min 离心10 min,弃上清液,用含10%FBS、1%青霉素/链霉素的DMEM 培养液重悬细胞,以5×105个/mL 的细胞密度均匀接种于25 cm2培养瓶中,在37 ℃、5%CO2细胞培养箱中培养。第3 日更换培养液后继续培养,当细胞汇合70%~80%时传代,取3~5 代MSCs 进行后续实验。
2.4 细胞毒性检测
将MSCs 以1×105/mL 的密度接种于96 孔板,24 h 后各孔分别加入0、10、20、30、40、50、60、70、80、90 μmol/L EA,每个浓度设6 个平行孔。孵育72 h 后按照说明书用CCK-8 试剂盒检测各孔细胞活力。使用Graphpad Prism 5.0 处理数据并计算IC50。

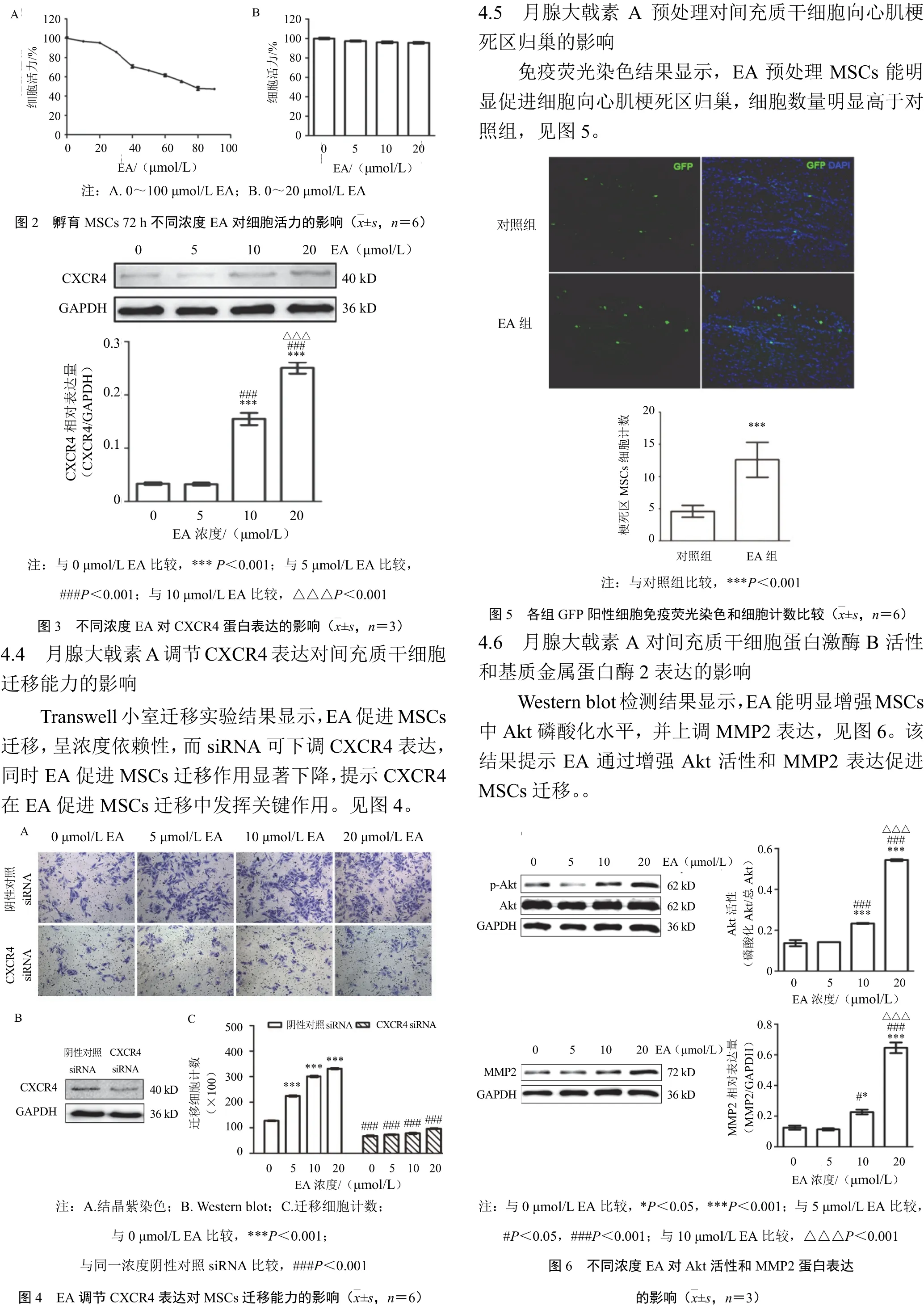
5 讨论
EA 是从中药狼毒中分离提取的一种乙酰间苯三酚类化合物,具有抑制肿瘤细胞增殖的作用[10-11]。目前EA 对干细胞生物学特性的影响尚未见报道。在前期研究中,我们构建了293-CXCR4 细胞株,通过双荧光素酶报告基因检测技术筛选出能够激活CXCR4启动子的中药单体EA[8]。本研究进一步明确EA 增强CXCR4 启动子活性的量效关系。同时我们发现低浓度(0~20 μmol/L)EA 对MSCs 无明显细胞毒性。在此基础上,应用Transwell 实验,发现EA 具有增强MSCs 向SDF-1 迁移的作用,且与EA 浓度呈正相关。应用大鼠心肌梗死模型,体内实验进一步证实EA 具有促进MSCs 向心肌梗死区迁移的作用。
CXCR4 是EA 促进MSCs 迁移的关键蛋白。应用Western blot 技术,我们发现EA 能上调MSCs 的CXCR4 蛋白表达,且与EA 浓度呈正相关。因此,CXCR4 可能是参与EA 促进MSCs 向SDF-1 迁移的关键蛋白。为证明这一假设,我们使用siRNA 敲低MSCs 的CXCR4 表达,结果显示EA 促进MSCs 迁移的能力明显减弱。因此认为,CXCR4 是EA 促进MSCs迁移的关键蛋白。
Akt 和MMP2 是SDF-1/CXCR4 信号通路下游重要的信号分子,在细胞迁移中发挥重要作用[12-13]。为进一步探索EA 促进MSCs 迁移的分子机制,我们应用Western blot 技术检测EA 对MSCs Akt 活性和MMP2 表达的影响,结果显示EA 能增强MSCs 的Akt 活性,并促进MMP2 表达。
综上,本研究首次揭示EA 通过上调CXCR4 表达促进MSCs 迁移的作用和分子机制,能为干细胞治疗心肌梗死提供先导化合物。

