长链非编码RNA RUSC1-AS1对肝细胞癌恶性生物学行的影响及其与微小RNA-326的关系
陈怡文,郭冰沁,李洪涛
(1.赣州市第三人民医院/赣南医学院附属老年医院 老年科,江西 赣州 341000;蚌埠医学院第一附属医院 2.病理科 3.肿瘤外科,安徽 蚌埠 233004)
肝细胞癌(以下简称肝癌)是世界常见的恶性肿瘤之一,我国肝癌患者病死率在世界上占较高比例,癌细胞肝内转移是患者术后复发的重要原因[1-2]。细胞增殖和凋亡调控的失衡是引起肿瘤发生发展的重要原因[3];肝癌细胞的迁移、侵袭是导致癌其转移的重要因素[4]。然而,介导肝癌增殖、迁移、侵袭和凋亡的潜在分子机制尚未完全不清楚。长链非编码RNA(long noncoding RNA,lncRNA)是一类长度>200 nt的非编码RNA,其可通过多种方式发挥其生物学功能,研究[5-7]表明lncRNA可以作为一种竞争性内源性RNA(competing endogenous RNA,ceRNA)与微小RNA(microRNA,miRNA)相互作用,参与调控靶基因的表达,在肿瘤的发生发展中发挥重要的作用。大量研究[8-10]表明,lncRNA在肿瘤的发生发展过程中起重要作用,可调控细胞增殖、分化、凋亡、迁移、侵袭等过程。既往研究发现敲除lncRNACASC15可以通过Y染色体上的性别决定区相关高迁移率族盒蛋白4(sexdertermining region of Y chromosome related high mobility group box 4,SOX4)/Wnt/β-连环蛋白(β-catenin)信号通路明显抑制肝癌细胞的增殖,迁移和侵袭,并在体外促进细胞凋亡[11]。沉默lncRNA LEF1-AS1可以抑制肝癌细胞的增殖和侵袭,且可抑制体内肿瘤的生长[12]。RUSC1-AS1是一个新发现的肿瘤相关的lncRNA,研究[13]表明RUSC1-AS1在乳腺癌组织中高表达,其表达水平与肿瘤大小和临床等级呈正相关,而与患者的整体生存呈负相关;沉默RUSC1-AS1显著抑制了乳腺癌MCF-7和BT549细胞的活力、克隆能力及细胞周期进程并诱导了其凋亡。RUSC1-AS1在喉鳞状细胞癌中上调表达,非甲基化可调节RUSC1-AS1的表达,且RUSC1-AS1与可能是喉鳞状细胞癌的重要预后生物标志物[14]。然而lncRNA RUSC1-AS1在肝癌中的表达和功能国内外尚未见报道。笔者前期采用Starbase预测显示,lncRNA RUSC1-AS1和微小RNA-326(miR-326)存在结合位点。因此,本研究检测lncRNA RUSC1-AS与miR-326在肝癌及癌旁组织中的表达,通过分子生物学实验分析lncRNA RUSC1-AS表达对肝癌细胞增殖、迁移、侵袭和凋亡的影响及其与miR-326的关系。
1 材料与方法
1.1 一般资料
收集2017年1月—2019年12月收治的肝癌患者经手术切除的肝癌组织及对应的癌旁组织(距离肿瘤边缘2~5 cm)标本41例,其经病理检测确认为肝癌,患者手术前未进行过手术及放化疗,所有患者均知情且签署知情同意书,本研究经本院伦理委员会审核批准。
1.2 主要材料
肝癌MHCC97-H细胞购自美国ATCC;胎牛血清、RPMI-1640培养基购自美国Gibco公司;胰蛋白酶购自美国Sigma公司;TRIzol试剂、反转录试剂盒、荧光定量试剂盒购自日本Takara公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;miR-326模拟物/抑制物、lncRNA RUSC1-AS1表达抑制质粒及各自阴性对照购自广州锐博生物技术有限公司;四甲基偶氮唑盐比色法(MTT)试剂盒购自武汉益普生物科技有限公司;RIPA蛋白裂解液购自北京百奥莱博科技有限公司;二辛可宁酸(bicinchoninic acid,BCA)试剂盒购自美国Bio-world公司;聚偏二氟乙烯膜购自美国Millipore公司;ECL发光液购自美国Advansta公司;cyclin D1抗体购自美国Biorbyt公司;P21、MMP-2、MMP-9、Bcl-2、Bax、GAPDH抗体购自美国Abbiotec公司;Transwell小室、Matrigel胶购自美国BD公司;膜联蛋白V-异硫氰酸荧光素/碘化丙锭(annexin V-FITC/PI)凋亡检测试剂盒购自上海BestBio贝博生物公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;荧光素酶报告载体购自江苏百奥迈科生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养与分组肝癌MHCC97-H 细胞用含10% 胎牛血清的RPMI-1640 培养液在37 ℃、5% CO2条件下培养,2 d 换液1 次,待细胞融合至80%~90% 左右时,用胰蛋白酶进行消化传代,取对数生长期细胞进行实验。取对数生长期MHCC97-H 细胞,按照每孔2×105个细胞接种于六孔板中,待细胞贴壁后根据LipofectamineTM2000 说明书进行转染,将lncRNA RUSC1-AS1表达抑制质粒(si-RUSC1-AS1 组)/ 阴性对照质粒(si-NC 组)、miR-326 模拟物(miR-326组)/ 阴性对照序列(miR-NC 组)分别转染至MHCC97-H 细胞中;将lncRNA RUSC1-AS1 表达抑制质粒分别与miR-326 抑制物(si-RUSC1-AS1+anti-miR-326 组)及其阴性对照序列(si-RUSC1-AS1+anti-miR-NC 组)转染至MHCC97-H细胞中。
1.3.2 qRT-PCR 检测lncRNA RUSC1-AS1 和miR-326 的表达水平用TRIzol 试剂提取组织和细胞中的总RNA,将RNA 反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,每个样品设3 个重复,循环条件为95 ℃ 5 min,95℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40 个循环;60 ℃延长5 min。相对表达量用2-△△Ct法计算。lncRNA RUSC1-AS1 和miR-326 分别以GAPDH 和U6 为内参,lncRNA RUSC1-AS1 上游引物序列:5'-CAG GGT CCC ACT ATG TTG CT-3',下游引物序列:5'-CCA TTT TAT AGG CGG GGA GT-3';GAPDH上游引物序列:5'-TGT TGC CAT CAA TCA CCC CTT-3',下游引物序列:5'-CTC CAC GAC GTA CTC AGCG-3';miR-326 上游引物序列:5'-CAT CTG TCT GTT GGG CTG GA-3',下游引物序列:5'-AGG AAG GGC CCA GAG GCG-3';U6 上游引物序列:5'-CGG GTT TGT TTT GCA TTT CT-3',下游引物序列:5'-AGT CCC AGC ATG AAC AGC TT-3';引物由上海生工生物工程公司合成。
1.3.3 MTT 法检测细胞增殖取对数生长期MHCC97-H 细胞,按照每孔5×104个细胞接种于六孔板中,在各组细胞培养至24、48、72 h时,每孔分别加入5 mg/mL 的MTT 溶液20 μL,于培养箱中继续孵育4 h 后弃去上清液,每孔加入DMSO 150 μL,振荡反应10 min 使沉淀溶解,用酶标仪于波长450 nm 处检测吸光度(OD)值。
1.3.4 Western blot 法检测cyclin D1、P21、MMP-2、MMP-9、Bcl-2、Bax 蛋白表达用RIPA 蛋白裂解液提取细胞总蛋白,用BCA 试剂盒进行蛋白定量。各组蛋白上样量60 μg,进行聚丙烯酰胺凝胶电泳,经电转将蛋白转移至聚偏二氟乙烯膜上。用5% 脱脂牛奶室温封闭90 min,分别加入相应的一抗(1:800),4 ℃孵育过夜,PBS洗涤3 次,每次5 min;再加入二抗(1:1 200)室温孵育2 h,PBS 洗涤3 次,每次10 min,后在暗室中用ECL 发光液显影,用ChemiDoc XRS+ 系统成像,再用Quantity One 凝胶分析软件处理,测定各组蛋白条带的灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.3.5 Transwell 检测细胞迁移和侵袭细胞迁移实验:分别将600 μL 含胎牛血清的RPMI-1640 完全培养液和200 μL 细胞悬液加入Transwell 小室的下室和上室中,放入细胞培养箱中培养24 h。取出小室,吸去培养液后用棉签轻轻擦去上层细胞,PBS 洗涤,4%多聚甲醛固定30 min,再用0.1%结晶紫染色10 min,显微镜观察并拍照,计算结晶紫染色细胞数即为迁移细胞数。细胞侵袭实验:将60 μL Matrigel 与300 μL 无血清的RPMI-1640培养液中混匀,然后取100 μL 平铺于Transwell小室的上室,凝固后按细胞迁移实验操作进行。
1.3.6 流式细胞仪检测细胞凋亡取转染48 h 后生长状态良好的细胞,吸弃上清液,PBS 漂洗细胞2 次,吸弃PBS 液,加1~2 mL 胰酶消化细胞使之脱壁,静置5~8 min,轻摇使之形成均匀细胞悬液,结合缓冲液终止消化,分别加annexin V-FITC和PI 各5 μL,轻摇混匀,常温避光孵育15 min,上流式细胞仪检测细胞凋亡率。每组设3 个复孔,实验重复3 次。
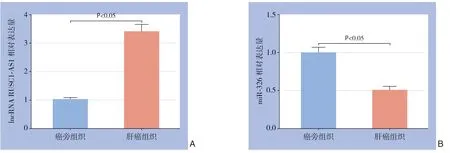
图1 qRT-PCR 检测结果Figure 1 Results of qRT-PCR detection
1.3.7 荧光素酶报告实验检测lncRNA RUSC1-AS1 和miR-326 的靶向关系构建lncRNA RUSC1-AS1 的野生型和突变型的荧光素酶表达载体质粒WT-RUSC1-AS1 和MUT-RUSC1-AS1,用LipofectamineTM2000 将WT-RUSC1-AS1 和MUTRUSC1-AS1 质粒分别与miR-326 模拟物及相应的对照序列共转染至293T 细胞中。转染48 h 后按照说明书检测荧光素酶活性。
1.4 统计学处理
采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差(±s)表示,两组比较行t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 lncRNA RUSC1-AS1 和miR-326 在肝癌组织中的表达
应用qRT-PCR检测41例肝癌组织和癌旁组织中lncRNA RUSC1-AS1和miR-326的表达水平,结果显示,与癌旁组织比较,肝癌组织中RUSC1-AS1表达水平明显升高,miR-326表达水平明显降低(均P<0.05)(图1)。
2.2 干扰lncRNA RUSC1-AS1 表达对MHCC97-H 细胞增殖的影响
与si-NC组比较,si-RUSC1-AS1组MHCC97-H细胞中RUSC1-AS1表达水平明显降低,24、48、72 h细胞OD值明显降低,cyclin D1蛋白表达水平明显降低,P21 蛋白表达水平明显升高(均P<0.05)(图2)。
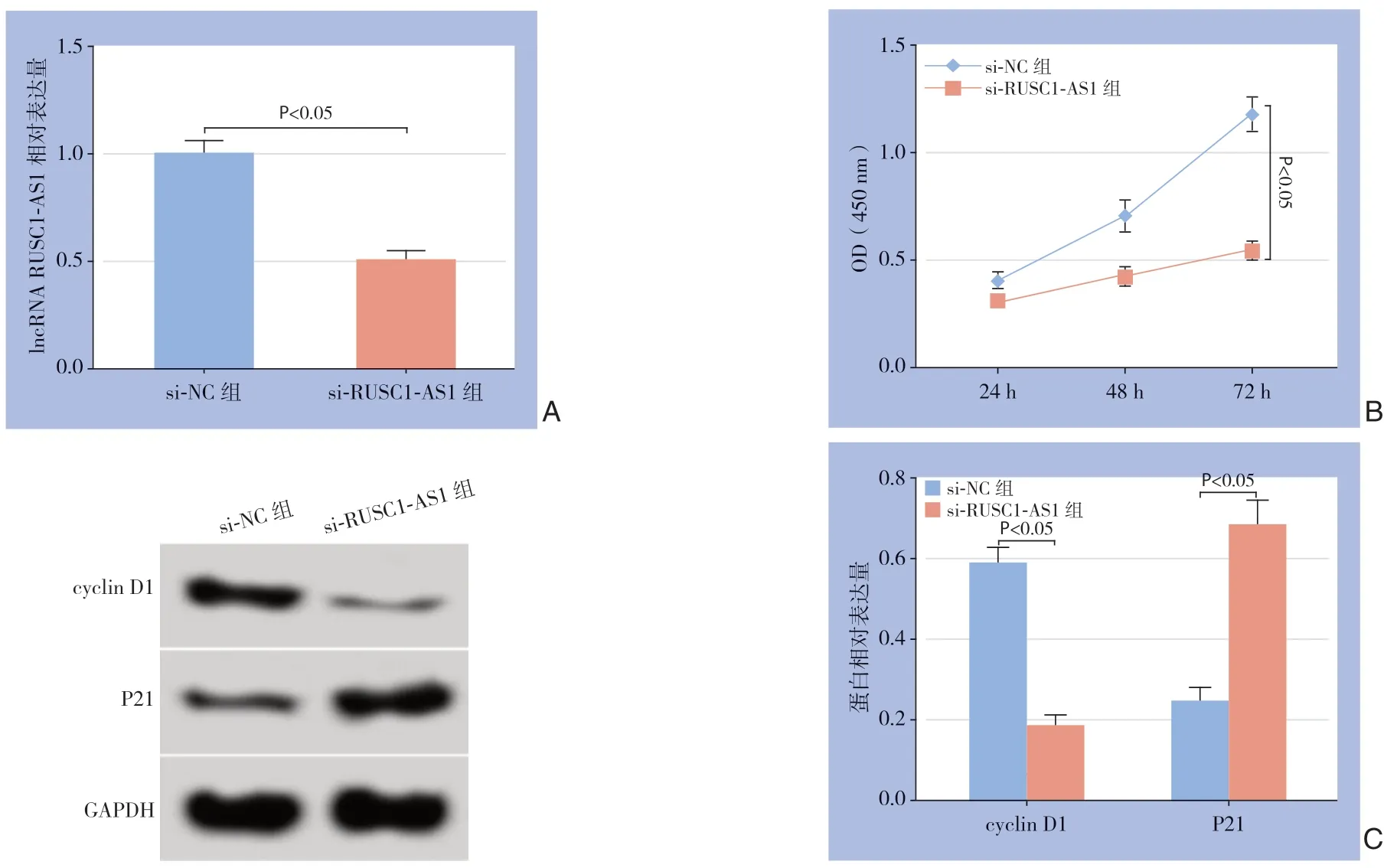
图2 干扰lncRNA RUSC1-AS1 表达对MHCC97-H 细胞增殖的影响Figure 2 Influence of lncRNA RUSC1-AS1 interference on proliferation of MHCC97-H cells
2.3 干扰lncRNA RUSC1-AS1 表达对MHCC97-H细胞迁移、侵袭的影响
与si-NC组比较,si-RUSC1-AS1组MHCC97-H细胞迁移、侵袭数明显降低,MMP-2、MMP-9蛋白表达水平明显降低(均P<0.05)(图3)。

图3 干扰lncRNA RUSC1-AS1 表达对肝癌MHCC97-H 细胞迁移、侵袭的影响Figure 3 Influence of lncRNA RUSC1-AS1 interference on migration and invasion of MHCC97-H cells
2.4 干扰lncRNA RUSC1-AS1 表达对MHCC97-H细胞凋亡的影响
与si-NC组比较,si-RUSC1-AS1组MHCC97-H细胞凋亡率明显升高,Bcl-2蛋白表达水平明显降低,Bax蛋白表达水平明显升高(均P<0.05) (图4)。

图4 干扰lncRNA RUSC1-AS1 表达对肝癌MHCC97-H 细胞凋亡的影响Figure 4 Influence of lncRNA RUSC1-AS1 interference on apoptosis of MHCC97-H cells
2.5 miR-326 过表达对MHCC97-H 细胞增殖、迁移、侵袭和凋亡的影响
与miR-NC组比较,miR-326组MHCC97-H细胞中miR-326表达水平明显升高,24、48、72 h细胞OD值明显降低,细胞迁移、侵袭数明显降低,细胞凋亡率明显升高,cyclin D1、MMP-2、MMP-9、Bcl-2蛋白表达水平明显降低,P21、Bax蛋白表达水平明显升高(P<0.05)(图5)。
2.6 干扰lncRNA RUSC1-AS1 表达同时抑制miR-326 表达对MHCC97-H 细胞增殖、迁移侵袭和凋亡的作用
与si-RUSC1-AS1+anti-miR-NC组比较,si-RUSC1-AS1+anti-miR-326组MHCC97-H细胞中miR-326表达水平明显降低,24、48、72 h细胞OD 值明显升高,细胞迁移、侵袭数明显升高,细胞凋亡率明显降低,cyclinD1、MMP-2、MMP-9、Bcl-2蛋白表达水平明显升高,P21、Bax蛋白表达水平明显降低(均P<0.05)(图6)。

图5 miR-326 过表达对肝癌MHCC97-H 细胞增殖、迁移、侵袭和凋亡的影响Figure 5 Influence of miR-326 overexpression on proliferation,migration,invasion and apoptosis of MHCC97-H cells
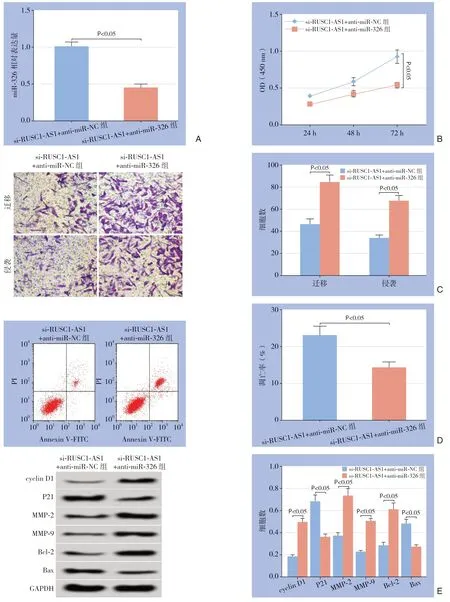
图6 干扰lncRNA RUSC1-AS1 表达同时抑制miR-326 表达对MHCC97-H 细胞增殖、迁移侵袭和凋亡的作用Figure 6 Influence of lncRNA RUSC1-AS1 interference with miR-326 inhibition on proliferation,migration,invasion and apoptosis of MHCC97-H cells
2.7 lncRNA RUSC1-AS1 靶向调控miR-326 的表达
StarBase在线软件预测显示lncRNA RUSC1-AS1与miR-326存在互补的核苷酸序列(图7A)。在MHCC97-H细胞中共转染miR-326模拟物或阴性对照序列和WT-RUSC1-AS1或MUT-RUSC1-AS1,双荧光素酶报告实验结果显示(图7B),过表达miR-326明显降低包含WT-RUSC1-AS1质粒的荧光素酶活性(P<0.05),但不影响包含MUTRUSC1-AS1质粒的荧光素酶活性(P>0.05)。qRT-PCR检测测转染lncRNA RUSC1-AS1过表达质粒、干扰质粒或阴性对照序列的MHCC97-H细胞中miR-326 表达水平,结果显示,过表达RUSC1-AS1导致miR-326表达水平明显降低,抑制RUSC1-AS1表达导致miR-326表达水平明显升高(均P<0.05)(图7C)。
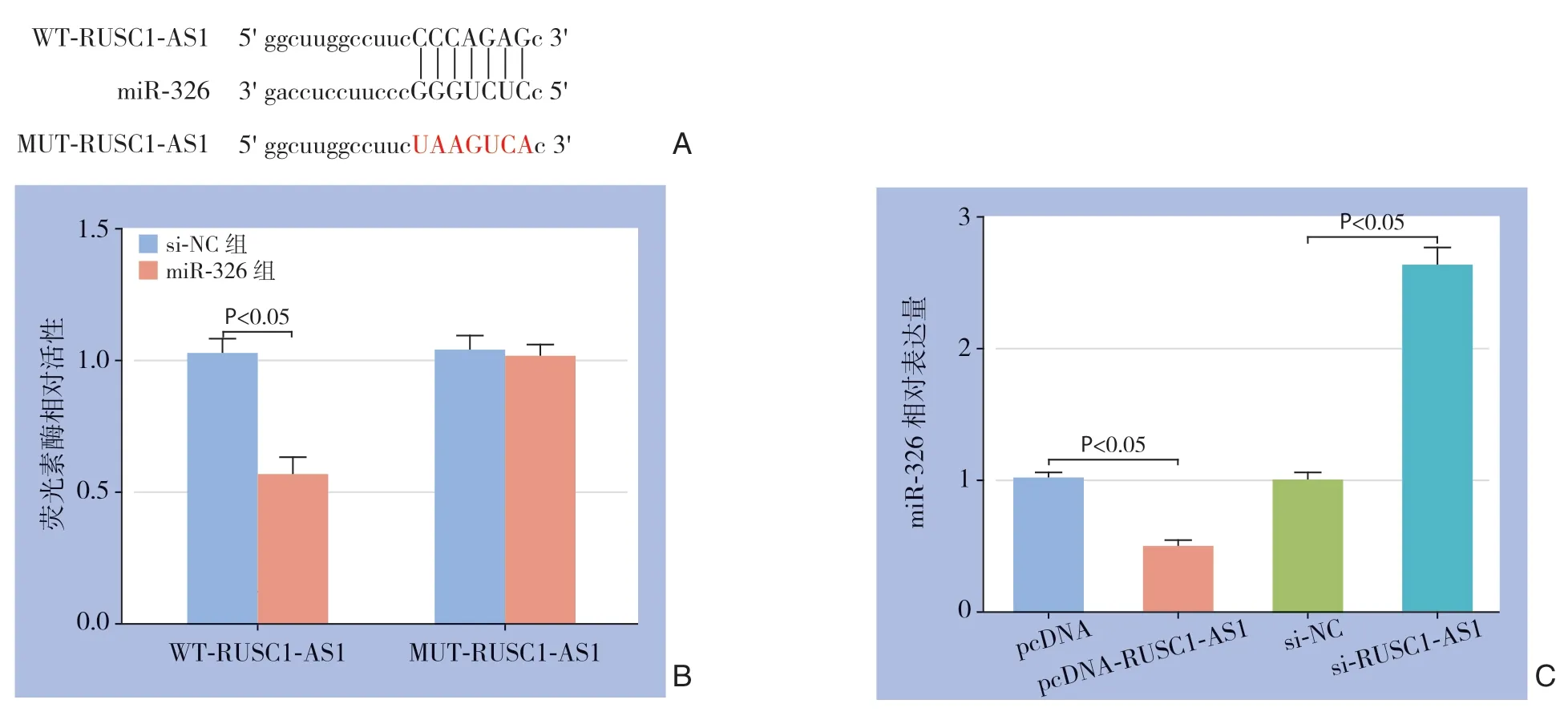
图7 lncRNA RUSC1-AS1 与miR-326 的关系分析Figure 7 Analysis of relationship between lncRNA RUSC1-AS1 and miR-326
3 讨 论
越来越多的研究[15-17]表明lncRNA在肝癌的发生发展中发挥重要的作用,其可能通过调控抑癌或致癌基因起作用。因此,研究影响肝癌的lncRNA对于揭示肝癌发生发展的分子机制至关重要。已有大量研究表明多种lncRNA影响肝癌的进展,如lncRNA LBX2-AS1通过充当miR-384的竞争内源RNA,从而上调胰岛素受体底物1(insulin receptor substrate-1,IRS1)的表达来驱动肝癌的发展;敲低lncRNA LBX2-AS1会减弱肝癌细胞增殖,迁移和侵袭,并在体外诱导其凋亡[18]。LINC01139通过与miR-30家族竞争性结合,通过上调成髓细胞瘤转录因子第2亚型(MYB protooncogene like 2,MYBL2)来促进肝细胞癌的发展;LINC01139可能成为肝癌患者的潜在治疗靶点和预后生物标志物[19]。近年来研究表明lncRNA RUSC1-AS1在人类肿瘤中起重要作用,已有研究[13-14]报道lncRNA RUSC1-AS1在乳腺癌、喉鳞状细胞癌中具有致癌作用。且有研究[20]报道lncRNA RUSC1-AS1在宫颈癌组织和细胞系中高表达,RUSC1-AS1的高表达与宫颈癌患者的FIGO分期,淋巴结转移和较短的总生存期显著相关;干扰lncRNA RUSC1-AS1表达通过上调miR-744抑制了宫颈癌细胞的体外增殖,迁移和侵袭,诱导细胞凋亡;并阻碍体内肿瘤的生长。然而目前lncRNA RUSC1-AS1在肝癌发生发展中的作用尚不清楚。本研究重点研究lncRNA RUSC1-AS1在肝癌组织中的表达,并进一步探究lncRNA RUSC1-AS1对肝癌细胞增殖、迁移、侵袭和凋亡的影响及其潜在的作用机制。
本研究首先在20例肝癌组织和对应的癌旁组织中检测lncRNA RUSC1-AS1的表达差异,结果发现lncRNA RUSC1-AS1在肝癌组织中的表达水平显著高于对应的癌旁组织,表明lncRNA RUSC1-AS1在肝癌组织可能起促癌作用,与在其他癌症中的作用相同。功能试验发现干扰lncRNA RUSC1-AS1表达后,肝癌MHCC97-H细胞在培养至24、48、72 h时细胞OD值显著降低,细胞迁移、侵袭数显著降低,细胞凋亡率显著升高,cyclin D1、MMP-2、MMP-9、Bcl-2蛋白表达水平显著降低,P21、Bax蛋白表达水平显著升高。cyclin D1、P21是细胞周期相关蛋白,其表达水平与细胞增殖有关,cyclin D1是正调控因子,P21是负调控因子,cyclin D1低表达,P21高表达抑制细胞增殖[21]。MMP-2、MMP-9 是基质金属蛋白酶家族成员,其高表达可降解细胞外基质,促进细胞迁移、侵袭[22]。Bcl-2、Bax是调控细胞凋亡的关键因子,Bcl-2是抗凋亡因子,Bax是促凋亡因子,其表达水平可反映细胞凋亡情况[23]。表明干扰lncRNA RUSC1-AS1表达可显著抑制MHCC97-H细胞增殖、迁移和侵袭,并促进细胞凋亡。
研究[24-27]表明miRNA也参与调控肝癌细胞的发生发展过程,影响癌细胞的增殖、凋亡、转移等。有研究[28]报道miR-326在肝癌组织和细胞系中下调表达,miR-326的低表达与肝癌患者的TNM分期,分化和淋巴结转移密切相关;miR-326过表达通过直接靶向LIM和SH3蛋白1(LIM and SH3 protein 1,LASP1)在体外抑制了肝癌细胞的增殖和侵袭,并激活了细胞凋亡。还有研究[29]表明miR-326过表达可显著抑制前列腺癌细胞增殖,集落形成,迁移和侵袭,诱导G0/G1细胞周期阻滞并促进前列腺癌细胞凋亡。上调miR-326显著抑制了乳腺癌细胞生长和集落形成,且阻滞了细胞周期,并诱导了细胞凋亡[30]。本实验结果显示,与癌旁组织相比,miR-326在肝癌组织中表达水平显著升高。过表达miR-326后,肝癌MHCC97-H细胞培养至24、48、72 h时细胞OD值显著降低,细胞迁移、侵袭数显著降低,细胞凋亡率显著升高,cyclin D1、MMP-2、MMP-9、Bcl-2蛋白表达水平显著降低,P21、Bax蛋白表达水平显著升高。说明过表达miR-326可显著抑制MHCC97-H细胞增殖、迁移和侵袭,并促进细胞凋亡。
为进一步研究lncRNA RUSC1-AS1对肝癌细胞的影响的机制是否与miR-326有关,本实验通过StarBase在线软件预测可能与lncRNA RUSC1-AS1结合的miRNA,结果发现lncRNA RUSC1-AS1与miR-326存在结合位点,双荧光素酶报告实验结果证实lncRNA RUSC1-AS1可靶向miR-326。且过表达lncRNA RUSC1-AS1导致miR-326表达水平显著降低,抑制lncRNA RUSC1-AS1表达导致miR-326表达水平显著升高,表明lncRNA RUSC1-AS1确实可调控miR-326的表达。研究报道lncRNA可通过调控miR-326表达影响肿瘤进展,如lncRNA DDX11-AS1通过调节miR-326/IRS1轴促进胃癌的细胞进程和奥沙利铂耐药性[31]。lncRNA TDRG1通过靶向miR-326调节子宫颈癌中丝裂原活化蛋白激酶1(mitogen-activated protein kinase1,MAPK1)的表达来促进细胞增殖、迁移和侵袭[32]。LncRNA SNHG3通过靶向miR-326促进肝细胞肿瘤的发 生[33]。lncRNA H19可以作为ceRNA海绵来修饰miR-326并调节TWIST1表达参与肝细胞癌的发展[34]。本实验结果显示,抑制miR-326表达的同时干扰lncRNA RUSC1-AS1表达,培养24、48、72 h后细胞OD值显著升高,且细胞迁移、侵袭数显著升高,细胞凋亡率显著降低,cyclin D1、MMP-2、MMP-9、Bcl-2蛋白表达水平显著升高,P21、Bax蛋白表达水平显著降低。说明抑制miR-326表达可能逆转了干扰lncRNA RUSC1-AS1表达对肝癌细胞增殖、迁移、侵袭的抑制和凋亡促进作用。
综上所述,肝癌组织中lncRNA RUSC1-AS1异常高表达,干扰lncRNA RUSC1-AS1表达可能通过上调miR-326表达抑制肝癌细胞的增殖、迁移和侵袭,并促进细胞凋亡。lncRNA RUSC1-AS1的异常高表达可能是促进肝癌进展的驱动因素,其可作为生物治疗肝癌的潜在作用靶点。
——一道江苏高考题的奥秘解读和拓展

